贲门癌组织中nm23-H1、MMP-2的表达与临床意义
李良军, 赵元锰, 张灿斌, 张 克, 王光华
贲门癌是我国常见的恶性肿瘤,发病率和死亡率在恶性肿瘤中位于前列。目前虽然在贲门癌的早期诊断与综合治疗方面取得较大进展,但大多数中晚期患者综合治疗后的5年生存率仍不超过24%[1]。导致患者死亡的主要原因是肿瘤细胞的扩散与转移,约有45%的患者死于转移、复发。探讨肿瘤转移相关基因,分析其与贲门癌生物学行为的相关性有重要的临床意义。贲门癌的发生发展是一个多因素和多阶段演变的过程,该过程与多种原癌基因激活及抑癌基因失活,肿瘤转移抑制基因失活相关[2]。
nm23是第一个被分离出来的肿瘤转移抑制基因。nm23-H1基因是nm23基因家族成员之一,与人类恶性肿瘤侵袭转移关系较密切,其表达水平与多种肿瘤转移行为和预后相关[3]。基质金属蛋白酶家族(MMPs)中的MMP-2被认为是参与降解基底膜(BM)和细胞外基质(ECM),影响组织的重塑并促进肿瘤的浸润、转移和血管生成的主要成分[4]。本研究采用免疫组化SP法联合检测肿瘤转移抑制基因nm23-H1和基质金属蛋白酶MMP-2在贲门癌中的表达,探讨nm23-H1和MMP-2与贲门癌的浸润、转移、临床病理分期的关系,为贲门癌的临床防治提供科学依据。
1 资料与方法
1.1 标本收集及制作 收集2005—2009年河南科技大学第一附属医院手术切除并经病理确诊的贲门癌57例资料。全部病例临床资料完整。贲门癌病例的肿瘤中心均位于齿状线上1 cm至齿状线下2 cm范围内,符合Siewert贲门癌的分型标准[5]。男39例,女18例;年龄32~78岁,平均63.8岁;高分化腺癌14例,中分化腺癌21例,低分化腺癌22例;淋巴结转移阳性32例,淋巴结转移阴性25例。所有病例术前均未经放化疗。另外收集正常贲门黏膜25例作为对照组。全部标本均经10%福尔马林溶液固定,常规石蜡包埋,4 μm厚度连续切片,分别进行常规HE染色和免疫组化染色。实验所用试剂nm23-H1单克隆抗体购自武汉博士德生物工程有限公司,MMP-2单克隆抗体及SP试剂盒、DAB显色剂等均购自北京中杉金桥生物工程有限公司。
1.2 实验方法 采用免疫组化SP法检测贲门组织中nm23-H1和MMP-2表达情况。将组织切片经过二甲苯脱蜡,梯度酒精脱水后,用柠檬酸盐缓冲液高压热修复抗原,严格按照试剂盒说明的步骤操作,DAB显色,苏木素复染,中性树胶封固玻片。用PBS代替一抗作阴性对照。
1.3 结果判断 在正常贲门黏膜及贲门癌组织中nm23-H1和MMP-2阳性表达均定位于细胞浆内,呈棕黄色颗粒样物质。高倍镜下(×400)随机选取10个视野,按细胞染色的百分率及染色的深浅程度采用二级计分法判定阳性结果。(1)细胞染色率<10%为0分,10% ~25%为1分,25% ~50%为2分,50% ~75%为3分,>75%记为4分;(2)按染色的深浅程度计分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。二者计分相乘数值>1者判定为阳性[6]。
1.4 统计学处理 所有数据采用SPSS17.0统计软件包进行分析,数据资料用χ2检验和Fisher精确概率法计算,相关性采用Spearman等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 正常贲门黏膜与贲门癌组织中nm23-H1和MMP-2的阳性表达 nm23-H1阳性表达呈颗粒状定位于细胞浆中,浅黄色至棕黄色。比较正常贲门黏膜及贲门癌组织中nm23-H1的阳性表达率,前者明显高于后者(23/25 vs.14/57),二者具有显著差异性(χ2=31.918,P <0.01);MMP-2 阳性着色呈颗粒状定位于细胞浆,黄色至棕黄色。MMP-2在正常贲门黏膜中的阳性表达率明显低于贲门癌组织(5/25 vs.42/57),有显著差异性(χ2=20.472,P <0.01)。见表1。

表1 正常贲门黏膜与贲门癌组织中nm23-H1和MMP-2的阳性表达率
2.2 MMP-2和nm23-H1在贲门癌中的表达与临床病理指标的关系 MMP-2的阳性表达与肿瘤浸润深度、淋巴结转移及组织学分级相关(P<0.05,P<0.01,P < 0.01),与年龄、性别无关(P > 0.05);nm23-H1蛋白表达与肿瘤浸润深度及淋巴结转移密切相关(P <0.01,P <0.05),与性别、年龄及组织学分级无相关性(P>0.05)。见表2。
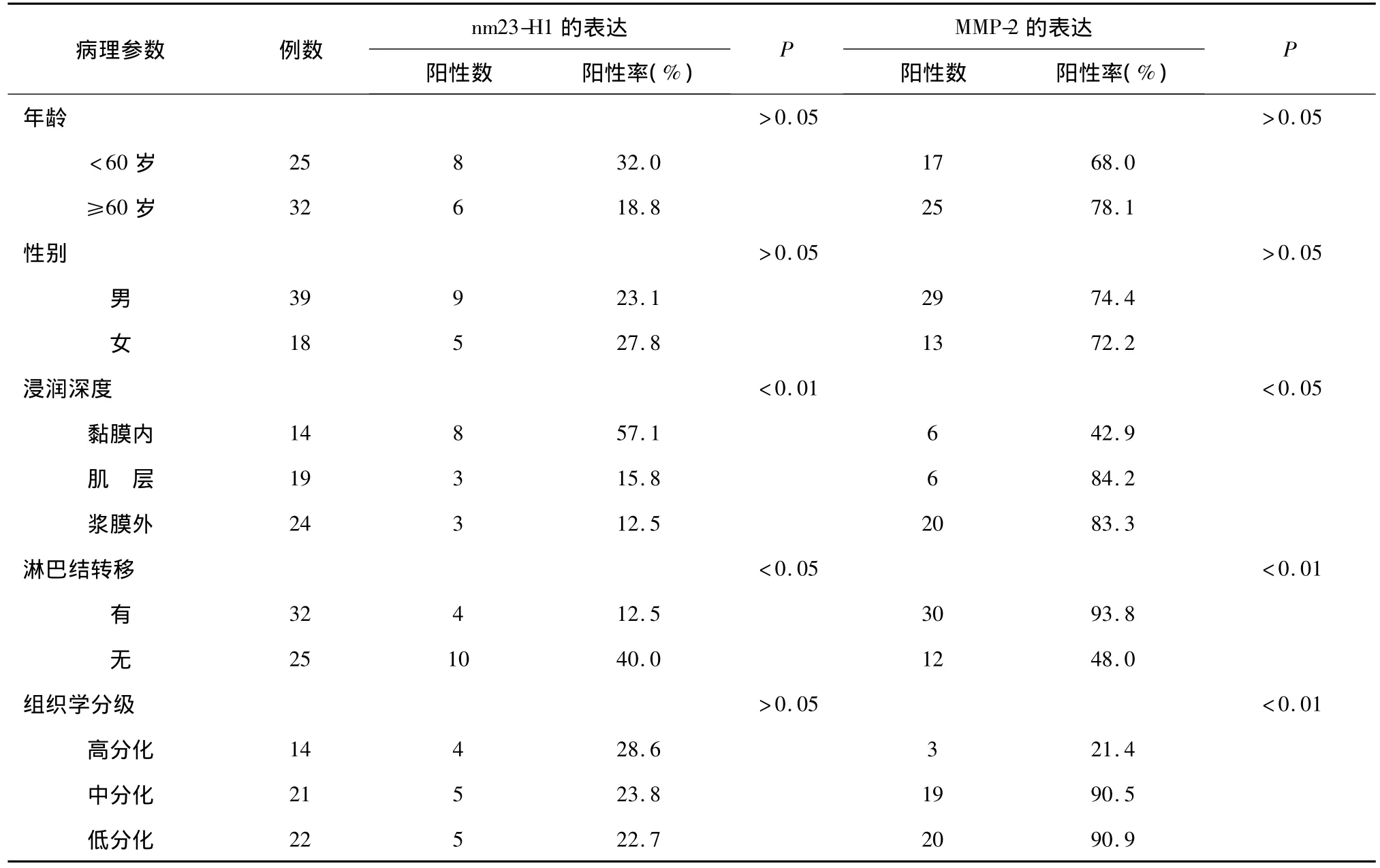
表2 nm23-H1和MMP-2在贲门癌组织中的阳性表达与病理参数间的关系
2.3 nm23-H1和MMP-2在贲门癌组织中阳性表达的相关性分析 nm23-H1阳性表达的14例中MMP-2阳性占4例,nm23-H1阴性表达的43例中MMP-2阳性占38例;MMP-2蛋白阳性表达的42例中nm23-H1阳性4例,MMP-2阴性表达的15例中nm23-H1阳性占10例;二者均阴性共5例。nm23-H1与MMP-2阳性表达率呈显著负相关,两者差异具有统计学意义(r= - 0.585,χ2=19.478,P <0.01),见表3。

表3 nm23-H1和MMP-2在贲门癌组织中的表达关系
3 讨论
肿瘤的发生与癌基因和抑癌基因的异常关系密切,但在肿瘤浸润转移这一特定阶段,涉及到转移促进基因和转移抑制基因表达异常。nm23是第一个被发现的肿瘤转移抑制基因,nm23-H1是nm23肿瘤抑制基因家族中的代表,与肿瘤转移的抑制关系十分密切。定位于17号染色体长臂(17q22),主要表达产物为二磷酸核苷激酶(NDPK),参与体内磷酸核苷的生成,通过影响微管聚合状态参与G蛋白的信号传递和微管聚合酶的活化而调节细胞代谢,在肿瘤细胞增殖、分化和侵袭转移中起重要作用,其活性与肿瘤细胞转移及增生过程有关[7]。nm23-H1的表达与乳腺癌、肺癌、肝癌、食管癌、恶性黑色素瘤、卵巢癌、膀胱癌等多种恶性肿瘤的高转移潜能显著负相关,被认为是显著的转移抑制基因[8]。但是由于肿瘤转移过程中信号转导途径的复杂性及调控的网络性,nm23-H1表达水平虽可对判断某些肿瘤浸润深度及淋巴结转移起重要参考作用,但其在临床诊断中尚不能作为肿瘤独立的综合预后因子[9]。本研究发现,正常贲门黏膜与贲门癌组织相比,nm23-H1阳性表达率明显下降,差异具有统计学意义(P<0.01),提示nm23-H1具有一定抑制肿瘤转移的活性,其表达的缺失可能引起肿瘤的转移,使肿瘤细胞侵袭力更强。
基质金属蛋白酶(MMPs)是一类依赖锌离子的内肽酶,属重要的蛋白水解酶类,经典型MMP以水溶性酶原形式被分泌至胞外,在激活剂的作用下脱去前肽而具有蛋白水解酶活性,通常由内皮细胞、巨噬细胞、粒细胞及结缔组织细胞分泌,能降解细胞外基质(ECM)及基底膜(BM)类纤维胶原,在肿瘤的浸润与转移过程中起重要作用。MMP-2是MMPs家族重要成员之一,分子量72 KD,激活后的MMP-2能降解ECM及BM中的Ⅳ型、Ⅴ型胶原和纤维连接蛋白成分,导致基底膜破坏,肿瘤细胞浸润结缔组织基质,侵入小血管和淋巴管而发生转移[10]。关于MMP-2与肿瘤浸润、转移的关系国内外已有大量的实验研究,原位杂交技术揭示了结肠癌间质细胞能合成MMP-2,并与癌细胞共同参与浸润癌特异性组织重塑和基底膜降解过程[11]。本研究结果显示MMP-2在正常贲门黏膜组织中阳性表达率较低,而在贲门癌组织中阳性表达率较高,两者差异有显著统计学意义(P<0.01),且与贲门癌的浸润深度、淋巴结转移及组织学分级密切相关(P<0.05),提示其表达增高能促进贲门癌的浸润与转移。
本实验结果还显示,在贲门癌组织中nm23-H1与MMP-2的表达两者之间存在显著负相关(r=-0.585,P <0.01),nm23-H1 的低表达提示其抑癌基因功能的缺失,进而导致肿瘤细胞信号传导异常,并进一步促使MMP-2基因的转录表达增高,导致BM与ECM降解,加速贲门癌细胞的侵袭转移。随着肿瘤浸润程度的加深与淋巴结转移的进展,nm23-H1阳性表达率减低,MMP-2的阳性表达率增高,这与肿瘤的临床病理分期密切相关,提示二者的表达可能为复杂肿瘤信号转导调控网络的组成部分,前者属上游调控基因[12],其详细机制有待进一步研究。联合对nm23-H1与MMP-2蛋白表达的检测可能成为临床判断贲门癌分化及浸润转移潜能的重要参考指标,并提示其早期诊断的可能。
[1] de Manzoni G,Pedrazzani C,Pasini F,et al.Results of surgical treatment of adenocarcinoma of the gastric cardia[J].Ann Thorac Surg,2002,73(4):1035-1040.
[2] Rugge M,Cassaro M,Di Mario F,et al.The long term outcome of gastric non-invasive neoplasia[J].Gut,2003,52(8):1111-1116.
[3] Baba H,Urano T,Okada K,et a1.Two isotypes of murine nm23/nucleoside diphosphate kinase,nm23-M1 and nm23-M2,are involved in metastatic suppression of a murine melanoma line[J].Cancer Res,1995,55(9):1977-1980.
[4] 宋牧,倪多,朱丽萍.VEGF、MMP-2在乳腺癌中的表达及其临床意义[J].新疆医科大学学报,2008,31(1):57-59.
[5] Siewert JR,Stein HJ.Carcinoma of the gastroesophageal junction classification,pathology and extent of resection[J].Dis Esophagus 1996,9:173-182.
[6] Lu CD,Altieri DC,Tanigawa N.Expression of a novel antiapoptosis gene,survivin,correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas[J].Cancer Res,1998,58(9):1808-1812.
[7] Chen JQ,Zhan WH,He YL,et a1.Expression of heparanase gene,CD44v6,MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas[J].World J Gastroenterol,2004,10(6):776-782.
[8] Lacombe ML,Milon L,Munier A,et al.The human nm23/nucleoside dispaosphate kinases[J].Bioenerg Biomembr,2000,32(3):247-258.
[9] 王亚莉,王建刚,刘琳.食管鳞癌nm23-H1及基质金属蛋白酶-7蛋白表达的临床病理意义[J].新乡医学院学报,2008,25(1):23-26.
[10] Okada E,Murai Y,Matsui K,et al.Survivin expression in tumor cell nuclei is predictive of a favorable prognosis in gastric cancer patients[J].Cancer Lett,2001,163(1):109-116.
[11] 黄启普,耿排力,吕同德,等.胃癌组织中survivin、MMP-2及nm23的表达及其临床意义[J].青海医学院学报,2006,27(1):1-4.
[12] Zhou Q,Yang X,Zhu D,et a1.Double mutant P96S/S120G of Nm23-H1 abrogates its NDPK activity and motility-suppressive ability[J].Biochem Biophys Res Commun,2007,356(2):348-353.

