重组人血管内皮抑素联合白介素-2灌注治疗恶性胸/腹腔积液的临床研究Δ
王 锴,朱志图,哈敏文,郁云龙,李恩泽,刘阳阳(辽宁医学院附属第一医院肿瘤科,锦州市 121001)
恶性胸/腹腔积液是晚期肿瘤的常见并发症,严重影响患者的生存质量,常采用胸/腹腔内局部用药,但总体疗效欠佳,尤其对美国东部肿瘤协作组(ECOG)体力状况评分标准(PS)评分>2分的患者,治疗难度增大。重组人血管内皮抑素具有抑制肿瘤血管内皮细胞迁移和增生的作用,临床应用以静脉为主,而胸/腹腔局部用药报道较少。我院2007年4月~2009年4月应用重组人血管内皮抑素联合白介素-2(IL-2)胸/腹腔灌注治疗PS评分>2且已失去手术及放化疗机会的恶性胸/腹腔积液患者,取得了一定疗效,现报道如下。
1 资料与方法
1.1 临床资料
1.1.1 入组标准:经病理学及细胞学检查证实为恶性肿瘤;有可测量的病灶;年龄18~75岁,PS评分>2,预计生存期≥2个月;血常规、肝肾功能、心功能基本正常;既往未经任何灌注治疗;既往对生物制剂无过敏反应;自愿接受重组人血管内皮抑素及IL-2治疗,签署知情同意书。
1.1.2 排除标准:无可测量病灶;正接受其他抗肿瘤治疗者;既往对生物制剂有过敏反应;原发性脑瘤或中枢神经系统转移瘤病情未控制者;有化脓性及慢性感染性伤口迁延不愈者;有重要脏器功能不全和严重心脏病者;妊娠或哺乳期妇女;有不易控制的精神病史者。
1.2 研究方法
59例患者采用顺序法随机分成试验组与对照组,男性33例,女性26例(见表1)。全部患者均经B超诊断(中~大量积液)定位后,按无菌操作规范行经皮中心静脉导管浆膜腔内置入引流,尽量引流干净后,试验组腔内注入用生理盐水20 mL稀释的IL-2 200万IU,3 d后予以重组人血管内皮抑素60 mg+生理盐水40 mL,每次灌注后嘱患者每半小时变换体位,共4次,使药物在腔内均匀分布;对照组单纯予以IL-2治疗。原则上每周给药1次,每周复查B超观察积液量情况,如果积液在注药1次后增长速度显著减慢,则下一次注药根据患者体质和B超复查结果可适当延长,间隔最长不超过2周。

表1 2组临床资料比较(n)Tab 1 Comparison of clinical information between two groups(n)
1.3 评价标准
1.3.1 客观疗效:根据世界卫生组织(WHO)通用疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、稳定或无变化(SD)、进展(PD)。其中,CR是指治疗后积液完全消失,维持4周以上;PR是指积液减少一半以上,维持4周以上;SD是指积液减少不足一半或增多不超过25%,维持4周以上;PD是指积液进一步增加并超过以前25%[1]。以CR+PR计算有效率,CR+PR+SD计算临床获益率(CBR);总生存时间(OS)指从治疗开始至死亡的时间。
1.3.2 生活质量:参照卡氏功能状态评分标准(KPS)评分变化评价。治疗后KPS评分增加10分为改善,无增加为稳定,减少10分为下降。
1.3.3 毒副反应:按WHO抗癌药物毒性的分度标准[1](0~Ⅳ度)进行评价。
1.4 统计学方法
使用SPSS 16.0进行统计学处理。计数资料采用χ2检验,均值比较采用t检验,以P<0.05为差异有统计学意义。生存率的计算采用Kaplan-Meier生存曲线。
2 结果
2.1 疗效
试验组30例患者共接受94个周期治疗,平均3.1个周期;对照组29例共接受88个周期,平均3.0个周期。试验组无论是有效率还是CBR都优于对照组(见表2)。研究随访至2009年10月,试验组OS为118.34 d,对照组为110.37 d,2组无明显差异(见图1)。试验组有1例失访,对照组有2例失访。
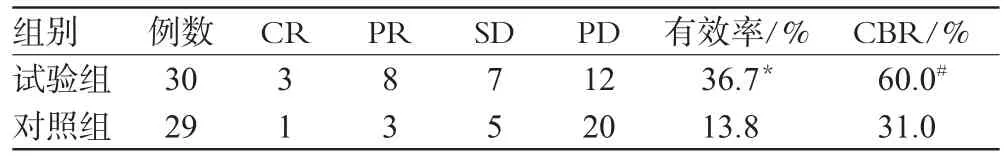
表2 2组近期疗效比较(n)Tab 2 Comparison of short-term efficacy between two groups(n)
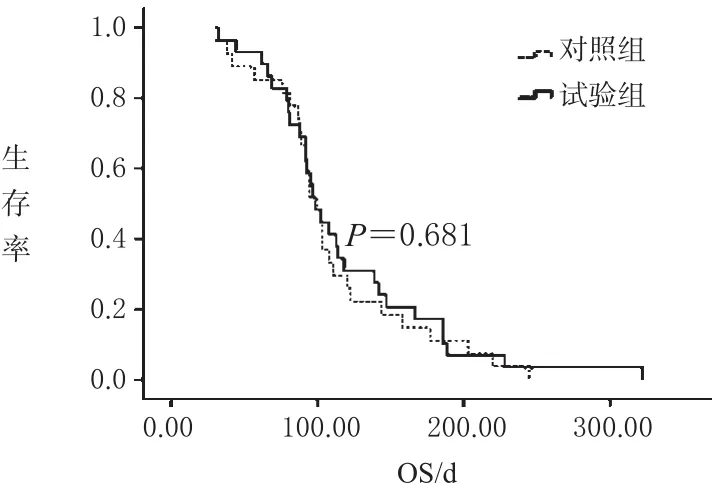
图1 2组生存率比较Fig 1 Comparison of survival rate between two groups
2.2 生活质量
试验组KPS评分改善16例,稳定10例,下降4例;对照组改善7 例,稳定11例,下降11例,χ2=6.821,P=0.033,试验组优于对照组。
2.3 毒副反应
59例均顺利完成治疗,主要副反应为发热和胃肠道反应(见表3)。试验组5例出现心悸,心电图示2例窦性心动过速,2例ST-T段改变,1例房性期前收缩。
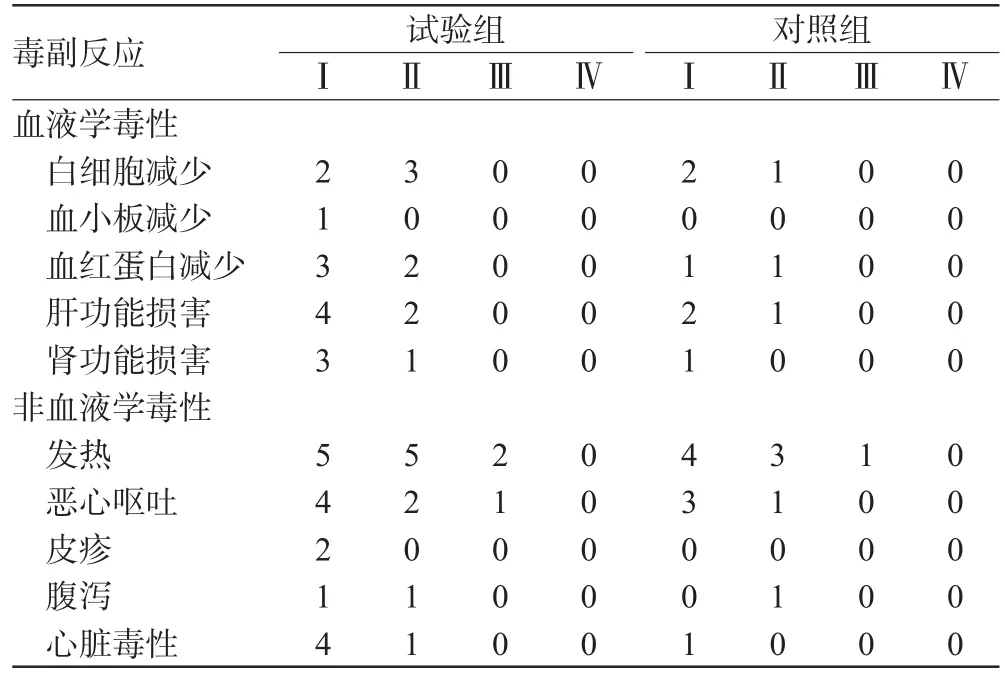
表3 2组毒副反应比较(n)Tab 3 Comparison of toxic reaction between two groups(n)
3 讨论
恶性胸/腹腔积液是晚期恶性肿瘤常见并发症,多见于肺癌、乳癌,其次为卵巢癌、胃肠肿瘤和胸膜间皮瘤等[2~4]。恶性胸/腹腔积液增长迅速,严重影响晚期患者的生活质量,预后差,平均生存期3个月,其治疗多采用化疗药物局部注射,但易引起胃肠道反应、骨髓抑制、发热等毒副反应[5],对于PS评分>2的患者很难耐受,因此寻求一种有效控制恶性胸/腹腔积液的药物对提高PS评分>2的晚期患者生活质量至关重要。
恶性胸/腹水的主要形成机制包括:(1)肿瘤直接侵犯浆膜血管和炎性介质的释放可使毛细血管通透性增加;(2)肿瘤细胞造成淋巴管梗阻,增加淋巴液流体静压,使淋巴回流受阻,导致水和蛋白吸收减少,潴留于胸/腹腔[6];(3)肿瘤引起新生血管形成导致毛细血管内膜面积增加和血管通透性增高,导致腹腔内蛋白浓度增高引起胶体渗透压明显升高,这过程与肿瘤细胞产生的多肽,主要是血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF)有关[6,7]。
VEGF是一种有生物学效应的血管源性肽,是诱导肿瘤血管形成作用最强、特异性最高的血管生长因子。Verheul HM研究发现,恶性胸/腹水中VEGF的浓度明显增高,抑制VEGF的活性,可减少胸/腹水的形成[8]。因此,VEGF将成为治疗恶性胸/腹水的重要靶点。
目前国内、外已有20多种抗肿瘤血管药物进入到临床研究,其中以血管生成抑制因子或相关受体为靶点的药物最多。国外研究发现,内皮抑素能明显下调血管生成促进因子,显著上调血管生成抑制因子,影响超过12%的人类基因组的血管生成调节基因,调控广泛的血管生成抑制基因[9]。实验证实,内皮抑素具有广谱的动物和人类抑瘤活性[10]。临床试验也显示,与单纯化疗相比,重组人血管内皮抑素联合多种化疗方案可明显提高初、复治患者的有效率、CBR、中位肿瘤进展时间(TTP)及中位生存时间,且安全性好。
静脉应用重组人血管内皮抑素发现,很多同时合并胸/腹腔恶性积液的患者其胸/腹水明显改善。国外研究也证实腹腔内给予重组人血管内皮抑素与静脉等方式一样,具有减少血管密度和抑制腹腔内肿瘤生长的作用[11]。IL-2是免疫反应中关键性的调节物,能促进淋巴细胞的增殖与分化,诱导及增强自然杀伤细胞的活力,具有抗肿瘤和增强机体免疫功能等作用。基于此,本研究尝试应用重组人血管内皮抑素联合IL-2治疗PS评分>2的晚期恶性胸/腹水患者,无论从近期疗效还是生活质量改善方面,联合方案均优于单纯予以IL-2的对照组,且未出现严重不良反应。试验组5例出现轻度心脏毒性,心电图示2例窦性心动过速,2例ST-T段改变,1例房性期前收缩,主要表现在用药初期,通过对症处理可迅速纠正,不影响继续用药。很多已失去化疗机会的恶性胸/腹腔积液患者选择姑息治疗,而本研究为体力评分差或经过多线化疗后以及老年恶性胸/腹腔积液患者提供了新的临床治疗依据,但具体给药周期、给药剂量及作用机制等仍需进一步研究。
重组人血管内皮抑素联合IL-2灌注治疗恶性胸/腹腔积液,有效率高,安全性好,为晚期不能接受化疗的恶性胸/腹腔积液患者提供了一个新的治疗方法,值得临床推广应用。
[1]Palmer MK.WHO Handbook for Reporting Results of Cancer Treatment[J].Br J Cancer,1982,45(3):484
[2]Hsu IL,Su WC,Yan JJ,et al.Angiogenetic biomarkers in non-small cell lung cancer with malignant pleural effusion:correlations with patient survival and pleural effusion control[J].Lung Cancer,2009,65(3):371.
[3]Oh SY,Kwon HC,Lee S,et al.A phaseⅡ study of oxaliplatin with low-dose leucovorin and bolus and continuous infusion 5-fluorouracil(modified FOLFOX-4)for gastric cancer patients with malignant ascites[J].Jpn J Clin Oncol,2007,37(12):930.
[4]Woopen H,Sehouli J.Current and future options in the treatment of malignant ascites in ovarian cancer[J].Anticancer Res,2009,29(8):3 353.
[5]Yoshida K,Sugiura T,Takifuji N,et al.Randomized phaseⅡtrial of three intrapleural therapy regimens for the management of malignant pleural effusion in previously untreated non-small cell lung cancer:JCOG 9515[J].Lung Cancer,2007,58(3):362.
[6]Tamsma J.The pathogenesis of malignant ascites[J].Cancer Treat Res,2007,134:109.
[7]Wörnle M,Sauter M,Kastenmüller K,et al.Role of viral induced vascular endothelial growth factor(VEGF)production in pleural effusion and malignant mesothelioma[J].Cell Biol Int,2009,33(2):180.
[8]Verheul HM,Hoekman K,Jorna AS,et al.Targeting vascular endothelial growth factor blockade:ascites and pleural effusion formation[J].Oncologist,2000,5(Suppl 1):45.
[9]Abdollahi A,Hlatky L,Huber PE.Endostatin:the logic of antiangiogenic therapy[J].Drug Resist Updates,2005,8(1~2):59.
[10]Folkman J.Antiangiogenesis in cancer therapy-endostatin and its mechanisms of action[J].Exp Cell Res,2006,312(5):594.
[11]Kisker O,Becker CM,Prox D,et al.Continuous administration of endostatin by intraperitoneally implanted osmotic pump improves the efficacy and potency of therapy in a mouse xenograft tumor model[J].Cancer Res,2001,61(20):7 669.

