2009年我国部分地区禽白血病分子流行病学调查
高玉龙,邵华斌,罗青平,潘 伟,秦立廷,孙芬芬,刘超男,高宏雷,祁小乐,王笑梅*
(1.中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室/禽传染病研究室,黑龙江哈尔滨150001;2.湖北省农业科学院畜牧兽医研究所,湖北武汉430065)
禽白血病(Avian Leukusis,AL)是危害养禽业的一种重要传染病,是由AL病毒(ALV)引起的以造血细胞增生为主的一类肿瘤疾病,包括淋巴细胞性白血病,成红细胞性白血病,成髓细胞白血病和髓细胞样白血病。该病自1908年首次报道并分离到ALV以来,世界上许多国家都有发生,但由于该病造成的直接经济损失相对较小,并未受到重视。直到1988年,J亚群禽白血病在世界范围内发生[1],给养禽业造成了巨大的经济损失[2]。该病的危害主要表现在以下几个方面:一是直接发病,病鸡产生肿瘤,最终死亡;二是导致感染鸡产生免疫抑制,易造成发病鸡继发其它病原的多重感染,对疫苗免疫应答差,严重影响鸡的生产性能[3];三是通过垂直传播危害子代鸡,所以祖代或父母代鸡场一旦发病,将会严重影响鸡雏的质量。因此,ALV对养禽业造成的危害是多方面的。
禽白血病在我国已广泛存在,近几年该病的流行日趋严重,特别是自2009年初以来,湖北、山东等地鸡白血病疑似病例频发,鸡群ALV的感染率高达60%,病死率高达50%以上。为了对此次ALV的流行情况和病毒分子特征进行研究,我们先后对多个鸡场进行调研采样,收集了大量疑似ALV的病料,本研究主要对采集到的病料进行了检测,并初步分析了发病鸡群中ALVenv基因的分子特性。
1 材料和方法
1.1 病毒株及被检样品 ALV-J原型毒株HPRS-103、ALV-A标准毒株RAV-1和ALV-B标准毒株RAV-2为本实验室保存。被检样品为自2009年1月至11月初从湖北、山东、吉林、辽宁、黑龙江、安徽、宁夏、广东8个省区39个养鸡场采集发病鸡鸡的肝、脾、肿瘤等脏器采集共178份(详见表2)。这些病料均为疑似ALV,发病日龄在50 d~200 d左右,品种有海兰褐、罗曼、白羽肉鸡、地方品种等,部分鸡有内脏肿瘤和血管瘤症状。
1.2 引物设计及合成 根据GenBank中登录的HPRS103(Z46390.1)、 RAV-1(M19113.1)和 RAV-2(M14902.1)的基因序列,设计并合成4对引物(表1),用于检测ALV-A、B和J亚群以及扩增ALV-J亚群的囊膜基因。引物由上海英俊公司合成。
1.3 前病毒基因组DNA提取 被检样品研磨后,按照常规方法提取DNA:取病料研磨液 100 μL,加入裂解液裂解后,静止5 min~10 min;酚/氯仿/异戊醇抽提,75%乙醇洗涤,RNA酶消化后,-20℃保存备用。
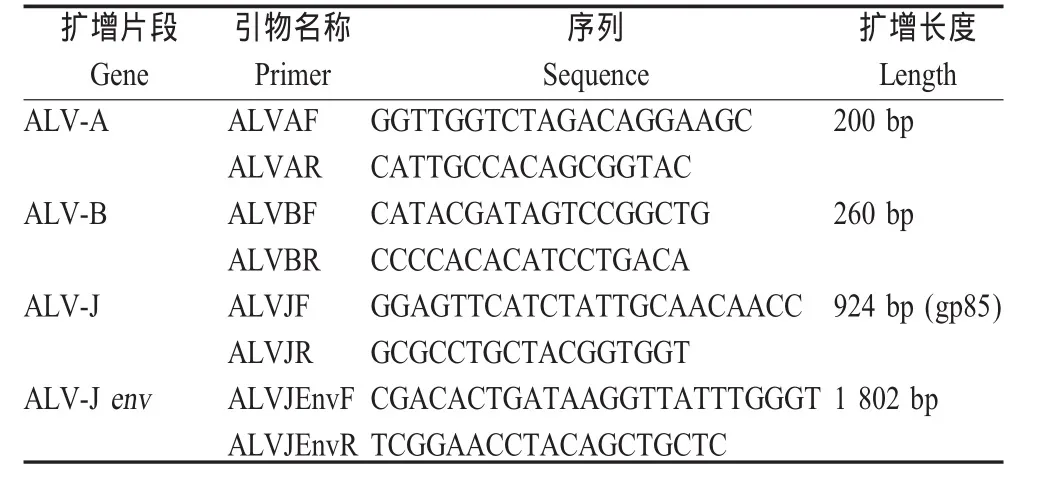
表1 扩增靶基因引物序列Table 1 Target ALV subgroup and oligonucleotide primers used in PCR assay
1.4 样品的PCR检测 以提取的前病毒基因组DNA为模板,分别用ALV-A、B和J亚群特异性引物 ALVAF和 ALVAR、ALVBF和 ALVBR、ALVJF和ALVJR进行PCR扩增。PCR产物经鉴定后,回收目的片段,与pMD18-T载体连接,转化感受态DH5α,挑取白色菌落,阳性质粒送上海英骏公司测序。
1.5 ALV-J阳性样品env基因的扩增 对检测ALV-J阳性的样品用env基因特异性引物ALVJEnvF和ALVJEnvR扩增囊膜基因。PCR产物连接到pMD 18-T载体,转化DH5α,选取阳性质粒送上海英骏公司测序,序列用DNAStar、Clustal X和MEGA 3.1软件进行分析。
2 结果
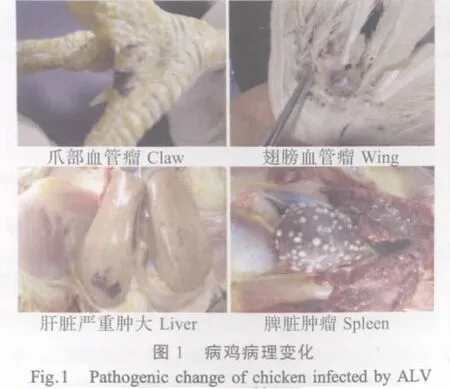
2.1 样品检测结果 共检测了8个省39个鸡场的178份病料,这些病料多为疑似ALV病料。疑似ALV的鸡场雏鸡生长缓慢,蛋鸡产蛋率偏低、死亡率较高。临床症状主要有消瘦、精神沉郁、食欲不振症状,爪部、翅膀及头部出现血管瘤等病变(图1)。病鸡剖解后,多数可见肝、脾肿大,部分有肾脏和腺胃肿大,有些在肝脏或脾脏有白色肿瘤(图1)。
PCR检测各鸡场样品结果见表2,结果表明:124份病料中检出ALV-J,检出率为69.7%;25份病料中检出ALV-A,检出率为13.9%;7份病料中检出ALV-B,检出率为3.9%。检测的39个鸡场中,有35个鸡场检测出ALV-J,阳性率为89.7%;有4个鸡场检测出ALV-A,阳性率为10.3%;有1个鸡场检测出ALV-B,阳性率为2.6%。
对ALV-J阳性样品的gp85基因测序后,比较分析表明有3个毒株在669位~699位之间缺失30 bp。样品间gp85基因的同源性为85.9%~99.9%,与ALV-J原型株HPRS-103的gp85基因的同源性为88.1%~98.2%。
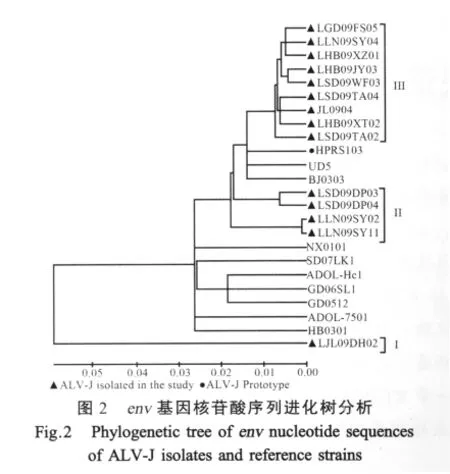
2.2 ALV-J阳性样品env基因序列分析 选取14个ALV-J阳性样品测定了env基因序列。结果表明分离株的env基因核苷酸序列同源性为85.5%~99.3%,氨基酸同源性为84.3%~99%;与J亚群原型毒株HPRS-103的核苷酸同源性为87%~98.1%,氨基酸序列同源性为87.3%~98.2%;与其它J亚群env基因核苷酸序列的同源性为85.2%~97%,氨基酸序列同源性为83%~97.4%。遗传进化分析表明(图2),14个ALV-J分离株分别分属于不同的分支。分离株LJL09DH02与其它分离株的遗传距离最远,与HPRS-103的氨基酸同源性仅为87.3%。4个分离株(LLN09SY02、LLN09SY11、LSD09DP03和LSD09DP04)的env基因与HPRS-103的氨基酸同源性在93%以下,其他9个分离株的env基因与原型毒株HPRS-103的氨基酸同源性可达96.6%以上。
3 讨论
根据病毒的宿主范围及交叉中和试验等将ALV分为A~J 10个亚群,其中A~D和J为外源性病毒,E~I为内源性病毒。A、B亚群是商业鸡群中最为常见的外源性病毒亚群,而C、D亚群感染率极低,几乎很难检测到;ALV-J于1988年由Payne等首次从商品代肉用鸡中分离[1],ALV-J是一外源性ALV与禽内源性反转录病毒囊膜(E51)的重组体[4],可以通过水平和垂直传播在鸡群中广泛传播。我国于1999年首先在江苏和内蒙古的肉鸡群中发现有髓细胞性白血病,杜岩等在该病例中分离到ALV-J毒株,随后山东、宁夏等地也有本病发生的报道[5-6]。近几年的J亚群禽白血病的病例报道表明,发病日龄比最初报道的明显提前。在本研究检测的病料中,有50日龄的发病病例,并且表现有明显的临床症状,这表明ALV-J毒株的致病性明显增强,自然感染时引起发病的日龄逐渐提前。另外,在检测的178份病料中,ALV-J感染率高达69.7%,远远高于ALV-A和B亚群的感染。而且检测的39个鸡场中,有35个鸡场是ALV-J阳性,鸡群阳性率高达89.7%,表明我国目前ALV的感染主要以J亚群为主。另外检测中还发现,ALV-A或ALV-B阳性的鸡场同样能检测到ALV-J,感染率在3.9%~13.9%。
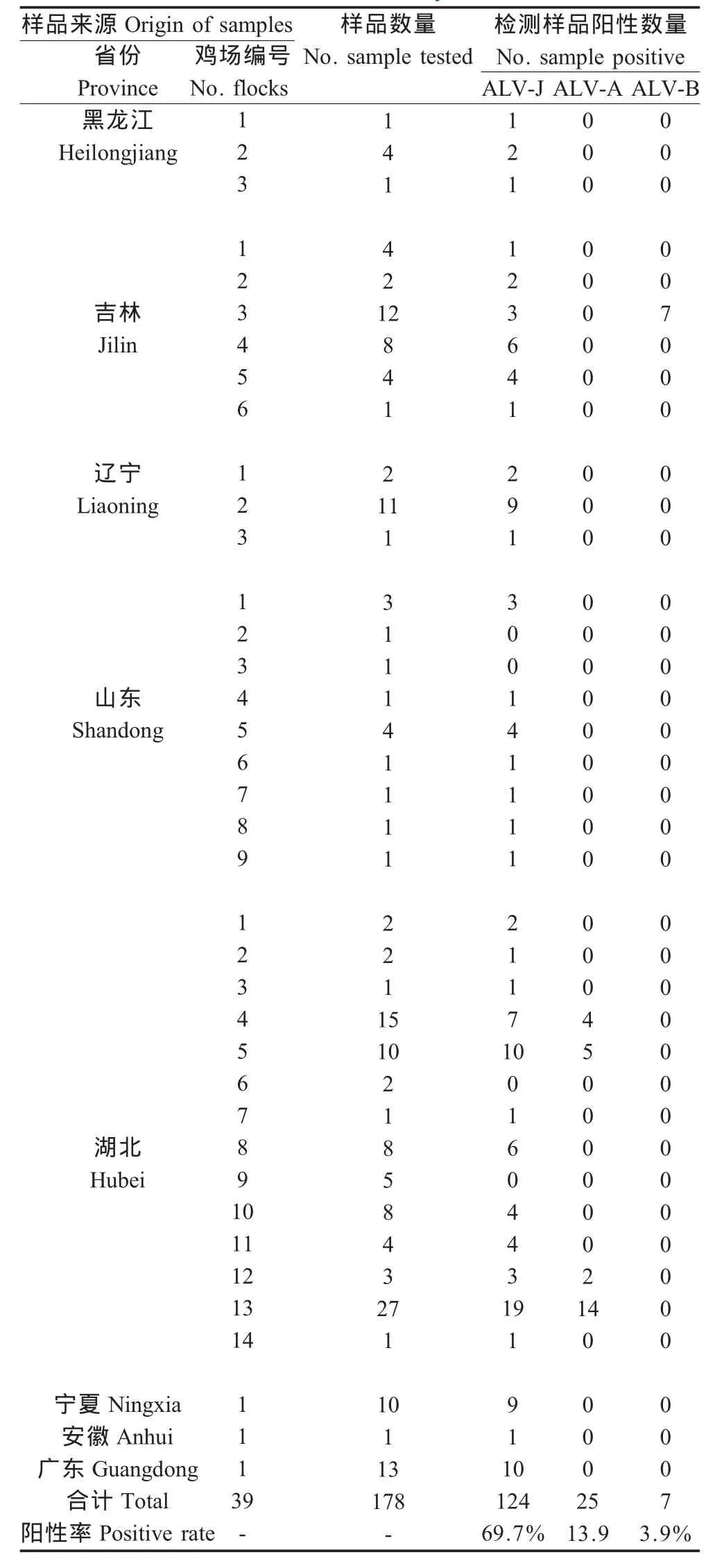
表2 样品来源及检测结果Table 2 Background of clinic samples and the ALV detection by PCR
以前认为ALV-J主要引起肉用型鸡发病,商品莱航鸡虽然对ALV易感,但不产生肿瘤[7]。最近国内的报道白表明蛋鸡发生骨髓细胞瘤型J亚群禽白血病病例,该病造成蛋鸡产蛋量下降,死亡率明显增加[8]。ALV-J的宿主范围逐渐扩大,不仅局限于白羽肉鸡感染发病,在蛋鸡甚至我国地方品种麻鸡也普遍发生[9-10]。以往报道ALV-J主要引起成年肉鸡骨髓细胞瘤,但近些年陆续报道有血管瘤型J亚群禽白血病病例发生[11-12],而且日趋更为常见。在本次调查中,发生J亚群禽白血病的鸡群以蛋鸡为主,发生血管瘤的病例占多数,个别鸡场有50%以上的发病鸡有血管瘤病变。
env基因与病毒的抗原性、组织亲嗜性以及毒力密切相关,是ALV致肿瘤性的关键基因[13]。env基因的变异决定了ALV-J毒株的变异,不同ALV-J毒株间的env基因同源性差异很大,而且越是新近分离到的野毒株,其与1988年分离到的英国原型毒HPRS-103的同源性越小[14]。本研究分析了同一时间不同地区的14个分离株的env基因,发现部分分离株的env基因也表现出明显的变异。根据变异程度将14个分离株分为 3类(I,II和 III),LJL09DH02分离株属于I类,env基因与HPRS-103的同源性仅为87.3%,而与2003年美国ALV-J毒株ADOL-7501的同源性低至83%。其它9个分离株属于III类,其env基因与HPRS-103的同源性均在96.6%以上,另外4个分离株(II类)介于I和III类之间。这说明随着病原长期进化导致毒力和致瘤性等特性发生了改变,从而使得发病率、临床肿瘤病变表现越来越多样化。有关此次ALV流行,是否是由于病毒变异而引起,还有待于进一步研究。
J亚群禽白血病不仅出现发病日龄提前,宿主范围扩大等特性,而且与其它免疫抑制病混合感染严重[15-16]。本次调查中也发现,不仅ALV感染率高,而且与其他免疫抑制病混合感染相当严重(结果另文发表)。这次禽白血病的流行,给我国养禽业造成了巨大的损失,部分鸡场面临倒闭。因而有效防控ALV显得尤为重要。目前尚无疫苗防制ALV的感染,只能通过防止垂直传播和二次感染作为控制该病的手段。建议祖代鸡场和父母代种鸡场加强防控ALV重视程度,做好净化工作,提高饲养管理水平,并加强日常兽医卫生管理和消毒措施,控制其它病原的混合感染。
[1]Payne L N,Brown S R,Bunstead N,et al.A novel subgroup of exogenous avian leucosis virus in chickens[J].J Gen Virol,1991,72:801-807.
[2]Payne L N.HPRS-103:a retrovirus strikes back.The emergence of subgroup J avian leucosis virus[J].Avian Pathol,1998,27(1):36-45.
[3]商营利,刘思当,丁宝君,等.鸡感染J亚群禽白血病病毒的免疫抑制机理[J].中国兽医学报,2005,25(6):573-577.
[4]Bai J,Payne L N,Skinner M A.HPRS-103(exogenous avian leukosis virus,subgroup J)has anenv gene related to those of endogenous elements EAV-0 and E51 and an E element found previously only in sarcoma viruses[J].J Virol,1995,69:779-784.
[5]杜岩,崔治中,秦爱建.从市场商品肉鸡中检测出亚群白血病病毒[J].中国家禽学报,1999,(1):124.
[6]赵振华,顾玉芳,王风龙,等.禽骨髓细胞瘤病的病理学初报[J].动物医学进展,1999,20(3):85-86.
[7]PayneL N.Developmentsin avian leucosisresearch [J].Leukemia,1992,6(3):150-152.
[8]Xu B R,Dong W X,Yu C M,et al.Occurrence of avian leukosis virus subgroup J in commercial layer flocks in China[J].Avian Pathol,2004,33(1),13-17.
[9]Sun S,Cui Z.Epidemiological and pathological studies of subgroup J avian leukosis virus infections in Chinese local"yellow"chickens[J].Avian Pathol,2007,36(3):221-226.
[10]成子强,张利,刘思当,等.中国麻鸡中发现禽J亚群白血病[J].微生物学报,2005,45(4):584-587.
[11]赖汉漳,曹伟胜,张贺楠,等.血管瘤病变型J亚群禽白血病病毒的分离与鉴定[C].中国畜牧兽医学会2008年学术年会暨第六届全国畜牧兽医青年科技工作者学术研讨会论文集,2008,339.
[12]孟祥凯,刘青,王海伦,等.商品蛋鸡成髓细胞瘤、血管瘤型J亚群白血病病毒特性的研究[J].畜牧兽医学报,2008,39(11):1544-1547.
[13]Brown D W,Blais B P,Robinson H L.Long terminal repeat(LTR)sequences,env,and a region near the 5'LTR influence the pathogenic potential of recombinants between Rous-associated virus types 0 and 1[J].J Virol,1988,62:3431-3437.
[14]Silva R F,Fadly A M,Hunt H D.Hypervariability in the envelope gene of subgroup J avian leucosis virus obtained from different farms in the United States[J].Virology,2000,272(1):106-111.
[15]崔志中,张志,姜世金.从J亚群禽白血病肿瘤中检测出禽网状内皮增生症病毒[J].中国兽医学报,2004,24(1):10-13.
[16]崔治中,金文杰,刘岳龙,等.传染性法氏囊病病料中MDV、CAV、REV的共感染检测[J].中国兽医学报,2001,21(1):6-9.

