核仁素对LPS诱导的白细胞介素1β释放的影响*
张 彬, 肖献忠, 张文辉, 蒋 磊, 蒋碧梅△
(中南大学湘雅医学院1病理生理学系,2组织学与胚胎学系,湖南 长沙 410078)
革兰氏阴性细菌胞壁上的LPS(lipopolysaccharide,LPS)即内毒素,是引起脓毒症(sepsis)的主要原因之一。当机体遭遇革兰氏阴性细菌感染时,LPS释放入血,与血浆中的LPS结合蛋白(LPS binding protein,LBP)形成复合物,由LBP运送至单核-巨噬细胞及多形核白细胞膜表面的白细胞分化抗原14(cluster of differentiation 14,CD14)受体,然后通过跨膜信号受体 Toll样受体 4(Toll like recept 4,TLR4)等将LPS信号转入细胞,激活细胞内多条信号转导通路,从而启动炎症介质的表达如白细胞介素1β(interleukin-1β,IL -1β)、肿瘤坏死因子 α(tumor necrosis factor- α,TNF - α)[1]。核仁素(nucleolin,由C23基因编码)是一种具有多种生物学功能的RNA结合蛋白,在核仁的发生、核糖体的生物合成与成熟、细胞增殖与生长及细胞凋亡等过程中发挥重要调控作用[2,3]。近来研究发现革兰氏阴性菌感染人THP-1单核细胞时伴有核仁素表达上调;LPS诱导小鼠RAW264.7巨噬细胞活化时伴有核仁素裂解片段的表达下调[4,5]。这些证据表明,核仁素可能在炎症反应中发挥重要作用。但是发挥何种作用以及如何起作用,目前仍不清楚。因此,本研究首先以内毒素血症小鼠和内毒素刺激的巨噬细胞为模型,探讨核仁素在炎症中的表达,并采用基因转染、反义寡核苷酸技术从正反两方面深入探讨核仁素对LPS所致细胞炎症因子分泌的影响,从而为进一步探讨核仁素在炎症反应中的作用奠定基础。
材料和方法
1 材料
BALB/c小鼠由本校实验动物中心提供。正常RAW264.7细胞 (小鼠巨噬细胞),贴壁生长,由本校细胞中心提供。pcDNA3.1-C23真核表达载体由本科室王海云硕士构建。鼠抗核仁素单克隆抗体购于Santa Cruz;GAPDH小鼠单克隆抗体购于中国康成公司;鼠IL-1β ELISA试剂盒购于Boster;Lipofectamine脂质体转染试剂购自Invitrogen;大肠杆菌LPS(E.coli O111∶B4)购自 Sigma。
2 方法
2.1 细胞株传代培养 RAW264.7细胞(小鼠巨噬细胞)用含10%新生小牛血清的DMEM培养基培养。将细胞放置于37℃、5%CO2的条件下培养,待细胞生长至约85% 的融合状态用于实验。
2.2 C23反义寡核苷酸的设计 从GenBank获得小鼠C23基因全长cDNA,GenBank号为BC005460,选择跨越起始密码子的6-9位点作为靶位点,由碱基互补原则设计并合成正义(S)、反义(AS)及随机(R)寡核苷酸。S:5'-CATGGTGAAGCTCGCAAAGGCTGGC-3';AS:5'-GCCAGCCTTTGCGAGCTTCACCATG-3';R:5'-CTACGAGACTGCCTCCACTGCTTCG-3';并将所有碱基进行硫代修饰。
2.3 pcDNA3.1-C23或C23反义寡核苷酸瞬时转染RAW264.7细胞 根据Invitrogen公司提供的转染操作说明书进行。具体步骤如下:以合适的细胞密度接种到6孔培养板上(接种密度是3×108cells/L),待细胞达到80%-85%的融合状态用于后续实验。将20 μg pcDNA3.1 -C23 DNA 或20 μg C23 反义寡核苷酸稀释于480 μL无血清培养基中,室温下置5 min。将15 μL脂质体稀释于485 μL的无血清培养基中,室温下置5 min。然后将两者混合,室温下置20 min。将6孔板中的细胞用无血清培养基冲洗细胞2遍后,加入2 mL无血清培养基。将上述混合液逐滴加入孔中,摇动培养板,轻轻混匀。在37℃、5%CO2中培养6 h。6 h后,更换含有血清的全培养基,在37℃、5%CO2中培养24 h。
2.4 免疫印迹法(Western blotting) 按实验室常规方法进行。用2×SDS裂解缓冲液裂解细胞,收集细胞总蛋白质,100℃煮沸10 min,12000 r/min离心10 min,收集上清。采用Bradford法进行蛋白定量,制备好的蛋白样品置-80℃冰箱保存备用。30 g蛋白经10% -12%SDS-PAGE电泳6 h后,电转(4℃,过夜)至硝酸纤维素膜,2%BSA室温封闭3 h,先后加入靶蛋白抗体及HRP标记的相应IgG,室温分别孵育1 h和0.5 h,DAB显色试剂盒进行显色。
2.5 酶联免疫吸附实验(ELISA) 用LPS处理转染pcDNA3.1-C23表达载体或C23反义寡核苷酸的细胞,在相应时点收集细胞培养基,按试剂盒说明操作,检测IL-1β量的变化。
3 统计学处理
结 果
1 BALB/c小鼠内毒素血症模型中核仁素表达的变化
小鼠内毒素血症模型按照本实验室的成熟方法建立。BALB/c小鼠经腹腔注射LPS(15 mg/kg),分别于6 h、12 h、24 h提取肺组织总蛋白,用 Western blotting检测不同时点核仁素的表达改变。结果显示(图1):与对照组相比,LPS注射6 h后110 kD核仁素全长分子表达上调,12 h达到最高并维持到24 h;80 kD的核仁素片段则于注射LPS 6 h后表达下调,持续至24 h。
2 核仁素在RAW264.7细胞炎症模型中的表达改变
用500 μg/L LPS处理 RAW264.7 细胞,分别于6 h、12 h、24 h、36 h 收集细胞,提取细胞总蛋白,通过Western blotting分析不同时点核仁素的表达改变。结果发现(图2):与未处理组比较,110 kD核仁素全长分子在LPS处理6 h后表达上调,12 h上调最明显并维持到36 h;而80 kD的核仁素片段在LPS处理后逐渐减少。
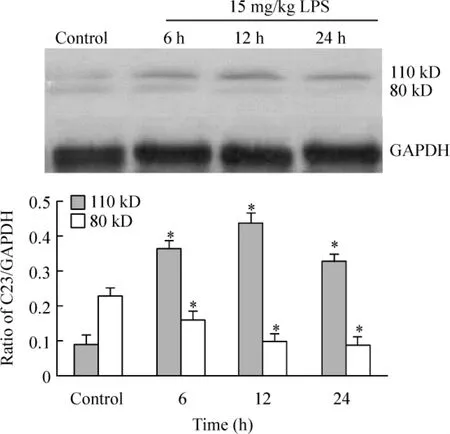
Figure 1.Western blotting showed the level of 110 kD nucleolin was increased and the level of 80 kD nucleolin was decreased in the lung tissues of the mice treated with 15mg/kg of LPS at different time..n=3.*P<0.05 vs control group.图1 Western blotting检测小鼠内毒素血症不同时点肺组织中核仁素的表达
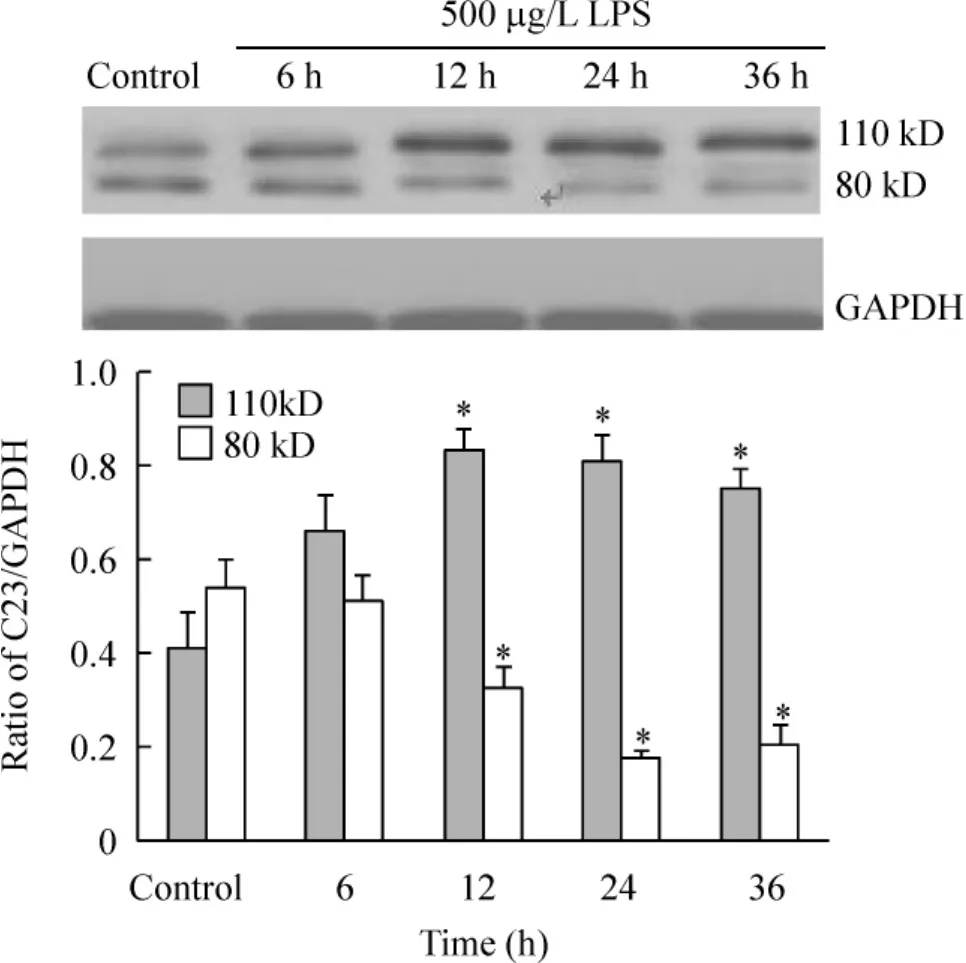
Figure 2.Western blotting showed the level of 110 kD nucleolin was increased and the level of 80 kD nucleolin was decreased in RAW264.7 cells treated with 500 μg/L LPS at different time..n=3.*P<0.05 vs control group.图2 Western blotting检测LPS刺激下不同时点RAW264.7细胞中核仁素的表达
3 用生物信息学方法筛选可能受核仁素调控的炎症介质基因
采用生物信息学方法分析,发现TNF-α、IL-1α、IL-1β等多个炎症介质基因的mRNA分子中含有完整的核仁素结合元件,见表1,表明上述多个基因mRNA稳定性可能直接受核仁素调控。

表1 mRNA中含有核仁素结合元件的炎症介质基因Table 1.Inflammatory mediator genes containing nucleolinbinding element
4 转核仁素真核表达载体后RAW264.7细胞中核仁素的表达改变
用全长核仁素真核表达载体(pcDNA3.1-C23)瞬时转染RAW264.7细胞24 h,收集细胞,提取细胞总蛋白,经Western blotting检测核仁素的表达改变。结果显示(图3):与转空载体组比较,转全长核仁素真核表达载体组细胞中110 kD核仁素表达明显上调。
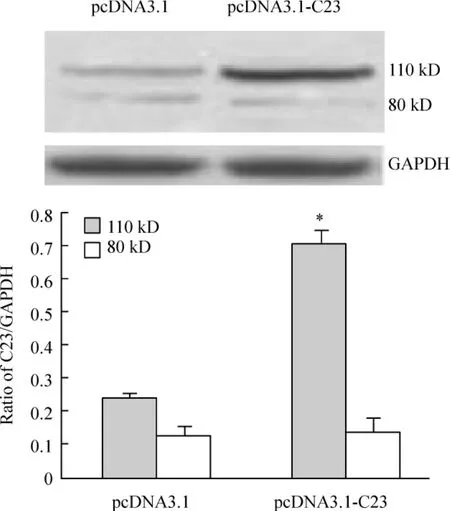
Figure 3.Western blotting showed the level of 110 kD nucleolin was increased in RAW264.7 cells transfected with pcDNA3.1-C23..n=3.*P<0.05 vs pcDNA3.1 group.图3 Western blotting检测核仁素基因转染后RAW264.7细胞中核仁素的表达
5 核仁素过表达对LPS所致RAW264.7细胞IL-1β释放的影响
用核仁素真核表达载体(pcDNA3.1-C23)瞬时转染RAW264.7细胞24 h,经LPS处理后,分别于6 h、12 h、24 h收集上清,采用 ELISA 检测 IL-1β 的变化。结果显示:核仁素过表达对LPS所致IL-1β释放有促进作用,见图4。

Figure 4.ELISA showed nucleolin-overexpression promoted LPS- induced IL -1β release in RAW264.7 cells..n=5.*P<0.05 vs pcDNA3.1 group.图4 ELISA显示核仁素过表达对LPS所致RAW264.7细胞IL-1β释放的影响
6 核仁素反义寡核苷酸对RAW264.7细胞中核仁素的表达改变
用核仁素反义寡核苷酸瞬时转染RAW264.7细胞24 h,收集细胞,提取细胞总蛋白,经Western blotting检测核仁素的表达改变。结果显示(图5):与正常组比较,转脂质体或随机寡核苷酸组的核仁素变化不明显,而转核仁素反义寡核苷酸组的110 kD核仁素表达明显受到抑制。
7 核仁素低表达对LPS所致RAW264.7细胞IL-1β释放的影响
用核仁素反义寡核苷酸瞬时转染RAW264.7细胞24 h,于LPS 处理后的6 h、12 h、24 h 收集上清,采用ELISA检测IL-1β的变化。结果显示:LPS处理后IL-1β释放明显增加;但核仁素低表达抑制了LPS所致的IL-1β释放,见图6。
讨 论
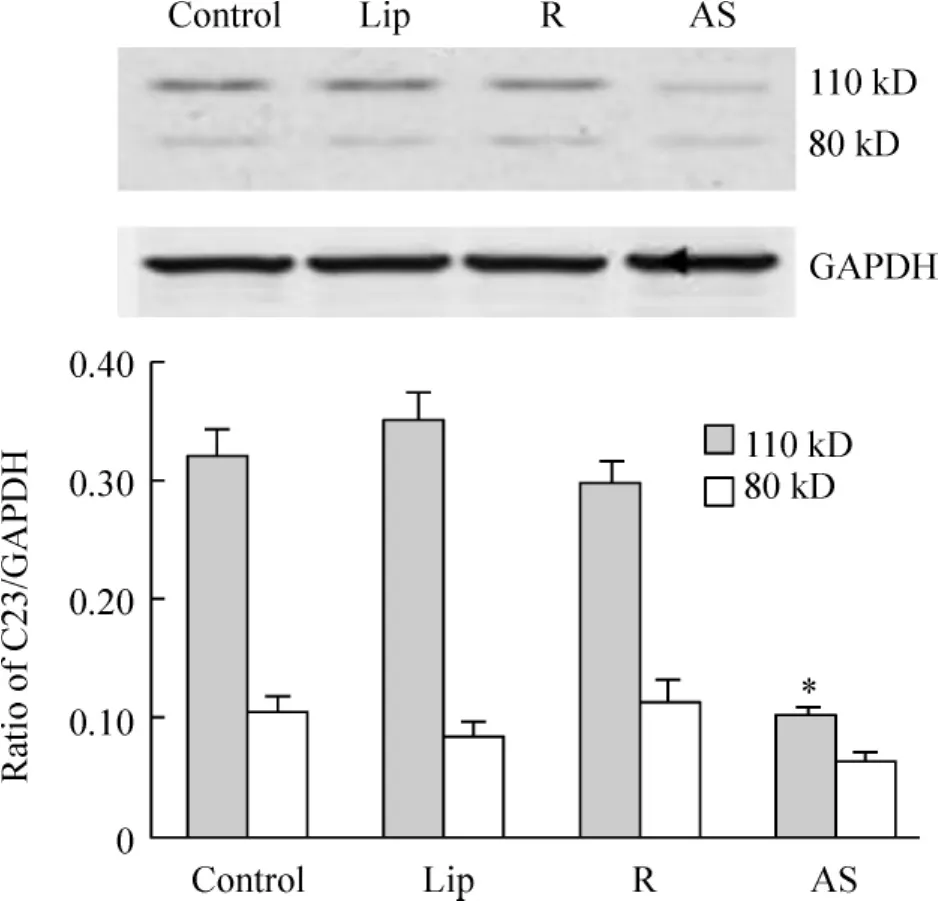
Figure 5.Western blotting showed the level of 110 kD nucleolin was decreased in RAW264.7 cells transfected with antisense oligonucleotide of nucleolin..n=3.*P<0.05 vs control group.Lip:lipofectamine;R:random oligonucleotide;AS:antisense oligonucleotide.图5 Western blotting检测核仁素反义寡核苷酸转染对RAW264.7细胞中核仁素表达的影响
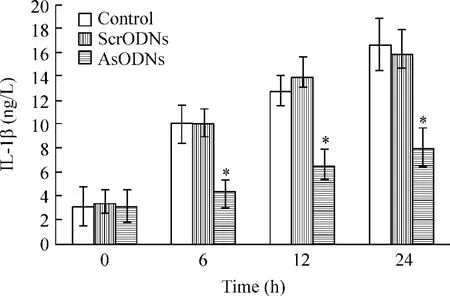
Figure 6.ELISA showed nucleolin-deficiency suppressed LPS-induced IL-1β release in RAW264.7..n=5.*P <0.05 vs control group.ScrODNs:scramble oligonucleotides;AsODNs:antisense oligonucleotides.图6 ELISA分析核仁素低表达对LPS所致RAW264.7细胞IL-1β释放的影响
LPS通过激活多条信号通路促进体内炎症介质的过表达,在脓毒症发病中起着重要的作用。最近研究表明核仁素可能在炎症中起作用。故本实验拟从整体和细胞水平初步探讨核仁素在LPS所致炎症反应中的作用。研究发现LPS处理后,小鼠肺组织以及RAW264.7细胞中核仁素110 kD片段表达上调,而80 kD片段在LPS处理后逐渐减少。这结果提示,LPS所致小鼠内毒素血症模型及细胞炎症模型中伴有核仁素的表达改变。但核仁素的表达改变在LPS所致炎症模型中是伴随现象还是起了重要作用,仍需要进一步研究。
核仁素是一种RNA结合蛋白,能与含-(T/G)CCCG(A/G)-序列的 rRNA特异性结合[6]。近年发现核仁素还可作为反式作用因子与多个基因的mRNA分子中的-(T/G)CCCG(A/G)–序列的顺式作用元件相结合来调控mRNA的稳定性,从而调控基因的蛋白质表达水平。Zhang等[7]发现核仁素可与生长抑制和DNA损伤诱导基因45α(growth arrest and DNA damage inducible gene 45α,GADD45α)mRNA结合来调控 GADD45α mRNA的稳定性。Chen等[8]发现核仁素可与IL-2 mRNA 的5'-非翻译区(5'-untranslated region,5'-UTR)相结合,增加其稳定性,使 IL-2蛋白表达增高;Singh等[9]发现核仁素可通过RNA/蛋白质相互作用,增加CD154 mRNA的稳定性。这些研究结果提示,核仁素可与炎症介质基因的mRNA结合,从而调控其稳定性及表达。
通过生物信息学分析,发现 IL-1β、IL-1α、TNF-α等多个炎症介质基因的mRNA分子中含有完整的核仁素结合元件(表1)。表明核仁素有可能通过与这些炎症介质基因的mRNA结合而调控它们的表达,进而对炎症反应起调控作用。IL-1β是LPS所致炎症反应中的重要早期促炎介质,在炎症反应中发挥重要作用。为了探讨核仁素是否对IL-1β起调控作用,我们采用了核仁素真核表达载体及反义寡核苷酸,发现RAW264.7细胞中核仁素过表达后可促进LPS所致IL-1β的释放,低表达则抑制LPS所致IL-1β的释放。上述结果提示,RAW264.7细胞中核仁素的表达水平对LPS所致IL-1β的释放有明显的影响。但该影响是否通过核仁素与IL-1β mRNA结合,使IL-1 βmRNA稳定性增加而导致IL-1β表达增多,进而释放增多,则仍需进一步的研究阐明。
[1]Seimon TA,Obstfeld A,Moore KJ,et al.Combinatorial pattern recognition receptor signaling alters the balance of life and death in macrophages[J].Proc NatI Acad Sci USA,2006,103(52):19794 -19799.
[2]Ginisty H,Sicard H,Roger B,et al.Structure and functions of nucleolin[J].J Cell Sci,1999,112(Pt 6):761-772.
[3]Mi Y,Thomas SD,Xu X,et al.Apoptosis in leukemia cells is accompanied by alterations in the levels and localization of nucleolin[J].J Biol Chem,2003,278(10):8572-8579.
[4]Saba JA,McComb ME,Potts DL,et al.Proteomic mapping of stimulus-specific signaling pathways involved in THP-1 cells exposed to Porphyromonas gingivalis or its purified components[J].J Proteome Res,2007,6(6):2211-2221.
[5]Zhang X,Kuramitsu Y,Fujimoto M,et al.Proteomic analysis of macrophages stimulated by lipopolysaccharide:lipopolysaccharide inhibits the cleavage of nucleophosmin[J].Electrophoresis,2006,27(8):1659 -1668.
[6]Bouvet P,Allain FH,Finger LD,et al.Recognition of pre-formed and flexible elements of an RNA stem-loop by nucleolin[J].J Mol Biol,2001,309(3):763 -775.
[7]Zhang Y,Bhatia D,Xia H,et al.Nucleolin links to arsenic-induced stabilization of GADD45α mRNA[J].Nucleic Acids Res,2006,34(2):485 -495.
[8]Chen CY,Gherzi R,Andersen JS,et al.Nucleolin and YB-1 are required for JNK-mediated interleukin-2 mRNA stabilization during T - cell activation[J].Genes Dev,2000,14(7):1236 -1248.
[9]Singh K,Laughlin J,Kosinski PA,et al.Nucleolin is a second component of the CD154 mRNA stability complex that regulates mRNA turnover in activated T cells[J].J Immunol,2004,173(5):976 -985.

