眼镜蛇伤大鼠多项指标动态变化与抗蛇毒血清的时效关系*
杨嘉琳, 董伟华, 孔天翰△
(1广州医学院第三附属医院,广东 广州 510150;2广州医学院病理生理教研室,广东 广州 510182)
舟山眼镜蛇(Naja atra Cantor)咬伤是我国南方最常见的蛇伤之一,尤其在广东、广西地区位于毒蛇咬伤的首位。目前,蛇伤后的分期、分型尚缺乏实验室检查的有关特异性指标,故临床上大多据患者的系统症状(神经、呼吸、消化、泌尿及血液系统等)及局部体征(出血、水肿、疼痛等)将蛇伤分为轻型、重型(功能障碍期)及危重型(功能衰竭期)[1]。抗蛇毒血清是治疗蛇伤的首选特效药,蛇伤后2 h内应用抗蛇毒血清能明显缩短病程和减轻脏器损害,可获得最佳的临床疗效[2];亦有报道于毒蛇咬伤6-8 h内应用抗蛇毒血清,96%以上病例可在1-2 d即可治愈出院[3]。由于蛇毒进入机体后有特定的代谢过程,当血液中游离蛇毒素含量低于特定值以后,再输入抗血清非但不足以提高疗效,相反还增加严重过敏反应的风险。另外,作为生物药品的抗血清在使用过程中还存在着诸多不足,如难保管、易变质及价格昂贵等,因此系统研究抗血清使用的时效性,以确定最佳使用时段及无效时段的下限,对指导正确、合理使用抗蛇毒血清,提高临床疗效有重要意义。本实验用不同挑战剂量(2 LD50[4]、4 LD50[5])舟山眼镜蛇毒以建立大鼠蛇伤模型,通过系统观察蛇伤后大鼠相关器官功能动态变化,依据多项实验室指标结果,提出了重度蛇伤后分期的假设,同时探讨了抗血清对动物保护时效性与相关实验室指标变化的关系,为优化眼镜蛇伤的临床治疗方案、动态监测抗血清应用的实际疗效提供实验依据。
材料和方法
1 主要仪器设备
蛇毒取毒器 (专利号为 ZL200420046279.9,由广州蛇毒研究所自行研制);Sychron LX20全自动生化分析仪(Beckman Coulter);Sysmen CA-600全自动凝血分析仪(日本希森美康公司);LD4-低速离心机(北京医用离心机厂);i-STAT多功能血液分析仪(雅培公司);真空采血管。
2 主要试剂
2.1 蛇毒的制备 成年舟山眼镜蛇购自广州白云区茶山福蛇场,用自制的蛇毒取毒器取毒,黏稠而淡黄色毒液按1∶4比例加入自制的蛇毒保护液(可避免细菌、蛋白酶及环境高温对蛇毒抗原性的破坏)稀释,3000×g离心30 min去沉淀,-20℃冷冻,真空、低温干燥为冻干粉,4℃密闭保存。生理盐水配成0.57 g/L溶液,分装后放于-20℃冷冻备用。
2.2 抗蛇毒血清 精制抗眼镜蛇毒血清(1000 IU/瓶,上海赛伦生物技术有限公司,批号为20070701)。
2.3 其它试剂 肝素、2%戊巴比妥钠、生理盐水;cTnl EG3+测试片。
3 蛇伤模型制备
动物由广东省实验动物中心提供,SPF级SD大鼠,体重(230±20)g,雄性,合格证号为粤监证字2007A003。按给药的不同分为对照组、4 LD50蛇毒和2 LD50蛇毒3组,2个蛇毒剂量分别按2.544 mg/kg(4 LD50)、1.272 mg/kg(2 LD50)于背部脊柱一侧胸廓下缘皮下注毒0.1 mL,剩余的蛇毒全部以肌下5-10 mm平均注入左、右腓肠肌内。
4 蛇伤多项指标动态观察
4.1 生化检测 取4 LD50蛇伤模型大鼠分为0、20、40、60、80、100、120 min 7 组,另取 2 LD50蛇伤模型大鼠分为 0、20、40、60、80、100、120、140 min 8 组,每组10只。注毒后立即开胸取血者为0 min组,其余组取血与注毒后相应时间对应。每只大鼠直视下心脏取血3 mL装无抗凝试管中并分离出血清,用Sychron LX20全自动生化分析仪检测以下项目:谷草转氨酶(aspartate transaminase,AST)、磷酸肌酸激酶(creatine kinase,CK)、磷酸肌酸激酶同工酶(creatine kinase,CK - MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷丙转氨酶(alanine transaminase,ALT)、肌酐(creatinine,Cr)、总胆红素 (serum total bilirubin,STB)、间接胆红素(unconjugated bilirubin,UCB)、直接胆红素(conjugated bilirubin,CB)。
4.2 病理检查 上述动物心脏取血后处死,取4 LD50组的右侧大腿肌肉(注毒位置)及心肌行病理检查。
4.3 检测血气分析 取4 LD50蛇伤模型大鼠分为0、20、40、60、80、100、120 min 7 组,每组 10 只。大鼠经2%戊巴比妥钠(2.3 mL/kg)腹腔麻醉,呈仰卧位固定于大鼠手术台上,切开颈前部皮肤,分离左侧颈总动脉,结扎远心端,近心端经硬膜外导管(3F)连接三通头,以少量肝素封管后备用。按不同时间段以2 mL注射器自置管处抽取颈动脉血液0.1-0.2 mL,以cTnl EG3+测试片用i-STAT多功能血液分析仪行血气分析检测,记录结果pH值、二氧化碳分压(pressure of carbondioxide,PCO2)、氧分压(pressure of oxygen,PO2)、碳酸氢根(bicarbonate,HCO3-)、血浆二氧化碳含量(content total plasma,TCO2)、剩余碱(bases excess,BE)、氧饱和度 (oxygen saturation,SO2)。
5 抗血清保护
取4 LD50蛇伤模型大鼠分为血清(40、60、80、100、120 min)及蛇毒对照共6组。40 min组为注毒后40 min经腹腔注射精制抗眼镜蛇毒血清(血清/蛇毒:125 kU/g),60、80、100 及 120 min 组分别于 60、80、100、120 min注入同量抗血清。统计存活时间、保护率,存活时间超过180 min按存活数(只)计。平均存活时间为死亡时间与存活时间(按>180 min计)之和的均数;保护率=(蛇毒组死亡率-血清保护组死亡率)/蛇毒组死亡率。
6 统计学处理
结 果
1 蛇伤模型制备
注入2倍LD50蛇毒(1.272 mg/kg),大鼠平均存活时间(300.0 ±19.2)min;按 0、20、40、60、80、100、120、140 min共8个时点取样进行相关的检测。
注入4倍 LD50蛇毒(2.544 mg/kg)后,大鼠于121-140 min之间的死亡率达到50%;至160 min时,死亡率已达 80%,见表 4。按 0、20、40、60、80、100、120 min共7个时点取样进行相关的检测。
2 生化功能检测
2.1 心、肝酶检测结果
①4 LD50AST、CK、CK-MB于注毒后明显上升,于60 min、120 min时点各出现1峰值,且120 min时点为最高值,80 min时点则为1谷值,40-120 min时点的5个时间段与0 min相比均有显著差异(P<0.05);其中 CK、CK-MB上升更为明显,其值在120 min时点较0 min时上升6-7倍,对比极显著差异(P<0.01)。LDH于注毒后20 min已开始上升,于60 min时点出现峰值,之后逐渐下降,120 min时点仅出现轻度上升,见表1、图1。②2 LD50与4 LD50相比心酶未出现2个明显峰值,CK-MB在100 min时点出现峰值,CK在80 min时点出现峰值,之后有所下降,140 min时点再次出现上升,但不及100 min前的峰值高;AST于60-100 min时点出现1平台期,140 min时点达到最高值;LDH于100 min时点出现峰值,之后逐渐下降,未再上升,120、140 min 2个时点与0 min相比有显著差异(P<0.05)。各心酶的最高值均较4 LD50剂量组记录的最高值低,见表2、图2。
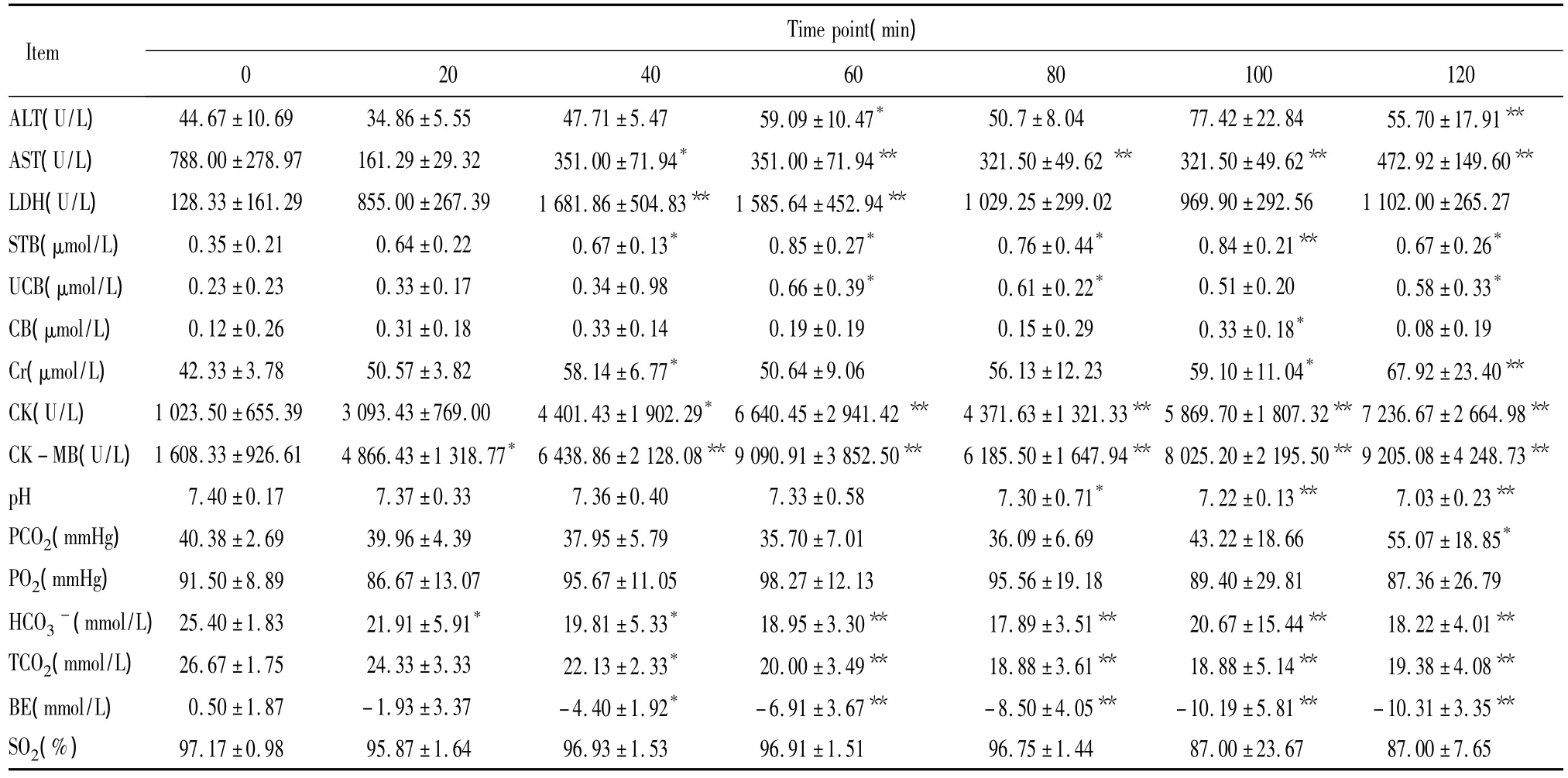
表1 注入4 LD50眼镜蛇毒后不同时点大鼠生化、血气分析指标检测Table 1.The biochemical indicators and blood gas analysis test at different time points after injection of 4 LD50of cobra venom in rats(n=10)
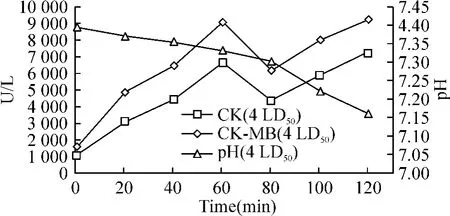
Figure 1.CK,CK -MB and pH curves in 4 LD50group.图1 4LD50组CK、CK-MB和pH 曲线图
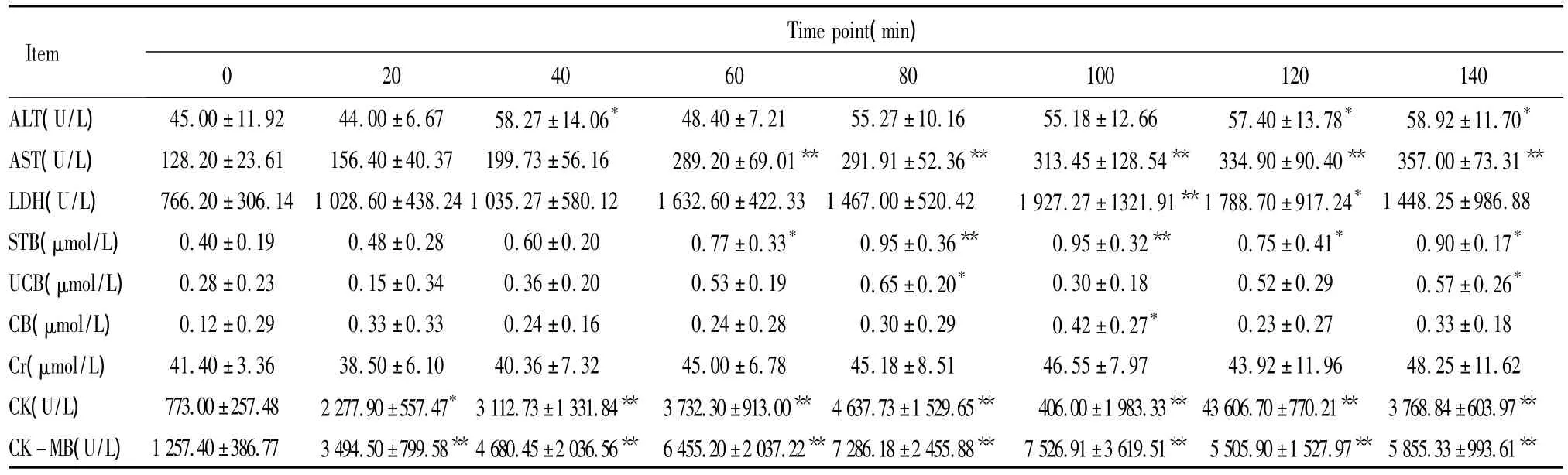
表2 注入2 LD50眼镜蛇毒后不同时点大鼠生化指标检测Table 2.The biochemical indicators test at different time points after injection of 2 LD50of cobra venom in rats(n=10)
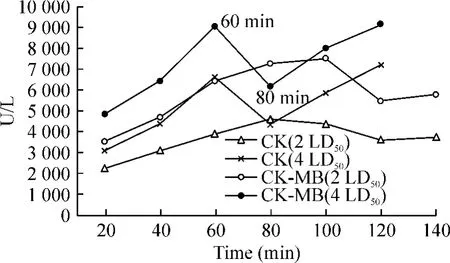
Figure 2.CK and CK-MB curves in 2 LD50and 4 LD50groups图2 2 LD50和4 LD50组的CK、CK-MB曲线
2.2 肝酶 ALT于注毒后进行性升高,在同种剂量组中其上升幅度不如心酶大。
①4 LD5060 min时点达到第1个峰值,80 min时点有一下降点,之后又再上升,120 min时点达到第2个峰值、亦是最大值;60、120 min两个时点与0 min时点相比有显著差异(P<0.05),见表1。
②2 LD50在60-100 min时则出现平台期,于140 min时点升到最高值,但其最高值较4 LD50120 min时点的最高值小,见表2。
2.3 胆红素 4 LD50与2 LD50中均可见STB上升,且有2个峰值:分别于60、100 min 2个时点(4 LD50)以及80、100 min 2个时点(2 LD50)出现。胆红素中的CB、UCB并不是同时升高;CB较UCB升高早,在60 min时点(4 LD50),80 min时点(2 LD50)出现峰值;UCB则在后期升高,在100 min时点(4 LD50、2 LD50)出现峰值。各组的峰值与0 min时点相比均有显著差异(P <0.05),见表1、2。
2.4 肾功能
①4 LD50血Cr于40、120 min 2个时点各出现1峰值,120 min时点为最高值,60 min期为1谷值。20、100、120 min时点分别与0 min时点对比均有显著差异(P <0.05),见表1。②2 LD50Cr在60 min时点后有轻度上升,但0 min时点与各时点相比均无显著差异,变化不明显,见表2。
3 血气分析
4 LD50:HCO3-、BE、TCO2于注毒后出现下降,且为进行性下降,其中 BE、TCO2中 60、80、100、120 min时点与0 min相比有极显著差异(P<0.01);pH值则于80 min时点后才出现下降,在此之前能维持相对稳定,20、40、60 min时点分别与0 min组对比均无显著差异(P>0.05);PCO2于40 min时点开始下降,至60 min时点降至最低值,80 min时点后出现升高,至120 min时点升至最高点;PO2于40 min时点开始上升,40 min时点为最高值,80 min时点后出现下降,至120 min时点降至最低点,见表1、图1。
4 病理检查
4.1 4 LD50大腿肌肉 0 min时点:肌肉纤维结构基本正常,少部分肌束胞浆嗜伊红染色,细胞结构较清晰,横纹可见;20 min时点:部分肌肉纤维节段性变性,肌肉横纹消失,大部分心肌纤维结构无异常肌;40 min时点:细胞浊肿较前(20 min时点)明显,细胞正常与浊肿比例介于1/2-2/3之间,少量淋巴细胞浸润;60 min时点:大部分肌纤维横纹消失,并见部分坏死及淋巴细胞浸润;100 min时点:大部分肌纤维坏死,呈空泡状,并见淋巴细胞灶性浸润;120 min时点:基本上所有肌束均明显浊肿、变性,见图3A-C。
4.2 4 LD50心肌 0 min时点:心肌横纹清晰;20 min时点:少部分心肌纤维浊肿,大部分心肌横纹清楚;40 min时点:心肌横纹消失,胞浆浊肿;60 min时点:心肌纤维广泛浊肿变性,可见凝固性坏死,心肌间见红细胞;80 min时点:心肌细胞广泛变性,可见收缩带;100 min时点:心肌纤维广泛变性、浊肿,可见凝固性坏死;120 min时点:心肌细胞明显变性、浊肿,并见炎症细胞浸润,见图3D-F。
5 抗蛇毒血清保护组
4 LD50注毒后40 min时点施予血清,所有大鼠的中毒症状均不明显,各项生命体征均基本稳定,平均存活时间约120 min,存活率为100%,保护率则为80%,与蛇毒组相比有非常显著差异(P<0.01);60 min、80 min、100 min 时点血清组存活率、保护率及平均存活时间呈线性下降,与蛇毒组相比差异明显(P<0.05);而120 min时点血清组的存活率为40%,保护率仅为20%,平均存活时间与蛇毒组非常接近,无显著差异,见表3。
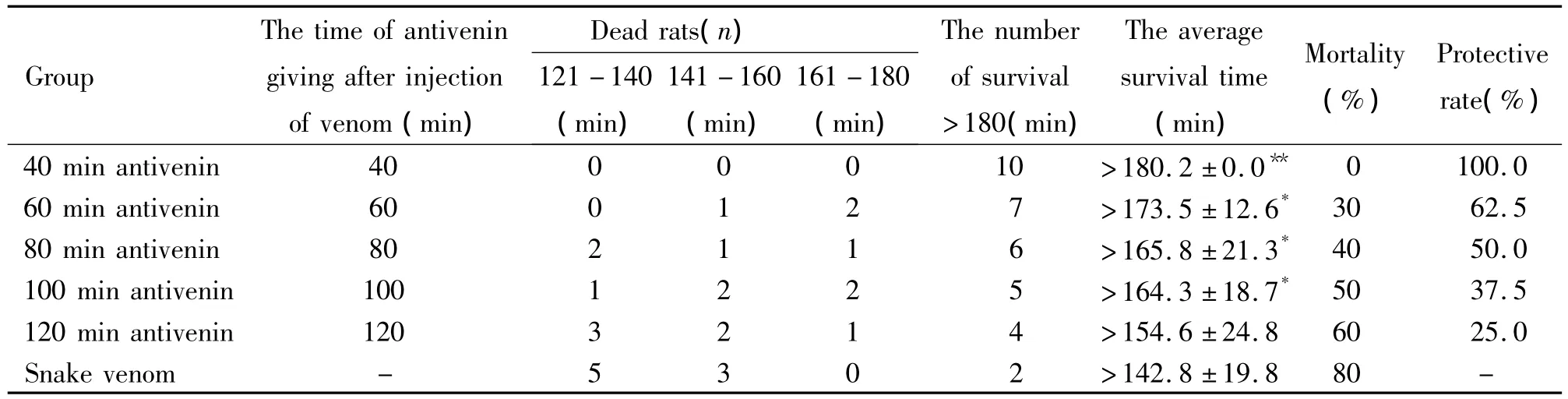
表3 注入4 LD50眼镜蛇毒后不同时点施予抗血清对大鼠存活时间的影响Table 3.After injection of 4 LD50cobra venom in rats,the effecf of giving antivenin on the survival time of rats at different time points(n=10)
讨 论
眼镜蛇属混合类蛇毒,神经毒、血循毒兼有之。其主要毒性成分为神经毒素、细胞毒素、磷脂酶A2(PLA2)等。细胞毒素(cytotoxin,CTX)又称为心脏毒素,对心脏和呼吸有明显毒性;CTX可直接损伤细胞生物膜导致细胞结构破坏、坏死,细胞通透性改变使CK -MB、AST 等释放增多[6]。
从表4可知,在60 min时点时,肝酶、心酶均出现第1个峰值,提示肝脏、心脏功能受损明显。近年来国外的药代动力学研究表明,眼睛蛇毒的各种成分在深部组织中的快速分布时间为22-47 min[7]。而国内对舟山眼镜蛇蛇毒及其相关组份药代动力学研究表明,其在哺乳动物体内的快分布相半衰期(T1/2)为40 min左右,3个不同剂量(75、150和300 μg/kg)的眼镜蛇毒组份60 min仅能改变曲线下面积,但对T1/2无显著影响[8]。在本实验中,酶学的第1个峰值出现在注毒后60 min,说明蛇毒在大鼠体内经快速分布扩散或渗透入机体重要靶器官,从而对心、肝等组织造成了直接的损伤。
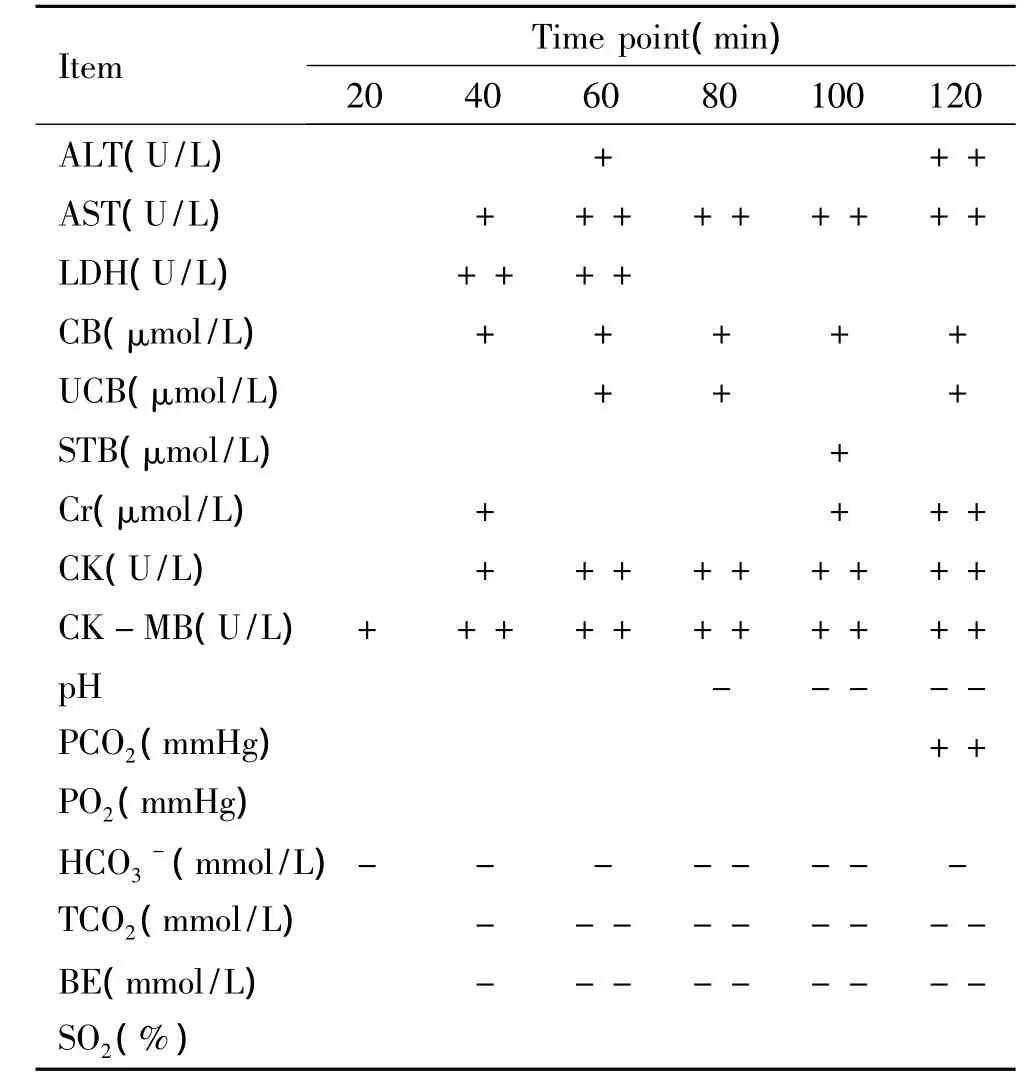
表4 注入4 LD50蛇毒肖后不同时点相关指标的差异Table 4.4 LD50snakebite related indicators at different time points
在80 min时点,酶学曲线表现为“谷值”,大鼠多项生化指标较60 min时点有所下降,该种现象可能与毒素已基本完成在体内的快分布并已有部分被清除,此时毒素对各脏器细胞直接损伤亦较前一时点相对减少,加之机体尚有一定的自我修复能力,故在酶学上检测到的相关指标有所下降,呈现出“好转”的假象。
眼镜蛇伤大鼠在生化检测方面表现为2个峰值,而血气分析的检测则可用于区分这2个峰值;若生化检测提示心、肝功能损伤而pH正常,则提示为第1个峰值,而且处于蛇伤早期(相当于本次实验中的0-60 min时点);反之,若存在多器官功能损伤且合并血气分析检查提示代谢性酸中毒,则为第2个峰值,则为蛇伤后期(相当于本次实验中的80-120 min时点)。结合抗蛇毒血清组的结果可知,在蛇伤的早期(0-60 min时点),及时使用抗蛇毒血清能取得很好的疗效;而在蛇伤的后期(80-120 min时点),因蛇毒已使部分靶器官的细胞产生不可逆损伤,抗蛇毒血清的保护作用大大降低,故此时在使用抗蛇毒血清之外,治疗重点应放在防止并发症以及生命支持等治疗上,如:糖皮质激素的应用,机械通气治疗,血液净化等[11]。另外,我们提出动态观察多项指标的变化,可更科学地指导抗蛇毒血清的应用以及提高对症治疗的疗效。
[1]毛晓农.实用蛇伤急救医学[M].第1版.南昌:江西科学技术出版社,2005.72-73,201.
[2]黄伟青,梁子敬,苏雪娥.毒蛇咬伤的早期预测与程序化救治的疗效观察[J].蛇志,2004,16(13):7-8.
[3]程祖耀.抗蛇毒血清的应用与并发症处理[J].浙江中医学院学报,2005,29(5):72.
[4]祁俊华,钟吉富,孔天翰.双价抗蛇毒IgY灌胃对眼镜蛇、蝰蛇伤小鼠的保护作用[J].中国病理生理杂志,2009,25(8):1600-1605.
[5]陈学文,冯凤琼,钟兆堂,等.抗眼镜蛇毒血清对中华眼镜蛇伤大鼠保护的时效性研究[J].蛇志,2007,19(4):257-260.
[6]Wang CH,Liu JH,Lee SC,et al.Glycosphingolipid-facilitated membrane insertion and internalization of cobra cardiotoxin.The sulfatide,cardiotoxin complex structure in a membrane-like environment suggests a lipid-dependent cell-penetrating mechanism for membrane binding polypeptides[J].Biol Chem,2006,281(1):656 -667.
[7]Ismail M,Aly MH,Abd-Elsalam MA,et al.A threecompartment open pharmacokinetic model can explain variable toxicities of cobra venoms and their alpha toxins[J].Toxicon,1996,34(9):1011-1026.
[8]Cher CD,Armugam A,Zhu YZ,et al.Molecular basis of cardiotoxicity upon cobra envenomation[J].Cell Mol Life Sci,2005,62(1):105 -118.
[9]Richard W,Carlson,Richard C,et al.Rattlesnake venom shock in the rat:development of a method[J].Am J Physiol,1975,229(6):1668 -1674.
[10]符 健,邝少轶,邢桂兰,等.CTX对家兔肺损伤早期血气与酸碱平衡调节改变的研究[J].海南大学学报自然科学版,2004,22(1):75-77.
[11]梁永源,梁子敬.蝰蛇咬伤的综合救治措施评价[J].现代临床医学生物工程学杂志,2000,6(2):61.

