盐酸头孢吡肟合成路线图解
王志贤,张海波,陈言德
(扬子江药业集团有限公司泰州新药研究院,江苏泰州 225321)
盐酸头孢吡肟(cefepine hydrochloride,1),化学名为 1-{[(6R,7R)-7-[(2Z)-(2-氨基-4-噻唑基)(甲氧亚氨基)乙酰胺基]-2-羧基-8-氧化-5-硫杂-1-氮基二环[4,2,0]-辛-2-烯-3-基}甲基吡咯烷鎓氯盐酸盐,是由美国布迈-施贵宝公司研制的第四代注射用头孢菌素,1993年于瑞典首次上市。本品对革兰阴性菌,特别是大肠埃希菌、绿铜假单胞菌具有良好的抗菌活性[1]。本文综述了盐酸头孢吡肟(1)的合成路线,按起始原料不同有两条路线:
1 合成路线图解
1.1 以3-氯代甲基头孢菌素为起始原料的合成路线
1.1.1 化合物 5[2-3]与 3-氯代甲基头孢菌素(6)缩合得 7[4],7与NaI发生置换反应得8,8与NMP烷基化后得9[5],9去保护、成盐后得1[5](图1)。9也可由8与吡咯烷反应得10,10与碘甲烷络合得 9[5];或8经与m-CPBA反应得 11,11与NMP烷基化得12,12与碘化钾在酰氯下络合得9。
1.1.2 保护了羧基的3-氯代甲基头孢菌素(13)用苯甲醛保护胺基得14,14与NaI发生置换反应得15,15与NMP经烷基化反应后得16[5]或14直接与NMP缩合得16,16经甲酸水解、去保护得到2[6],2与活性酯反应得1,共有3种路线(图2):①2与苯并三唑活性酯11缩合、成盐得1[5];②2与已有工业产品的 MAEM(12)经缩合、成盐得 1[7];③2与 2-甲氧亚氨基-2-(2-氨基-4-噻唑基)-(Z)-乙酸二乙基磷酰活性酯 13缩合,成盐得1[8]。
1.2 以7-氨基-3-乙酰甲氧基-头孢-3-烯-4-羧酸 (7-ACA)为起始原料的合成路线
1.2.1 化合物7-ACA用三甲基碘硅烷(TMSI)或六甲基二硅胺(HMDS)做硅烷化试剂在不同的溶剂中保护羧基和氨基,引入碘后得到17,17与NMP烷基反应得到21,21经甲醇水解、去保护得 2[7,9,10],同“1.1.2”法得 1(图 2)。 以上不同溶剂为,①使用三氟三氯甲烷作为溶剂[8];②使用氟利昴类溶剂[10];③使用环烷烃作为溶剂[10];④使用二氯甲烷作为溶剂[12]。
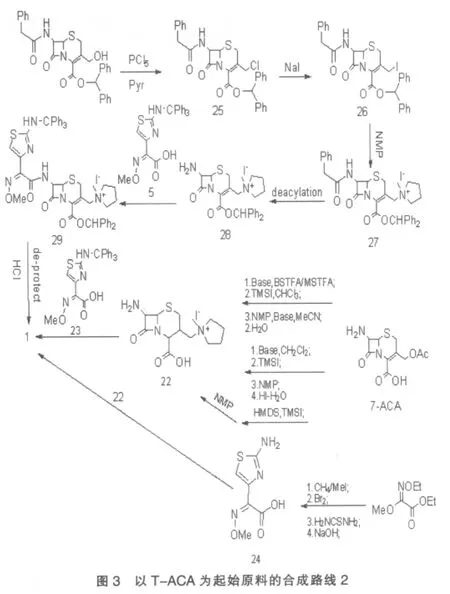
1.2.2 化合物7-ACA用BSTFA/MSTFA或TMS/HMDS保护羧基和氨基,引入碘后和NMP经烷基化反应得22,22与23发生缩合、去保护、成盐后得1[12];或22与24缩合、水解得1(图3)。
1.2.3 保护了羧基和氨基的7-ACA在PCl5中氯化得25,25与NaI经置换反应后得26,26与NMP经烷基化反应后得27,27脱酰得2,2与活性酯5缩合得29,29经去保护、成盐后得 1[4](图 3)。
2 讨论
第四代注射用头孢菌素盐酸头孢吡肟因其用途广泛,在疗效方面较突出,对其进行合成改进的文献报道较多,本文对其合成路线进行了归纳总结,主要是以3-氯代甲基头孢菌素或7-氨基-3-乙酰甲氧基-头孢-3-烯-4-羧酸(7-ACA)为起始原料有2条合成路线,两种方法各有优势,在生产中可根据实际情况来选择适合的路线。


[1]张致平.抗菌药物研究进展[J].中国抗生素杂志,2002,27(2):67-69.
[2]BlumbachJ,DurckheimerW,RedenJ,etal.Penicillins and Cephalosporins[P].DE:2758000,1979.
[3]Masataka F.Production of Cephalsporin Derivative[P].JP:5409-5589,1979.
[4]Aburaki S,Kamachi H,Narita Y,et al.Cephalosporing[P].DE:3307550,1983.
[5]Naito T,Aburaki S,Kamachi H,et al.Synthesis and structure-activity relationships of a new series of cephalosporins,BMY-28142 and related compounds[J].Journal of Anribiotics,1986,39(8):1092-1107.
[6]程青芳.7-氨基-3-(1-甲基四氢吡咯)甲基-3-头孢-4-羧酸盐酸盐的合成改进[J].化学试剂,2005,27(6):377-378.
[7]安明,常珍.盐酸头孢吡肟的合成[J].中国医药工业杂志,2004,35(9):515-516.
[8]晃明永,郝爱友.盐酸头孢吡肟的合成新方法[J].山东化工,2005,34(5):6-7.
[9]Steven P Brindidge,Paul R Brodfuehrer,Chet Sapino,et al.Process for preparing cephalosporin intermediater[P].US 4868294,1989.
[10]Gary Lim,Fayetteville,John M Roubie,et al.Process for preparing cephalosporin intermediates[P].US 5594131,1979.
[11]Donald G,Walker,Pau R,et al.Use of bistrimethylsilylnted intermediates in the preparation of semisynthetie 7-amino-3-substitutedcephems,expedient syntheses of a new-3-[(1-methyl-1-pyrrolidinio)methy1]cephalosporin [J].Journal of organic chemistry,1988,(53):983-991.
[12]Lattrell R,Blumbach J,Duerckheimer W,et al.Synthesis and structure-activity relationshios in the cefpirome series[J].Journal of Sntibiotics,1988,31(10):1374-1394.

