艾滋病伴肺部感染的临床及影像学相关问题
李宏军 齐 石 宋文艳 包东英
肺部是HIV相关性合并症最主要的受累器官,肺部感染是导致死亡率上升的主要原因。HIV相关性肺部感染的病原体主要包括寄生虫、真菌、分枝杆菌、病毒、细菌以及弓形体等。国外报道,不同的病原菌在地里分布上存在差异,同时与地区的经济状况密切相连,疾病谱有所不同,如在美国,肺囊虫肺炎(pneumocystis pneumonia,PCP)、结核和反复发生的细菌性肺炎(1年内发生2次以上)在HIV感染者频繁发生[1,2];国外10年前报道PCP是HIV感染者最常见、最严重的肺部机会性感染,目前随着抗逆转录病毒治疗及预防措施应用,其发病率有所下降;未知感染HIV病毒的病人中,初发PCP将会继续发生。另外,HIV相关性病毒和寄生虫感染国内外均有报道[3]。本文分析讨论HIV相关性肺部感染的临床和影像学表现,为临床提供有效的诊断依据,目的即降低HIV相关性肺部感染的发病率。
在艾滋病病人的整个发病过程中,多为一个系统或器官发生并发症为主,很少侵犯多个系统。随着免疫水平逐渐减低及存活时间延长,发生肺部多种病原体感染机会增多,表现为多病原体、多元化影像表现。
肺囊虫肺炎
肺囊虫过去认为属于原虫,最近有学者根据其超微结构和对肺囊虫核糖体RNA种系发育进行分析,认为肺囊虫属真菌类,对肺组织有高度的亲和力[3]。AIDS病人由于机体免疫力降低,95%的病人合并不同类型的肺部感染,其中PCP是最常见的威胁生命的机会性感染,发病率占60%~85%[4,5],大约90%~95%的PCP病发生在CD4计数低于200cell/μ l的青少年和成年人。
典型PCP临床表现为发热、咳嗽(干咳无痰)、呼吸困难、胸闷气短,呼吸困难呈进行性加重,开始仅在活动时发生,以后在平静时也感到呼吸困难,病人常伴有消瘦、乏力、贫血、体重下降、全身不适、淋巴结肿大等。上述症状为非特异性,但病人常自觉症状严重而体征较轻,多数肺部听诊无明显异常,或仅有轻微干、湿罗音,这是AIDS合并PCP的临床特征。大部分PCP病人血清LDH水平升高,但血清LDH水平升高是非特异性。HIV病人合并PCP时,血 PO2降低,中晚期病人血PO2往往小于70mmHg[6]。PCP的影像学检查包括胸片和CT,但胸片的分辨率低,对PCP的早期诊断受限。早期病变胸片往往显示阴性,或仅表现为肺纹理增重,肺野透亮度减低,而CT检查却能发现微小病变或更详细的肺内改变,特别是HRCT的应用,大大提高了病变的检出率,国外报道有近10%的PCP病人胸片表现正常而HRCT有异常改变[7]。由于PCP病情发展快,病理表现复杂,因此其CT显示多样化,同时具有特异性。根据不同时期肺部CT的不同表现,将PCP分为早(渗出、浸润)、中(融合、实变)、晚(吸收或纤维化)三期。早期典型表现为肺内多发粟粒状小结节,以两中下肺野分布为主,可伴有肺门影增大,此时需要与急性粟粒型肺结核相鉴别(图1)。
中期为浸润期,随着病变进展,粟粒及斑片状阴影融合扩大为均匀致密的浸润阴影,呈弥漫性磨玻璃改变,典型表现为以肺门为中心双侧对称,病灶自肺门向两侧肺间质浸润,由中肺向下肺发展,HRCT病灶显示更清晰,呈地图样或碎石路征,其内可见清晰的含气支气管穿过,肺尖部受累较晚,肺野外带透亮度增加,可见典型的“柳叶征”或“月弓征”,为代偿性肺气肿表现(图2,3)。
晚期代偿修复期,肺内病变以实变、纤维化为主,见大片状高密度影及索条状、网织状改变(图4,5)。其他可见合并症,如气胸、纵隔气肿、肺气囊、胸腔积液等,其中肺气囊约在10%~20%的病例可见。
病理变化主要表现为间质性肺炎,早期改变为肺泡壁毛细血管壁基底膜通透性增加,液体渗出,肺囊虫大量增殖、黏附,使I型肺泡上皮细胞变性,基底膜剥脱。肺间质内血管充血、水肿及淋巴细胞、浆细胞和单核细胞浸润(图6)。
真菌感染
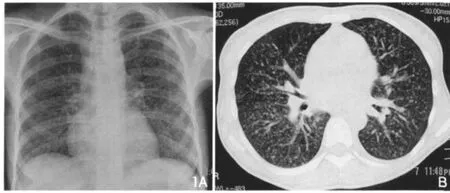
图1 PCP。胸片(A)显示两肺纹理增多伴随点状密度增高阴影,透亮度降低。CT(B)显示两肺对称分布多发点状密度增高阴影,以肺门为中心,并以两肺背段显著。
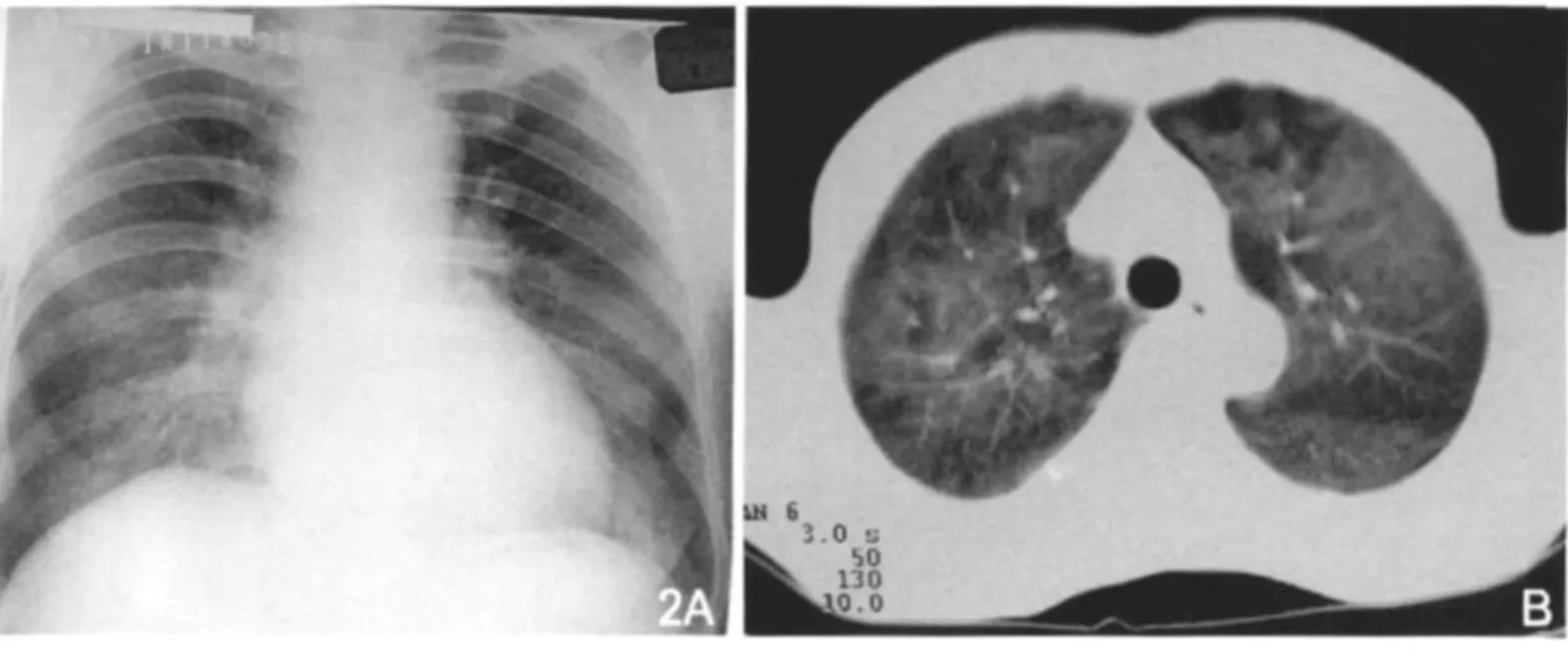
图2 PCP。胸片(A)显示两肺门影增大、增浓。CT(B)显示两肺对称性分布的磨玻璃影,以肺门为中心。
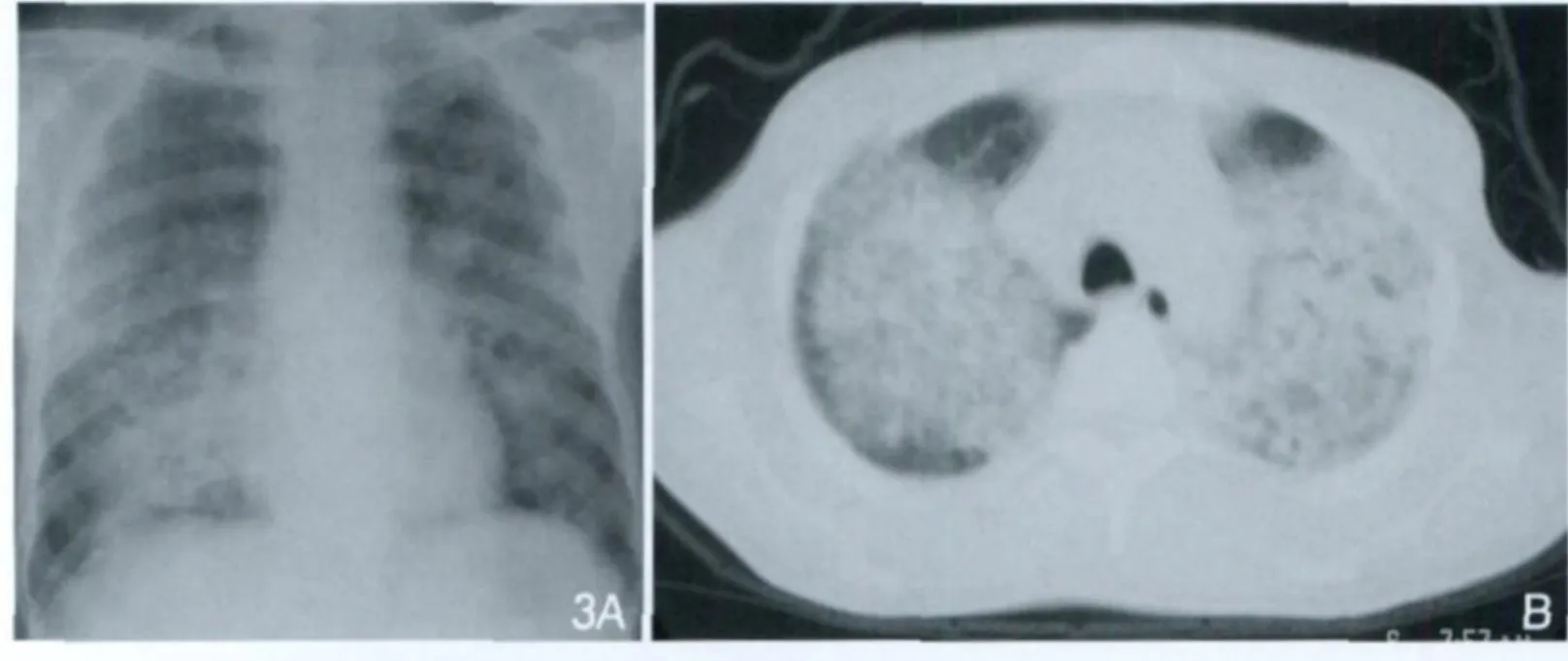
图3 PCP。胸片(A)显示两肺以肺门为中心的片状阴影,边缘模糊。CT(B)显示两肺大片状实变影,病灶以中内带为著,肺野外带见“柳叶”样透亮区。
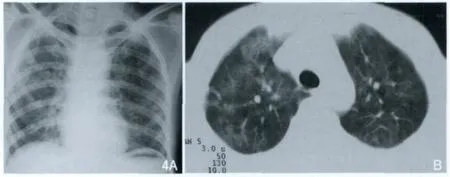
图4 PCP。胸片(A)显示两肺内见多发索条状及网格状阴影,以肺野中内带为著。CT(B)显示两上肺斑片状及索条状阴影。

图5 PCP。胸片(A)显示双侧中下肺野中内带索条状及斑片状阴影。CT(B)显示两肺野透亮度减低,其内见索条状及斑片状磨玻璃样阴影。

图6 HE染色显示肺泡壁出血、水肿,少量淋巴细胞聚集。A.低倍镜下。高倍镜下。
真菌感染多发生在病人CD4计数低于100cell/μ l时,其中肺部感染最常见的为曲霉菌,马尔尼菲青霉菌次之,而白念珠菌、组织胞浆菌引起的肺部感染较少见,隐球菌肺部感染的发病率报道不一,近年来有发展趋势[8]。也有地区性常见的真菌感染,如我国广西和香港等地AIDS病人的肺真菌感染多为青霉菌[9]。曲霉菌广泛分布自然界,HIV阳性病人合并曲霉菌感染,与皮质类固醇激素或广谱抗生素的应用有关,多发生在AIDS晚期或死亡前。肺部真菌感染时,组织切片中如发现菌丝(曲霉菌或念珠菌)或胞浆内酵母体(组织胞浆菌),同时有组织细胞的反应包括中性粒细胞的浸润,组织细胞的坏死,即可诊断为侵入性真菌感染。曲霉菌感染时,痰液中能够见到菌丝,但由于曲霉菌在自然界广泛存在,痰涂片阳性常不能明确病人有侵入性感染。
1.隐球菌肺炎
隐球菌感染多发生在病人CD4计数低于200cell/μl时,特别是低于50cell/μl时发病概率上升。隐球菌感染往往以脑膜炎或脑膜脑炎的形式出现,肺部感染常伴有脑膜炎或单独出现,临床表现为发热、咳嗽、呼吸短促,很少伴有胸痛,约10%的隐球菌感染者出现呼吸衰竭[10]。隐球菌肺炎可以发生肺内任何部位,多位于双侧下肺多灶性。影像表现:其常见的表现有肺纹理增加,孤立性或多发性结节,后者可融合成肿块影。Schofield等1992年则将肺部病变分为:①原发综合征:由胸膜下病变和受累淋巴结构成。②肉芽肿型:为较大的实体性肉芽肿,内含大量多无活力的酵母菌,外周纤维肉芽组织包绕,内含大量巨噬细胞。③肺内粟粒状病变:病灶呈粟粒样大小,弥漫分布。④空洞形成:有时病灶中心坏死,空洞形成,10%~16%可发生薄壁空洞。双侧弥漫性间质浸润、斑片融合、结节、胸膜炎、肺门淋巴结肿大等都有报道[11]。也有个例报道隐球菌肺炎呈肺内肿块、单独的胸膜渗出及气胸等。另外,部分隐球菌感染的病例肺部可表现为阴性(图7A)。病理变化主要为渗出性或肉芽肿性反应,病灶中有巨噬细胞、淋巴细胞和多核巨噬细胞浸润,很少形成化脓性病变。慢性肉芽肿可伴有广泛纤维化(图7B)。
2.曲霉菌肺炎
曲霉菌是一种条件致病菌,吸入后便侵犯支气管壁及肺组织,引起渗出性及坏死性病变,继发化脓性肺炎、肺脓肿,脓液及坏死物排出后可致空洞形成。有时空洞内可有真菌球形成。由于曲霉菌的类型不同、侵犯部位不同及机体反应不同,肺曲霉菌的表现类型不同,可分为4种类型,包括支气管肺炎、播散型曲霉菌性败血症、曲霉菌球、变态反应型[12]。临床可表现为畏寒、发热、喘息、咳嗽、咳黏液性痰、咯血、胸痛。变态反应型可引起呼吸困难、哮喘。咯血较严重时,可成为死亡的主要原因。X线检查可见肺部浸润、空洞病灶,表现为圆形阴影,边界清楚,可随体位改变而移动。如支气管阻塞,腔中液体出现液面,有时可见空气“新月体”(air-crescent),可与肿瘤相鉴别。曲霉菌侵犯血管,血栓形成可引起出血性梗死。可有磨玻璃样改变、结节或伴有空腔的结节,没有空腔的结节少见。继发于空腔的曲霉菌感染是影像诊断曲霉菌病的特异性征象(图 8)。
3.马尔尼菲青霉菌肺炎

图7 AIDS合并隐球菌肺炎。胸部CT(A)见两肺片状磨玻璃样阴影,右下肺后基底段见类圆形结节影,表面见浅分叶。病理(B)显示大量隐球菌芽胞及菌丝生长。
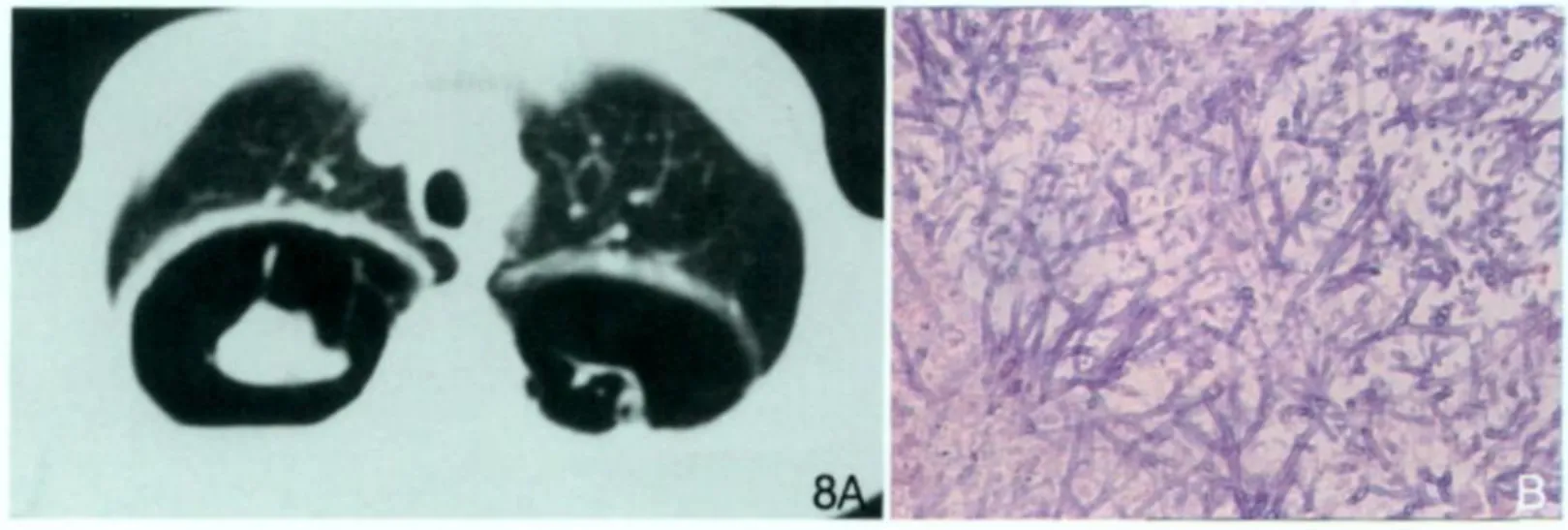
图8 AIDS合并肺曲霉菌病。胸部CT(A)显示两上肺见厚壁空洞,壁厚薄均匀,洞内见结节或索条影。病理(B)显示大量的曲霉菌菌丝生长呈草丛状。
马尔尼菲青霉菌(Penicillium marneffei,PM)是1956年才被发现的青霉属中的新品种[13,14],分布于东南亚及我国南方,竹鼠是其自然宿主。它是条件致病菌,免疫功能低下者易感染而致马尔尼菲青霉病(penicilliosis marneffei,PSM)。感染途径可以通过竹鼠的粪便污染土壤进行传播,人可通过呼吸道、消化道以及皮肤损伤而感染该菌。PM感染被认为是东南亚地区艾滋病病人最常见的机会性感染之一,并有逐渐增多趋势[15,16]。临床上长期发热、进行性消瘦、咳嗽咯痰、皮疹、贫血、淋巴结肿大等为特征。马尔尼菲青霉菌肺炎的病理由于PM酵母相色素的极强疏水性,促进霉菌相分生孢子和酵母相细胞黏附于肺泡巨噬细胞和其他部位的巨噬细胞,引起单核巨噬细胞丰富的器官增大,如淋巴结肿大等,可形成巨噬细胞肉芽肿等,并有多核巨细胞反应[17]。Kudeken等[18]在马尔尼菲青霉菌感染免疫正常鼠的研究中发现,马尔尼菲青霉菌经过复杂的CD4+T细胞介导引起致命性的高炎症反应状态。而在AIDS病人由于机体CD4+T细胞严重衰竭,合并马尔尼菲青霉菌肺部感染时,巨噬细胞吞噬能力明显减弱, 渗出改变相对为少,以增殖为主,仅引起无反应性坏死性炎症,并形成空洞[19]。李宏军等[20]研究一组病例影像表现为群聚的不规则厚壁空洞为其特征,反映出了其病理特点以增殖为主的坏死性空洞,而群聚特点可能与PM沿支气管扩散有关(图9A)。肺部穿刺活检标本25°C培养后显微镜下可见菌丝体分支分隔及其成串的小孢子或扫帚状菌丝生长(图 9B)。
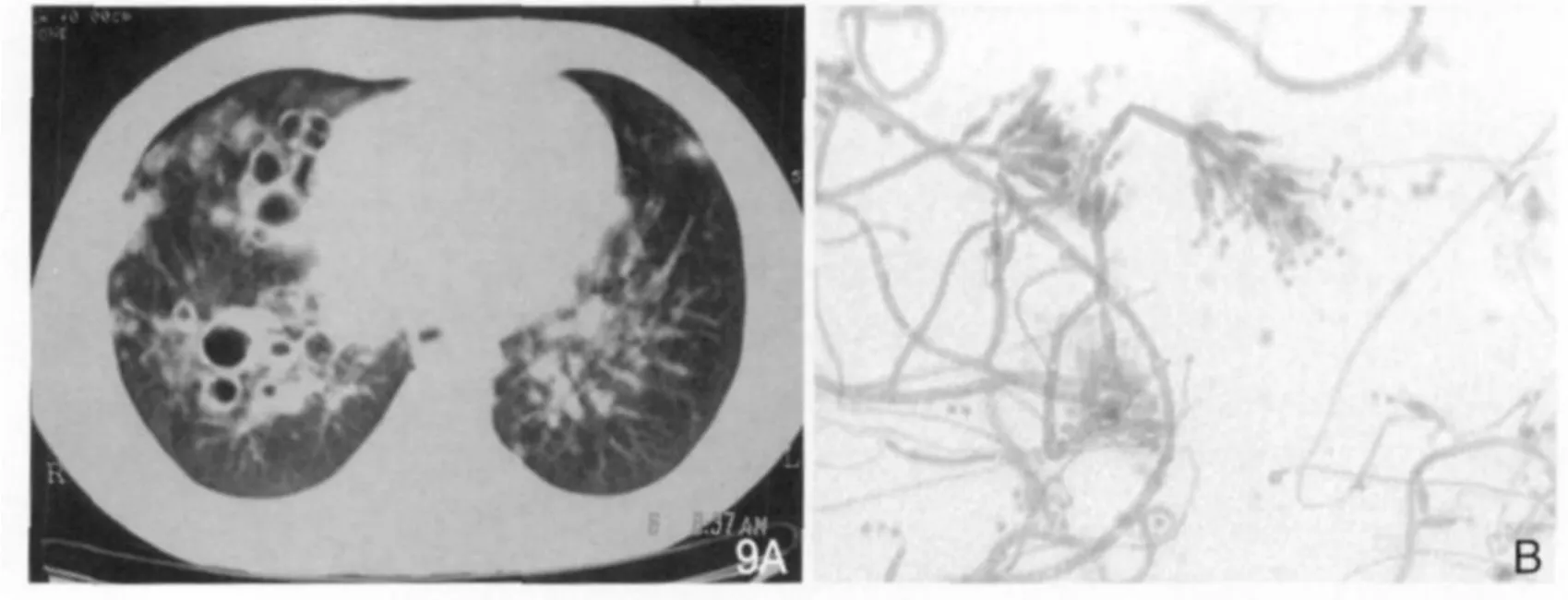
图9 AIDS合并马尔尼菲青霉菌肺炎。胸部CT(A)显示两下肺多发高密度结节,右下肺见多发大小不等的空洞,壁厚薄不均,内壁光滑。镜下(B)可见菌丝体分支分隔及其成串的小孢子,有典型的帚状枝。
4.念珠菌肺炎
白念珠菌是一种酵母样菌,广泛存在于自然界,可寄生在人的皮肤、口腔、肠道、阴道等处黏膜上。正常情况下不致病,当人体抵抗力低下时可致病。当念珠菌侵入组织内转变为菌丝型,并大量繁殖,毒性较大,并有对抗吞噬作用的能力。临床起病缓慢,主要为低热和中等度发热,较少高热。咳嗽、气促、发绀,精神萎靡或烦躁不安。肺部体征包括听诊呼吸音减弱,可有肺部湿性口罗音明显,严重者可有全身中毒症状。病程迁延反复,影像学分为:①支气管炎型:胸片示双肺中下肺野纹理增多。②肺炎型:白念珠菌肺炎常伴肺外病变。病变主要分布于中下肺野。肺尖一般不受累,病灶此起彼伏,反复出现。少数病人可并发渗出性胸膜炎。③播散型:呈粟粒状阴影、弥漫性结节阴影或多发性小脓肿。X线表现为肺纹理增粗,伴随斑点状、小片状及大片实变阴影,呈支气管肺炎表现。严重者病灶扩大融合可累及整个肺叶。CT显示肺结节,少数有毛玻璃样改变(图10A)。病理表现为急性炎性病灶,肺泡内渗出及单核细胞、淋巴细胞及中性粒细胞浸润。急性播散性病变常致多发微小脓肿,中心干酪坏死,病灶中及周围有孢子及菌丝(图10B)。
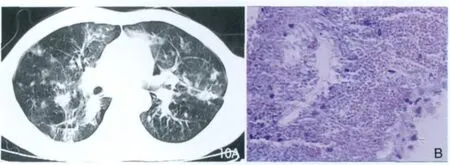
图10 AIDS合并肺念珠菌感染。胸部CT(A)显示两肺内多发索条状及斑片状阴影;HE染色(B)显示大量念珠菌芽胞生长。
5.组织胞浆菌肺炎
组织胞浆菌属于真菌界、半支菌纲、丛梗胞科。组织胞浆菌生长需要有机氮,常在富含鸟类或蝙蝠排泄物的土壤中分离出来。鸡、鸟、狗、猫及鼠等传染。组织胞浆菌病的分生孢子及菌丝片段被吸入后,多数被机体防御机制清除。可形成肉芽肿,免疫低下者可形成播散性组织胞浆菌病。艾滋病病人当CD4计数小于150cell/μl时,组织胞浆菌可在肺部发生感染[21]。组织胞浆菌肺炎在南美、非洲,印度等地发病率较高[22]。轻者临床表现类似感冒症状,低热、咳嗽、全身不适,重者出现流感症状,畏寒、高热、咳嗽、胸痛、呼吸困难、乏力、食欲不振。可在1个月内形成薄壁空洞,并发症可有心包炎、关节炎、皮肤结节、皮疹纤维性纵隔炎、纵隔肉芽肿等[12]。没有特异性影像表现,可见散在肺泡渗出,多发3mm左右结节伴间隔增厚,可形成肉芽肿伴钙化[22]。主要与细菌性肺炎、肺结核、肺部其他真菌感染鉴别,通过实验室检查明确诊断,组织胞浆菌糖原抗原检测特异性可达98%[12]。
6.毛霉菌肺炎
毛霉菌主要经呼吸道传播,毛霉菌极易侵犯血管,特别是动脉血管,在局部繁殖,或引起血栓形成、栓塞。临床表现为高热,咳嗽,咳痰,气促,胸闷,胸疼,咳血(肺动脉受累)。影像表现为片状炎症病灶,常有肺空洞和肺梗死表现。病理变化为局部组织出血性梗死和肺炎,中性粒细胞渗出。局部组织出血性梗死可能与菌丝引起小动脉病变引起。
肺结核
估计世界上有1/3的人口感染过结核杆菌,其中9%的病人为艾滋病感染者[23]。世界健康组织报道,全球每年新增加8.8万结核病人,其中8.4%是由于艾滋病引起的[24]。HIV感染病人存在巨大的由潜在结核感染发展为活动性结核的风险。HIV感染病人,估计每年1000人有35~162人发生活动性结核,而非HIV人群每年1000人有12.9人[7]。HIV感染肺结核病人年龄以中青年为主,男性多于女性。结核可以发生在AIDS的任何阶段及CD4计数的任何水平[25],国外报道,HIV感染者合并肺结核的影像学表现没有特异性,常常以急性发病,急性发病率是非HIV病人的2.5倍[2]。病变形态多种多样,有别于非HIV感染者合并肺结核的影像表现,前者以急性发作为主,而后者以继发病变为主,多见空洞、纤维化、胸膜肥厚、钙化等[26,27]。国内研究,AIDS合并肺结核,急性病例以粟粒性和渗出性病变为主,发病率分别占33%和49%;而空洞、纤维化及钙化等慢性病例的发生比率明显下降,分别为 11%、11%、2%[28]。HIV感染者的结核发病越晚,免疫缺陷越严重,临床及影像表现越不典型。当CD4计数在 350~400cell/μl水平之上时,临床表现同非HIV感染者相同点:全身症状为发热、寒战、盗汗、乏力、食欲减退、体重减轻。呼吸道症状表现为咳嗽、咳痰、咯血、胸痛、呼吸困难等。影像往往表现为原发性肺结核,病灶以中下肺分布为主,多叶多段均可发生。而当CD4计数下降时,结核的影响范围增大,包括肺外结核和弥散性疾病的发生。当CD4计数降至200cell/μl以下时,多表现为急性发病(如粟粒性肺结核)或肺外结核(如回盲部结核)及周围淋巴结结核形式出现(图11)。临床表现同非HIV感染者(表1)不同点:①肺部浸润多见,累及多部位,空洞少见。②播散发生率高(87%~96%)常经血液循环播散,肺外结核发生率较高(60%~70%)。③淋巴结结核多见。如肺门、纵膈、胸外淋巴结肿大。④结核菌素试验(PPD)阳性率很低。⑤较多病人无痰,痰涂片抗酸杆菌染色阴性。⑥耐药菌株发生率高,复发率高,病死率高。

表1 A IDS与非AIDS中伴发结核的比较
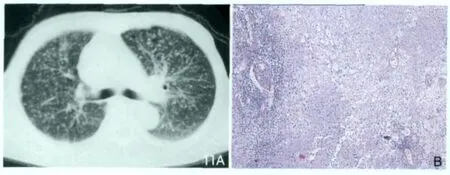
图11 AIDS合并肺结核。CT(A)显示两肺弥漫散在粟粒状结节,分布均匀;病理(HE低倍,B)显示干酪样坏死,上皮样细胞,淋巴细胞。
HIV感染者合并肺结核病人病灶变化快,经抗结核治疗后,病灶吸收快或消失;未经治疗的,病灶易融合成团状,或弥漫性分布。
细菌性肺炎
在艾滋病病人中常发生细菌性败血症,许多条件致病菌都可能引起呼吸系统感染,引起细菌性支气管炎、肺炎和胸膜炎。细菌性肺炎的发生率为3%~5%。BP对HIV感染者比非HIV人群的影响范围大[29]。在HIV感染者中,反复发作的BP被认为是潜在HIV感染者的首先表现形式,因此对于那些反复发生肺炎而没有其他肺炎风险因素的个体,应警惕HIV感染。常见的细菌有肺炎链球菌、金黄色葡萄球菌、马红球菌、嗜血杆菌及铜绿假单胞菌,同非HIV感染者一样,肺炎链球菌和流感嗜血杆菌是最常导致肺炎的主要病原菌[30],军团杆菌及克雷伯杆菌也不少见。HIV感染病人机体T淋巴细胞减少,宿主的中性粒细胞、单核细胞、细胞介素生产紊乱,B淋巴细胞功能障碍等多种因素,为机会性细菌感染提供条件,此外广谱抗生素的应用,也增加了机会性感染的概率。BP可发生在HIV的任何阶段、CD4计数的任意水平,而当CD4计数下降时,BP的发病概率增大。
HIV感染者的临床表现同非HIV感染者一样,典型表现是急性发作(3~5d)、高热 (39~40℃)、寒战、胸痛、呼吸困难、咳嗽、咳脓痰(可带血或呈铁锈色)。与非HIV感染不同的是,HIV感染病人的肺内感染常反复发作。
HIV相关性细菌性肺炎的影像表现同非HIV感染者相似。大部分链球菌和流感嗜血杆菌肺炎表现为单侧、局限性、部分或叶渗出病变的融合,偶尔合并胸膜渗出。影像学上,早期仅见肺纹理增粗、紊乱;随着病情发展,肺泡内充满炎性渗出物,可表现为大片炎症浸润影或实变影,实变影内可见支气管充气相,病变沿肺段或肺叶分布,少数可伴有少量胸腔积液;吸收期,实变影密度逐渐减低,范围缩小,个别病例可出现“空洞”,多数病例3~4周后才完全消散。老年病人及反复发作的病人病灶吸收较慢,很难完全吸收,往往发展为机化性肺炎(图12)。
马红球菌于1923年首次发现并命名为马棒状杆菌(corynebacterium equi),后经细胞壁结构分析,发现本菌与棒状杆菌属有较大差异,因此将其归属为马红球菌[31]。马红球菌一般认为是马、猪和牛的致病菌,人类马红球菌感染少见,近年来,由于免疫缺陷综合征病人增多,马红球菌引起人类呼吸道感染和败血症等报道增多[32]。马红球菌是细胞内的兼性寄生菌,最佳生长温度为30℃,适宜温度为10~40℃[33]。马红球菌抗酸染色的结果不确定,且因其形态多样,常会被误认为类白喉杆菌、芽胞杆菌或微球菌。在羊血液琼脂上,该菌与金黄色葡萄球菌、产单核细胞李斯特菌和假结核棒状杆菌之间可产生协同溶血现象[34]。此为马红球菌的特征表现。马红球菌的毒性机制过去大多数是猜测的,直到最近发现了有毒的质粒[35,36],这为研究马红球菌感染的致病机制拓展了新的思路。临床:病人多有咳嗽、吐桔红色痰、高热等症状,Marchior等[37]人(2005)所研究的5例合并马红球菌肺部感染的艾滋病病人都有1~2个月的咳嗽和发热历史,伴随呼吸急促和胸痛。李宏军等[38]研究的一组13例病人中显示均有发热,体温均在 38~40℃,咳嗽,吐桔红色痰10例,咯血4例,呼吸困难11例,肺部湿口罗音13例,消瘦 6例,食欲不振6例,腹泻2例,关节痛 1例,口腔念珠菌感染13例,口腔疱疹4例,胸痛4例,无明显症状1例,乙肝3例。发热、咳嗽、呼吸困难、胸痛等为本病典型临床表现,而其他如消瘦、腹泻、关节痛等则不具有代表性。

图12 AIDS合并细菌性肺炎。胸片(A)显示左侧肺门外上方团块状高密度影,外缘较清,密度均匀。MR冠状位(B)显示左侧肺门外方团块状软组织信号影,内部信号不均匀。
影像表现:马红球菌性肺部感染的影像学表现依据病程可分为三期。早期表现为位于一侧肺门周围类圆形片状模糊阴影,边缘模糊;中期(实变期)显示单侧肺门区的中心型类似球形密度增高阴影,实变,边缘清楚;晚期(坏死期)显示肺部肿块继发空洞,也可出现液气胸、胸膜炎等。影像表现虽具有一定特征性,但缺乏特异性(图13),需与肺部肿瘤鉴别诊断。马红球菌感染最普通的病理改变是慢性化脓性支气管肺炎和广泛性肺部脓肿[37]。李宏军等[38]研究的一组13例病人中显示肺泡腔内大量出血,肺泡壁完整,大量上皮细胞,也可以以成纤维细胞为主,肺组织实变,肺泡间隔增厚,PAS染色可见聚集成堆的条状紫红色马红球菌(图13)。
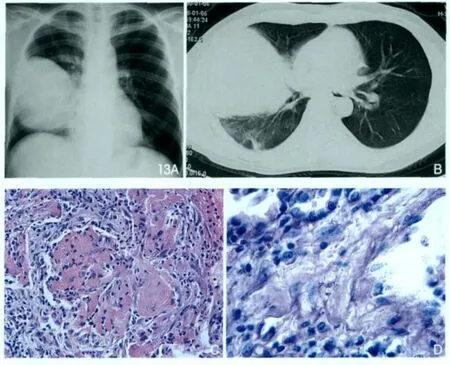
图13 AIDS合并肺马红球菌感染。胸片(A)显示右中下肺野见巨大类圆形软组织肿块,密度均匀,边界清晰。CT(B)显示右肺内类圆形软组织肿块,内部密度均匀,边缘清晰。HE染色(40×,C)显示肺泡腔内大量出血,大量红细胞,胞壁完整,大量上皮细胞,也可以以成纤维细胞为主,肺组织实变,肺泡间隔增厚。PAS染色(D)可见聚集成堆的条状紫红色马红球菌。
病毒性肺炎
HIV感染者肺部常见的病毒主要有流感病毒和巨细胞病毒(cytomegalovirus,CMV),而巨细胞病毒是艾滋病病人肺部感染常见的病原体,在艾滋病病人尸检报告中,49%~82%的病人合并巨细胞病毒感染[39-41],仅次于耶氏肺囊虫肺炎。Moskowitz等[40]报道,导致艾滋病病人死亡的直接原因中,19%是由于肺部巨细胞病毒感染所引起的。由于巨细胞病毒肺炎缺乏典型的临床表现和敏感的早期诊断方法,所以尸检前巨细胞病毒肺炎确诊率只有13%~24%[39-41]。CMV感染的临床表现没有特异性,病人发热、关节肌肉酸痛,阵发性干咳、进行性气促,活动时呼吸困难。肺部可继发真菌或合并细菌、真菌、耶氏肺囊虫感染,使病情复杂化。病理上,巨细胞病毒可广泛存在于受染病人全身各器官组织内,感染可直接导致受染宿主细胞损伤;此外,还可能通过免疫病理机制产生致病效应。有人把CMV肺炎分为弥漫性、粟粒性坏死和巨细胞性三种类型。弥漫性和巨细胞性常伴有弥漫性肺泡损伤 (DAD),以弥漫性常见,巨细胞性少见。有时可以看到CMV与其他感染共存于肺内,甚至共同感染一个细胞。如细胞内包涵体,俗称“鹰眼征”。
巨细胞病毒肺炎的影像学表现多种多样, 国外学者通过大量确诊病例研究总结出CT表现:毛玻璃样改变、肺实变、网格状改变、支气管壁增厚、支气管扩张、肺部结节或肿块等,其中以早期的毛玻璃样改变及晚期的肺部肿块表现为主[42]。肺部病变常表现为弥漫性间质浸润或肺泡浸润,CT显示肺内磨玻璃样密度影伴随多发小结节,这些小结节的病理基础为出血坏死。如有肺实变提示有细菌和真菌感染(图14)。
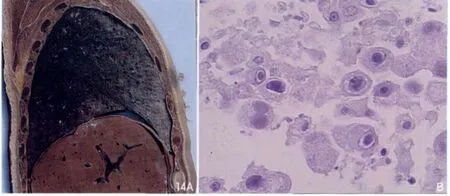
图14 CMV肺炎。断层标本(A)显示肺组织变硬呈黑褐色;病理(B)显示巨细胞包涵体呈典型“鹰眼征”。
淋巴细胞间质性肺炎
淋巴间质性肺炎是肺的淋巴组织异常增生,它的发生与免疫性疾病有关,被认为是肺对HIV的直接反应。临床表现可有复发性感染,食欲减退,肝脾肿大,发育停滞。CT检查无特征性,表现为支气管壁增厚,弥漫性小叶中心结节或支气管扩张。肺部呈粗细不均的网格状、索条状阴影。病理变化为聚集淋巴细胞、浆细胞混合浸润于肺泡间质并扩展到支气管周围区域。
弓形体肺炎
弓形体肺炎(toxoplasma pneumonia)是由细胞内寄生的弓形虫感染所致,Ludlam等(1963)首次提出肺弓形虫病的概念,认为弓形虫可引起不典型肺炎。临床表现为咳嗽、咳痰,严重者可引起呼吸困难、发绀等。慢性者可有长期低热、咳嗽,体重减轻,淋巴结肿大。影像上可表现为支气管肺炎、间质肺炎及胸膜炎。①支气管肺炎又称小叶性肺炎:散在分布斑片状模糊密度阴影;②间质性肺炎:典型表现为网状、结节状阴影;③胸膜炎:很少见。可出现胸腔积液,膈肌活动受限。影像表现缺乏特异性,需结合病因学检查才能确诊。病理变化为肺泡壁及支气管壁周围结缔组织充血水肿,肺间质增宽。肺泡和肺间质内少量浆液纤维蛋白渗出和巨噬细胞、淋巴细胞浸润,肺间质和巨噬细胞、肺泡上皮内可能查到弓形虫包囊和速殖子。
卡波西肉瘤
卡波西肉瘤是1872年发现的一种恶性肿瘤,属于血管性肿瘤,又称多发性出血性肉瘤、多发性脉管肉瘤、多发性色素性肉瘤。卡波西肉瘤被认定是艾滋病病人的定义性肿瘤,在欧美男性同性恋者中曾出现了暴发性流行。据统计,约30%同性恋的白种人中,卡波西肉瘤是艾滋病感染者的主要并发症,且多最早出现,已证实的是,尽管卡波西肉瘤是一种侵袭力较强的肿瘤,但该病本身对病死率影响不大,大多数的病人仍死于机会性感染。卡波西肉瘤以出现于面部和颈部者较多,多深红色至紫红色斑块,指压不褪色,其周围有褐色瘀斑。常侵犯多个内脏器官(肺、脾、口腔、淋巴结、胃肠道、肝等)。肺部是重要发病部位,影像上可见肺门淋巴结肿大及其周围结节样浸润,并有双侧间质性改变,胸腔积液是其典型X线表现(图15)。病理组织改变早期类似一般的血管瘤,毛细血管密集成团,其间含吞噬含铁血黄素的组织细胞,血管内皮细胞整齐。进一步发展可见内皮细胞及成纤维细胞增生活跃,核分裂增多并出现间变,血管间散在有淋巴细胞及组织细胞。至晚期,血管腔闭塞并发现坏死,肿瘤中常可见到新生的毛细血管不规则的管腔、裂隙,其中充满血液,常有出血(图15)。在我国这种肿瘤较少见。对肿瘤的确诊须赖于病理检查。

图15 卡波西肉瘤。胸片(A)显示右侧肺门增大,杂乱呈“鸟窝状”,双下肺可见片状阴影。CT(B)显示多发的类圆形结节影。
综上所述,艾滋病相关性肺部感染在艾滋病影像学疾病谱中占重要位置,影像诊断是肺部感染的不可替代的重要检查手段,早期预防、正确诊断是改善病人生存质量和延长病人生命的关键,但艾滋病相关肺部合并症的复杂性、多重性给我们在临床工作中提出了提出新的要求和挑战;首先做好艾滋病并发症分型,再根据各分型的疾病谱结合免疫指标进行逐一排除,进行诊断和鉴别诊断,HIV相关性肺部感染的诊断应当结合临床病史的进展过程及实验室检查更进一步明确诊断,达到具有针对性、个性化诊断,更好地服务于临床。
1.World Health Organization(WHO)/Joint United Nations Programme on HIV/AIDS(UNAIDS).Report on the Global AIDS Epidemic,2008[EB/OL].[Accessed 15 April 2009.]Available From.URL:http://www.unaids.org/en/KnowledgeCentre/HIVData/GlobalReport/2008/2008-Global-report.asp2008
2.Jones JL,Hanson DL,Dworkin MS,et al.Surveillance for AIDS-defining opportunistic illnesses,1992~1997.MMWR CDC Surveill.Summ,1999,48:1-22
3.宋文艳,李宏军.艾滋病合并肺部巨细胞病毒感染的影像学与病理对照 .放射学实践,2010,25:44-46
4.Lawrence J,Huang C,George P,et al.Roentgenographic Patterns of Pneumocystis Carinii Pneumonia in 104patients with AIDS.CHEST,1987,91:323-327
5.Amorosa JK,Nahass RG,Nosher JL,et al.Radiology Distinction of Pyogenic PulmonaryInfection from Pneumocystis Carinii Pneumonia in AIDS Patients.Radiology,1990,175:721-724
6.刘德纯主编.艾滋病临床病理学.合肥:安徽科学技术出版社,2002:338-344
7.The National Institutes of Health(NIH)the Centers for Disease Control andPrevention(CDC),andthe HIV Medicine Association of the Infectious Diseases Societyof America(HIVMA/IDSA).Guidelines for Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents[EB/OL] .MMWR,2009.[Accessed 15 April 2009.Available from URL:http://aidsinfo.nih.gov/contentfiles/Adult-OI.pdf
8.曹 彬,朱元珏,许文兵,等 .肺隐球菌病临床分析.中华结核和呼吸杂志.2002,25:610-612
9.罗 宏,梁 伶.马尔尼菲青霉菌流行病学研究进展.中国皮肤性病学杂志,2006,20:627-629
10.Visnegarwala F,Graviss EA,Lacke CE,et al.Acute respiratory failure associated with cryptococcosis inpatients with AIDS:analysis ofpredictive factors Clin Infect.Dis,1998,27:1231-7
11.Meyohas MC,Roux P,Bollens D,et al.Pulmonary cryptococcosis:localized and disseminated infections in 27patients with AIDS.Clin Infect Dis,1995,21:628-633
12.李梦东,王宇明,王 钥 ,等 .实用传染病学 .第3版 .北京:人民卫生出版社,2005
13.Capponi M,Sureau P.Penicillium de Rhizomys Sinensis.Bull Soc Pathol Exot,1956,49:418-421
14.Segretain G.Penicillium marneffei agent dune mycose due system reticuloendo thelial.Mycopathol Mycol Appl,1959,11:327-353
15.Disalvo A F,Fickling AM,Ajello L.Infection caused by penicillium marneffei.AM J Clin Pathol,1973,60:259-263
16.邓卓霖.进行性播散性马尔尼菲青霉病 .广西医学院学报,1984,1:1-3
17.邓卓霖,马 韵.酷似组织胞浆菌病的马尔尼菲青霉病 .中华病理学杂志,1999,28:384-386
18.Kudeken N,Kawakami K,Saito A.CD4+T cell-mediatedfatal hyperinflammatory reactions in mice infected with Penicillium marneffei.Clin ExpImmunol,1997,107:468-473
19.DengZ,Ribas JL,Gibson DW,et al.Infections caused byPenicillium marneffei in China and Southeast Asia:review of eighteen published case and report of our more Chinese cases.Rev Infect Dis,1998,10:640-652
20.李宏军,张玉忠.艾滋病合并马尔尼菲青霉菌肺炎的CT表现.放射学实践,2009,24:952-954
21.Wheat LJ,Connolly-Stringfield PA,Baker RL,et al.Disseminated histoplasmosis in the acquired immune deficiency syndrome:clinical findings,diagnosis and treatment,and review of the literature.Medicine(Baltimore)1990,69:361-374
22.Lacombe C,Lewin M,Monnier-cholley L,et al.Imaging of Thoracic Pathologyin Patients with AIDS.J Radiol 2007,88:1145-1154
23.Guilherme FG,Alexandre SM,Cid SF,et al.Clinical and radiographic features of HIV-related pulmonary tuberculosis accordingto the level of immunosuppression.Rev Soc Bras Med Trop,2007,40:622-626
24.Dolin PJ,Raviglione MC,Kochi A.Global tuberculosis incidence and mortalityduring1990-2000.Bull World Health Organ.,1994,72:213-220
25.Havlir DV,Barnes PF.Tuberculosis in patients with human immunodeficiency virus infection.N Engl J Med,1999,340:367-373
26.Batungwanayo J,Taelman H,Dhote R,et al.Pulmonary tuberculosis in Kigali,Rwanda.Impact of human immunodeficiency virus infection on clinical and radiographicpresentation.Am.Rev.Respir.Dis,1992,146:53-56
27.Jones BE,Young SM,Antoniskis D,et al.Relationship of the manifestations of tuberculosis toCD4 cell counts in patients with human immunodeficiencyvirus infection.Am Rev Respir Dis,1993,148:1292-1297
28.Awil PO,Bowlin SJ,Daniel TM.Radiology of pulmonary tuberculosis and human immunodeficiencyvirus infection GULU,U-ganda.Eur Respir J,1997,10:615-618
29.Hirschtick RE,Glassroth J,Jordan MC,et al.Bacterial pneumonia in persons infected with the human immunodeficiency virus.PulmonaryComplications of HIV Infection StudyGroup.N Engl J Med,1995,333:845-51
30.Burack JH,Hahn JA,Saint-Maurice D,et al.Microbiology of community-acquiredbacterial pneumonia in persons with and at risk for human immunodeficiency virus type 1 infection.Implications for rational empiric antibiotic therapy.Arch Intern Med,1994,154:2589-2596
31.金法祥,王红华,黄志刚 .32株马红球菌的耐药分析 .中华预防医药杂志,2006,7:55-56
32.Hondalus MK,Diamond MS,Rosenthal LA,et al.The intracellular bacterium Rhodococcus equi requires Mac21 to mammalian cells.Infect Immun,1993,61:2919-2929
33.Walsh RD,Schoch PE,Cunha BA.Rhodococcus.Infect Control HospEpidemiol,1993,14:282-287
34.Takai S,Sasaki Y,Ikeda T,et al.Virulence of Rhodococcus equi isolates from patients with and without AIDS.J Clin Microbiol,1994,32:457-460
35.Takai S,Sekizaki T,Ozawa T.Association betweenlargeplasmid and 15 to 17 kilo dalton antigens in virulent Rhodococcus equi.Infect Immun,1991,59:4056-4060
36.Tkachuk,Saad O,Prescott J.Rhodococcus equiplasmids:Isolation and partial characterization.J Clin Micor bio1,1991,29:2696-2700
37.Marchior I,Muller NL,de Mendonca RG,et al.Rhodococcus equipneumonia in AIDS:high-resolution CT findings in fivepatients.The British Journal of Radiology,2005,78:783-786
38.李宏军,曹志浩,黄 葵,等 .艾滋病合并马红球菌肺部感染的影像表现与病理对照.放射学实践,2009,9:943-947
39.Wallace MJ,Hannah J.Cytomegalovirus pneumonitis in patients with AIDS:findings in an autopsy series.Chest,1987,92:198-203
40.Moskowitz L,HensleyGT,Chan JC,et al.Immediate causes of death in acquired immunodeficiency syndrome.Arch Pathol Lab Med,1985,109:735-738
41.McKenzie R,Travis WD,Dolan SA,et al.The causes of death in patients with humanimmunodeficiency virus infection:aclinical and pathologic study with emphasis on the role of pulmonary diseases.Medicine,1991,70:326-343
42.Geogeann MD,John V,Stuart M,et al.Cytomegaloviruspneumonitis:spectrum of parenchymal CT findings with pathologic correlation in 21 AIDSpatients.Radiology,1994,192:451-4598

