胰头部肿块型慢性胰腺炎与胰头癌的CT鉴别诊断
田 笑,鹿 强,殷小平,梁广路
(河北大学附属医院CT/MRI科,河北 保定 071000)
胰头部肿块型慢性胰腺炎与胰头癌的鉴别诊断一直是临床工作中的难点,两者影像学表现及临床表现相似。笔者收集了2003年4月~2009年7月我院证实的胰头部肿块型慢性胰腺炎与胰头癌各30例患者的CT资料,分析其间差异,探讨CT检查对两者的诊断及鉴别诊断价值。
1 材料与方法
60例胰腺疾病患者行CT检查,其中胰头部肿块型慢性胰腺炎患者30例,男18例,女12例,年龄32~64岁,平均48岁。胰头癌患者30例,男20例,女10例,年龄48~78岁,平均65岁。主要临床表现为腹部不适、腹痛、黄疸。所有病例均经手术、病理活检,为临床证实。
采用德国Siemens公司Somatom Sensation 64层CT机。扫描方式采用螺旋扫描,P值为1,层厚5mm,间隔4mm。所有病例均先行平扫检查,而后进行增强检查。增强对比剂为碘海醇(300mgI/ml),总量为60~70ml,流率为3.0ml/s,动脉期为注药开始后30~35s,门脉期为 60~70s。
全部图像的观察由2位专家共同完成。数据采用SPSS 16.0软件进行处理。60例胰头肿块与正常胰腺的动脉期、门脉期平均CT值采用±s表示,3者之间比较采用单因素方差分析,动脉期与门脉期比较采用配对t检验。
2 结果
胰头部肿块型慢性胰腺炎组:①肿块平扫:胰头增大,外形光滑,无明显分叶27例。肿块呈等密度或等高混杂密度,17例肿块内伴钙化(图1)。②增强:炎性肿块动脉期平均 CT值为(48±12)HU,呈相对均匀低密度(图2a),门脉期逐渐强化,平均CT值为(78±11)HU,与正常胰腺门脉期强化无明显差异(P>0.05),呈等密度强化(图 2b)(表 1)。③胰体尾增大15例,假囊肿13例(图3)。④胰管改变:14例胰管贯通胰头部病灶;18例远端胰管扩张,平均直径为5mm,串珠样扩张15例,平滑性扩张3例;13例伴有胰管钙化(图3)。⑤胆管形态的改变:12例胆总管扩张,平均直径为9.2mm;远端自上而下逐渐变细10例(图2a),2例为突然截断。⑥双管征10例。⑦15例肾前筋膜增厚。
胰头癌组:①肿块平扫:胰头局限性增大,边缘有分叶25例,与正常胰腺分界不清。肿块为等或等低混合密度(图4a),未见钙化。②增强:本组30例动脉期肿瘤轻度不均匀强化,平均CT值为(41±13)HU(图 4b),门脉期平均 CT 值为(47±17)HU,与动脉期强化程度无明显差异(P>0.05),癌肿仍显示相对低密度(表1)。③胰体尾萎缩18例(图4d)。④胰管改变:25例胰管扩张,21例为平滑性扩张(图5),病灶处截断24例(图4c)。⑤胆管形态的改变:胆管扩张25例,于胰头处截断21例(图4b)。⑥不相交征20例(图4c),双管征20例(图4d)。⑦2例肾前筋膜增厚。
表1 胰头癌和胰头部肿块型慢性胰腺炎患者与正常组之间在动脉期和门静脉期CT值比较(±s)

表1 胰头癌和胰头部肿块型慢性胰腺炎患者与正常组之间在动脉期和门静脉期CT值比较(±s)
注:与正常胰腺组比较,1:P<0.01,2:P<0.05。 列内比较采用单因素方差分析,行内比较采用配对t检验。
组织 动脉期 门静脉期 t P正常胰腺(n=30)104±14 85±12 5.64 <0.01胰头癌(n=30)41±131 47±171 1.54 >0.05肿块型胰腺炎(n=30)48±122 78±11 6.73 <0.01 F 210.82 66.44 P<0.01 <0.01
3 讨论
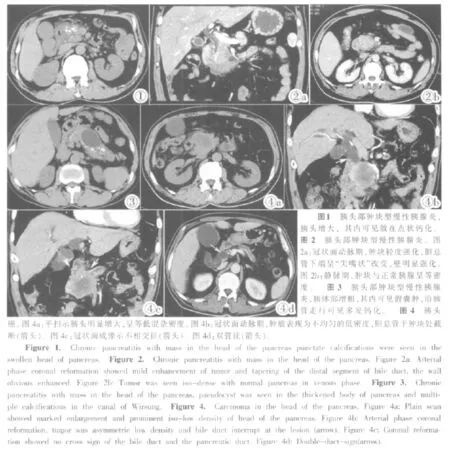
肿块型慢性胰腺炎又称假肿瘤性胰腺炎或炎性肿块,为节段性慢性胰腺炎的一种特殊类型,多位于胰头部[1]。胰头癌是最常见的消化系统恶性肿瘤之一,90%以上来自胰管上皮细胞,常早期浸润导管系统致胰管阻塞、远端胰管扩张、胰腺组织萎缩纤维化。两者在病理、临床表现和实验室检查方面有诸多相似,故两者的诊断及鉴别诊断一直是临床工作中的难点。本文对胰头部肿块型慢性胰腺炎(以下简称炎性肿块)与胰头癌的CT特征作了相应的探讨和比较。
3.1 肿块平扫
炎性肿块主要病理改变为胰腺广泛纤维化或钙化,腺泡萎缩。肿块轮廓较光整、无分叶,平扫时一般与正常胰腺组织呈等密度或等高混杂密度,钙化最多见,呈砂粒样或斑片状钙化。胰头癌多围绕胰腺主导管浸润性生长而形成肿块,胰头部明显增大变形,边缘呈分叶状,与正常胰腺分界不清,多呈等或等低混合密度,液化坏死多见,钙化极少见。
3.2 肿块增强
静脉注入对比剂后,由于正常胰腺腺体由动脉供血灌注,早期即可出现明显强化。炎性肿块由于小叶间或胰管周围纤维组织增生,故肿块有类似于纤维组织的血供特点,多表现为动脉期轻微强化,病灶呈相对低密度,门脉期逐渐强化。本研究中胰头炎性肿块组与正常胰腺门脉期强化CT值无明显差异(P>0.05),表现为等密度强化,该征象对胰头肿块型慢性胰腺炎与胰头癌的鉴别诊断具有重要意义[2]。胰头癌是一种供血少且无包膜的实质肿瘤,在注射造影剂后,强化程度弱、速度慢,动脉期肿瘤多表现为不均匀的低密度病灶,与周围供血丰富的正常胰腺迅速明显增强形成鲜明对比。门脉期肿瘤的强化与动脉期无明显差异(P>0.05),与正常胰腺对比不如动脉期明显,癌肿仍显示相对低密度,边缘模糊不清。
3.3 胰体尾萎缩与假囊肿
炎性肿块是胰腺反复炎症的结果,通常整个胰腺都伴有炎性改变,胰体尾部常有纤维组织增生和炎性细胞渗出而致体尾部肥大,与胰头癌胰头肿块伴体尾部萎缩的征象具有重要鉴别意义。假性囊肿的形成也是慢性胰腺炎的较特征性表现,病理机制为血液、胰液外渗以及组织坏死崩解物的积聚未能及时吸收,被纤维组织粘连包裹所致。胰腺癌假囊肿的发生率较低,体积较小,单发,位于肿瘤远端胰腺组织内,一般不超过胰腺轮廓;慢性胰腺炎囊肿的发生率较高,常多发,大小不一,位置不定,胰腺内外均可发生且多超出胰腺轮廓[3]。
3.4 胰管扩张与钙化
慢性胰腺炎时主胰管及分支多呈串珠状扩张或扭曲,主胰管管径平均为5mm,同时多数伴有胰管内钙化,笔者根据本组结果并结合文献分析[4-5]认为沿主胰管走行的钙化是诊断胰头部炎性肿块的可靠征象。本组14例可见到主胰管穿过炎性肿块呈光滑的狭窄性改变或无异常,即“胰管穿透征”[6],是炎性肿块的特征性改变,这一征象普通扫描不易见到,增强后2mm薄层放大扫描可清晰见到该征象,用“胰管穿透征”鉴别两者的特异性高达93%[7]。
胰头癌80%以上癌细胞起源于1~2级胰导管上皮,短期内导致胰管进行性狭窄以致闭塞,梗阻端呈突然截断,远端胰管多呈光滑的连续性扩张。
3.5 胆管扩张
肿块型胰腺炎常与胆管炎合并存在,互为因果[8]。本组12例胆总管扩张,胆管壁增厚约2~3mm,增强后管壁呈环形强化。扩张的胆总管圆形光滑,自上而下逐渐变细呈“尖嘴状”,无突然中断、变形,平均直径为9.2mm。
胰头癌病程短、进展快,常早期侵犯压迫胆总管致肝内外胆管明显扩张,肝内胆管扩张多呈软藤状改变,胆总管壁常因急性梗阻而变薄,少有增厚及环形强化的表现,胆总管下端呈截断或不规则狭窄,胆管扩张程度大于胰头部炎性肿块扩张的程度。
3.6 双管征与不相交征
“双管征”即胆总管与主胰管同时扩张。本研究中胰头癌和胰头部炎性肿块双管征分别占76.7%及20%,因此双管征的出现强烈提示胰头癌的诊断[9]。经仔细对比两组“双管征”发现:胰头癌双管征表现为胆总管胰头部截断并伴有胆总管左移内收成角,肝内胆管扩张,胰头段胰管截断,胰体尾胰管均匀扩张;而双管征在胰头部炎性肿块中表现为胆总管扩张程度较轻,末端逐渐变细,肝内胆管无扩张,胰管多呈串珠样扩张。
“不相交征”即胆总管和主胰管胰头段因癌瘤侵袭而破坏截断,其残存之胆总管与残留主胰管扩张不相交的现象,为胰头癌MRCP诊断的特异征象[10]。笔者研究本组30例并复习既往文献中的插图,认为该征象同样适用于胰头癌的CT诊断。胰头癌组出现率为83.3%,胰头部炎性肿块组未见此征象。CT不仅可以显示胆总管及主胰管在胰头段破坏而于壶腹部呈不相交征,而且可以明确显示肿块的位置所在。
3.7 肾前筋膜或肾周筋膜增厚
肿块型慢性胰腺炎时胰腺组织坏死出血,由于胰周缺乏完整包膜,炎性渗出物及坏死物向胰周及肾旁间隙内扩散,累及肾前或肾周筋膜使其增厚,该征象为提示胰腺慢性炎症的有力佐证。而当癌肿侵犯周围脂肪组织时,常引起脂肪间隙的消失,一般不会引起肾周筋膜的增厚。
综上所述,胰头部肿块型慢性胰腺炎与胰头癌的CT鉴别要点:①肿块平扫:炎性肿块外形光滑,无明显分叶,多呈等高混杂密度,钙化常见。癌肿外形不规则,边缘多分叶,境界模糊,呈等或略低密度,液化坏死多见,钙化极少见。②强化:炎性肿块大多为渐进性均匀强化,动脉期呈短暂低密度,至门脉期接近等密度。胰头癌呈轻度不均匀强化,动脉期与门脉期均呈相对低密度。③胰体尾萎缩与假囊肿:炎性肿块多伴有体尾部增粗及假囊肿形成。胰头癌多伴有胰体尾萎缩,假囊肿少见。④扩张的胰管:炎性肿块处胰管多穿通病灶,远端胰管呈串珠状扩张,多伴有胰管内钙化。胰头癌胰管多呈平滑扩张并在肿块处截断。⑤扩张的胆管:肿块型慢性胰腺炎的胆总管下段呈逐渐变细的“尖嘴状”改变。胰头癌的胆总管于肿块处呈突然截断。⑥双管征多见于胰头癌,不相交征为胰头癌的特异征象。⑦肾前筋膜增厚:炎性肿块多伴有肾前筋膜增厚,癌肿很少见此征象。总之,胰头部肿块型慢性胰腺炎与胰头癌的CT表现具有一定差异,CT检查对两者的鉴别诊断具有重要的临床意义。
[1]陈韵彬,Hoeffel JC,李铭山.假肿瘤性胰腺炎的CT表现[J].临床放射学杂志,2000,19(11):710-712.
[2]Kim T,Murakami T,Takamura M,et al.Pancreatic mass due to chronic pancreatitis:correlation of CT and MR imaging features with pathologic findings[J].AJR,2001,177(2):367-371.
[3]陈翼,赵云辉,许乙凯,等.联合运用MRI多种成像技术在胰腺肿块鉴别诊断中的价值[J].临床放射学杂志,2006,25(1):49-53.
[4]Maartense S,Ledeboer M,Masclee AA.Chronic pancreatitis relation between function and morphology[J].Dig Liver Dis,2004,36(1):61-67.
[5]Kahl S,Zimmermann S,Genz I,et al.Biliary strictures are not the cause of pain in patients with chronic pancreatitis[J].Pancreas,2004,28(4):387-390.
[6]Schima W.MRI of the pancreas:tumours and tumour-simulating process[J].Cancer Imaging,2006,20(6):199-203.
[7]Ly JN,Miller FH.MR imaging of the pancreas:a practical approach[J].Radiol Clin North Am,2002,40(6):1289-1306.
[8]张善华,王培军,李晓兵,等.肿块型胰腺炎的CT诊断[J].胰腺病学,2002,2(2):91-94.
[9]Adamek HE,Albert J,Breer H,et al.Pancreatic cancer detection with magnetic resonance cholangiopancreatography and endoscopic retrograde cholangiopancreatography:a prospective controlled study[J].Lancet,2000,356(9225):190-193.
[10]席永昌,席大鹏,赵吉生,等.胰头癌的MRCP临床诊断的特异征象[J]. 实用放射学杂志,2005,21(9):923-925.

