蟹抗氧化肽的分离纯化及活性研究
范建凤,王泽南*,杨 柯,李洪波,郭俊珍,周小芬
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
天然抗氧化肽具有较强的抗氧化活性和很高的安全性,近年来已成为各国研究的重点。从水产品中以酶解法制备抗氧化肽已经得到广泛研究[1],如Binsan等[2]从白虾头中提取出抗氧化肽具有很好的体外清除自由基及还原能力,Qian等[3]分别用多种酶水解牛蛙皮蛋白提取并纯化得到抗氧化活性很高的多肽,这充分证明水产品中的优质蛋白具有制备抗氧化肽的潜力。蟹下脚料中除了含甲壳质外,还含有丰富的蛋白质,目前国内对蟹下脚料的研究主要集中在甲壳素的制备等方面,而对其蛋白水解产物抗氧肽制备与分离纯化方面尚未见报道。
本实验选用中性蛋白酶水解蟹下脚料制得蟹抗氧化肽,再采用葡聚糖凝胶进行分离纯化,并对分离所得样品的理化特性进行测定,旨在为蟹下脚料的抗氧化肽开发利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
梭子蟹下脚料 汕头市侨丰集团有限公司。
葡聚糖凝胶G-25 上海贝基生物科技有限公司;铁氰化钾、邻二氮菲、邻苯三酚、三氯乙酸、重水、硫酸亚铁(均为分析纯);乙腈(色谱纯)。
BT200恒流泵、自动收集器、核酸蛋白检测器 上海奇特仪器有限公司;层析柱(1.6cm×50cm) 上海贝基生物科技有限公司;721分光光度计 上海精密科学仪器有限公司;TDL-50B离心机 上海安亭科学仪器厂;FD-1型真空冷冻干燥机 北京博医康实验仪器有限公司;S433D氨基酸自动分析仪 德国SYKAM公司。
1.2 方法
1.2.1 蟹抗氧化肽粗品的制备工艺流程[4]
蟹下脚料→脱脂→水浴热处理→酶解→灭酶→离心(4000r/min,10min)过滤→抗氧化肽粗品
1.2.2 蟹抗氧化肽粗品的分离纯化[5]
通过葡聚糖凝胶G-50与G-25对蟹抗氧化肽粗品进行两步分离纯化。将粗品配制成质量浓度为5g/100mL的溶液,经0.45μm微孔滤膜过滤后用葡聚糖G-50进行分离,上样量为1mL,以蒸馏水为洗脱液,流速为1mL/min,检测波长为280nm,分管收集,每管2mL,合并同一分离峰的洗脱液,冷冻干燥,测定各分离组分的还原力。将还原力最大的组分继续经葡聚糖G-25进行分离,步骤同上。
1.2.3 蟹抗氧化肽的相对分子质量测定[6-7]
分离后所得的组分由Sephadex G-25分析检测其相对分子质量。以蒸馏水为洗脱液,样品流速为1mL/min,标准样分别为牛血清蛋白、还原型辅酶Ⅰ、VB12,其相对分子质量(Mr)分别为67000、663.45、1302。测定各标准样的洗脱体积(Ve),以标准样的相对分子质量的对数值lgMr为横坐标,Ve为纵坐标制作标准曲线。样品液的相对分子质量由其洗脱体积和标准曲线求得。
1.2.4 蟹抗氧化肽抗氧化特性的测定
实验通过测定三价铁离子还原力、清除超氧自由基能力和清除羟自由基能力来综合反映蟹抗氧化肽的抗氧化性。
1.2.4.1 还原力的测定
采用Viliak等[8]的方法并稍作修改。取样品液0.1mL,加入0.2mol/L PBS溶液(pH6.6)和1g/100mL的铁氰化钾溶液各2.5mL,混合物于50℃水浴中加热20min,再加10g/100mL三氯乙酸溶液2.5mL,充分混合后,3000r/min离心5min。取上清液2.5mL,加入蒸馏水2.5mL和0.1g/100mL三氯化铁溶液0.5mL,静置10min后,在700nm波长处测定其吸光度A700nm。以A700nm值反映还原力大小,A700nm值越高,水解物的还原力越大。
1.2.4.2 超氧自由基清除率的测定
采用Wu等[9]的方法,并稍作修改。将0.1mL样品液加入2.8mL pH8.2的Tris-HCl缓冲溶液中,空白组加入去离子水,25℃ 10min后加入0.1mL 3mmol/L的邻苯三酚溶液(25℃水浴预热),迅速混匀并计时,320nm波长处测定吸光度,隔30s读取一次,5min结束。以0.2mL去离水加2.8mL 0.1mol/mL pH8.2的磷酸缓冲液调零。作吸光度随时间变化的回归方程,其斜率为样品邻苯三酚自氧化速率(V样品);空白对照管以蒸馏水代替样品,测定邻苯三酚自氧化速率(V对照)。
1.2.4.3 羟自由基清除率的测定
采用Thiansilakul等[10]的方法,并稍作修改。取5mmol/L邻二氮菲溶液0.6mL加入PBS(pH7.4)0.6mL,充分混合,加入2mL多肽溶液以及体积分数0.1%的双氧水0.4mL摇匀,37℃ 1h后,测定样品液在波长536nm处的吸光度(A样品)。按照上述操作,采用去离子水代替样品液测得损伤管吸光度(A损伤),采用去离子水代替样品液和双氧水测得未损伤管吸光度(A未损伤)。

1.2.5 蟹抗氧化肽的纯度鉴定[11-12]
将分离后活性最高的组分用HPLC法测定其纯度。取样品用重蒸水溶解、过滤。层析条件:Restek C18柱(250mm×4.6mm,5μm);流动相:乙腈与重蒸水(含体积分数0.1%三氟乙酸)体积比1:19;流速为1mL/min;进样量为5μL;检测波长为280nm。
1.2.6 蟹抗氧化肽的氨基酸组成分析[13]
采用GB/T 5009.124—2003《食品中氨基酸的测定》中的方法,将纯化后的蟹抗氧化肽组分用6mol/L HCl溶液于110℃水解24h,然后将水解液蒸干,用氨基酸自动分析仪对氨基酸组成进行测定。
2 结果与分析
2.1 蟹抗氧化肽粗品的分离
2.1.1 蟹抗氧化肽粗品第一步分离纯化结果

图1 葡聚糖凝胶G-50分离抗氧化肽粗品的洗脱曲线Fig.1 Elution profile of crude antioxidant peptides from swimming crab wastes on Sephadex G-50 column
从图1可以看出,蟹抗氧化肽粗品经0.45μm微孔滤膜过滤后用葡聚糖凝胶G-50进行分离,得到组分a与组分b,含量分别为80.24%、16.33%,将其配成质量浓度为0.03g/mL的溶液,测定其还原力,发现组分a的A700nm为0.720,远大于组分b的A700nm为0.324,对组分a继续进行分离纯化。
2.1.2 蟹抗氧化肽粗品第二步分离纯化结果

图2 Sephadex G-25分离组分a的洗脱曲线Fig.2 Elution profile of fraction No.a on Sephadex G-25 column
从图2可以看出,组分a经Sephadex G-25洗脱后得到3个洗脱峰,分别标记为组分1、组分2、组分3,含量分别为 17.78%、41.44%、26.23%。
2.2 蟹抗氧化肽的相对分子质量分布
对分离纯化后得到的3个组分测定其相对分子质量分布,标准曲线如图3所示。
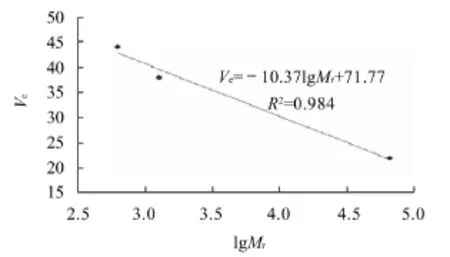
图3 葡聚糖凝胶G-25层析测定相对分子质量的标准曲线Fig.3 Standard curve of molecular weight determined by Sephadex G-25 chromatography
由图3可得,标准洗脱曲线回归方程Ve=-10.37lgMr+71.77,推测所分离抗氧化肽的相对分子质量Mr=10Ve-71.77÷(-10.37)。根据组分1的出峰体积为16.8mL、组分2的出峰体积为28.4mL、组分3的出峰体积为40.2mL,可得组分1的相对分子质量约19.95×104,组分2的相对分子质量约1.5×104,组分3的相对分子质量约1096.5。
2.3 蟹抗氧化肽的抗氧化特性

表1 蟹抗氧化肽的抗氧化特性Table1 Scavenging rates of crude antioxidant peptides from swimming crab wastes and various subfractions of their raction No.a against hydroxyl and superoxide anion free radicals
将分离所得的3个组分与蟹抗氧化肽粗品配制成质量浓度为0.02g/mL的溶液,分别测定其还原力、羟自由基清除能力、超氧自由基清除能力,结果如表1所示。
从表1可以看出,组分3的A700nm值最大,即它的还原力最强,另两个组分的抗氧化能力均比蟹抗氧化肽粗品低;3个组分的羟自由基清除率均比蟹抗氧化肽粗品高,组分1羟自由基清除率比组分3略高,组分2羟自由基清除率最低;3个组分的超氧自由基清除率均比蟹抗氧化肽粗品高,组分3超氧自由基清除率最高。结合上述抗氧化性测定结果可知,组分3的抗氧化性较强,因此确定组分3为分离纯化的最终产物,并对组分3的纯度及氨基酸组成进行测定。
2.4 蟹抗氧化肽纯度鉴定

图4 组分3的HPLC分离图Fig.4 HPLC separation profile of subfraction No.3
从图4可以看出,在保留时间为7.86min处,得到1个峰面积比为85.87%的洗脱峰,这说明组分3已基本得到纯化。
2.5 蟹抗氧化肽的氨基酸组成
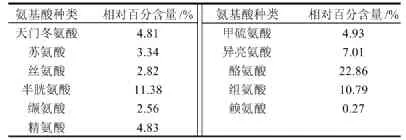
表2 组分3的氨基酸组成Table2 Amino acid compositions of subfraction No.3
从表2可以看出,蟹抗氧化肽组分3由11种氨基酸组成,具有抗氧化能力的酪氨酸、半胱氨酸和组氨酸[14-15],占总量将近一半,含量分别为22.86%、11.38%、10.79%。
3 结 论
3.1 酶解蟹下脚料获得的抗氧化肽经葡聚糖凝胶G-50
与葡聚糖凝胶G-25分离纯化得到3个组分,组分3的抗氧化性较强,相对分子质量约为1096.5。
3.2 经HPLC分析组分3已基本达到纯化;氨基酸分析表明其由11种氨基酸组成,其中具有抗氧化能力的酪氨酸、半胱氨酸和组氨酸所占比例很高。
[1] 裴小平, 唐道绑, 肖更生, 等.抗氧化肽制备的应用现状及趋势[J].食品工业科技, 2009, 30(2): 319-322.
[2] BINSAN W, BENJAKUL S, VISESSANGUAN W, et al.Antioxidative activity of Mungoong, an extract paste, from the cephalothorax of white shrimp (Litopenaeus vannamei)[J].Food Chemistry, 2008, 106(1):185-193.
[3] QIAN Zhongji, JUNG W K, KIM S K, et al.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeianaShaw[J].Bioresource Technology,2008, 99(6): 1690-1698.
[4] 范建凤, 王泽南, 杨柯, 等.梭子蟹下脚料酶解制备抗氧化肽的工艺研究[J].食品科学, 2009, 30(24): 122-125.
[5] 张强.玉米抗氧化肽的分离制备及其体外抗氧化活性研究[D].沈阳:沈阳农业大学, 2005.
[6] 朱艳华.玉米多肽的制备、理化性质及生物活性的研究[D].武汉:华中农业大学, 2007.
[7] 陆健.蛋白质纯化技术及应用[M].北京: 化学工业出版社, 2005, 99(1): 51.
[8] VILIAK K, SOOTTAWAT B, DUANGPORN K, et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry, 2007, 102(4): 1317-1327.
[9] WU Huichun, CHEN Huaming, SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J].Food Research International, 2003,36(9/10): 949-957.
[10] THIANSILAKUL Y, BENJAKUL S, SHAHIDI F.Comositions, functional properties and antioxida-tive activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J].Food Chemistry,2007, 103(4): 1385-1394.
[11] 王丰, 梅子青, 周秋丽, 等.鹿茸多肽的分离纯化及药理活性[J].吉林大学学报: 理学版, 2003, 41(1): 111-114.
[12] WANG Haiping, DASS C.Characterization of bioactive peptides in bovine adrenal medulla by a combination of fast HPLC and ESI-MS[J].Peptides, 2002, 23(12): 2143-2150.
[13] 郭霭光.生物化学实验技术[M].北京: 高等教育出版社, 2007: 165-166.
[14] CHEN Huamin, YAMAUCHI F, FUJIMOKO K, et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].J Agric Food Chem,1998, 46(1): 49-53.
[15] 王嘉榕, 滕达, 田子罡, 等.功能性抗氧化肽制备与机制研究进展[J].天然产物研究与开发, 2008, 20(2): 371-375.

