糖尿病的抗血小板治疗:当前治疗策略的效果和局限及未来方向
安吉奥利洛
(甘肃省人民医院内分泌糖尿病科 刘静 翻译 徐赫男 编辑)
引言
心血管疾病在糖尿病患者中的发病率和死亡率居首位。多个典型的心血管病危险因素同时存在,会提高糖尿病患者动脉粥样硬化的危险。但是,其他风险因素也可能很重要,如血小板功能异常。事实上,血小板在动脉粥样硬化及其血栓性并发症中发挥关键作用,而抗血小板治疗可以通过阻断调节血小板活化和聚集过程的一个或多个途径,因此是减少糖尿病患者缺血性风险的关键。本文综述了发生缺血事件的糖尿病患者目前的抗血小板药物、目前使用的治疗策略的局限性,以及目前正在临床开发的有克服这些限制潜力的抗血小板药物。
抗血小板治疗
有三种不同类型的血小板抑制药:环氧合酶1(COX-1)抑制剂(阿司匹林),ADP P2Y12受体拮抗剂(thienopyridines)和血小板糖蛋白(GP)Ⅱb/Ⅲa抑制剂,主要用于预防与治疗动脉粥样硬化疾病(如图1)。阿司匹林抑制COX-1酶,从而阻止血小板血栓素A2合成。然而,在阿司匹林治疗的患者,特别是高危人群,可能再发生血栓事件。GP Ⅱb/Ⅲa抑制剂是很强有力的抗血小板药物,它通过抑制最后共同通路介导的血小板聚集过程发挥作用,并已被证明对接受经皮冠状动脉介入(PCI)治疗的高危患者预防血栓并发症有效。然而,这些药物仅适用于注射使用,作用持续时间短,阻碍其作为长期保护用药。对抗血小板用药选择需求带来了对阻断不同血小板活化途径的口服抗血小板药物联合用药的效果评价。噻氯匹定是第一代噻吩吡啶,可不可逆地阻断血小板ADP P2Y12受体。它与阿司匹林结合,同阿司匹林单一治疗或阿司匹林联合使用华法林相比,在实施冠脉支架术的患者中有一个更强的对血小板的抑制作用和较好的临床预后。然而,噻氯匹定有限的安全性和无法迅速实现抗血小板作用,导致氯吡格雷(第二代噻吩吡啶)成为ADP P2Y12受体拮抗剂的选择。
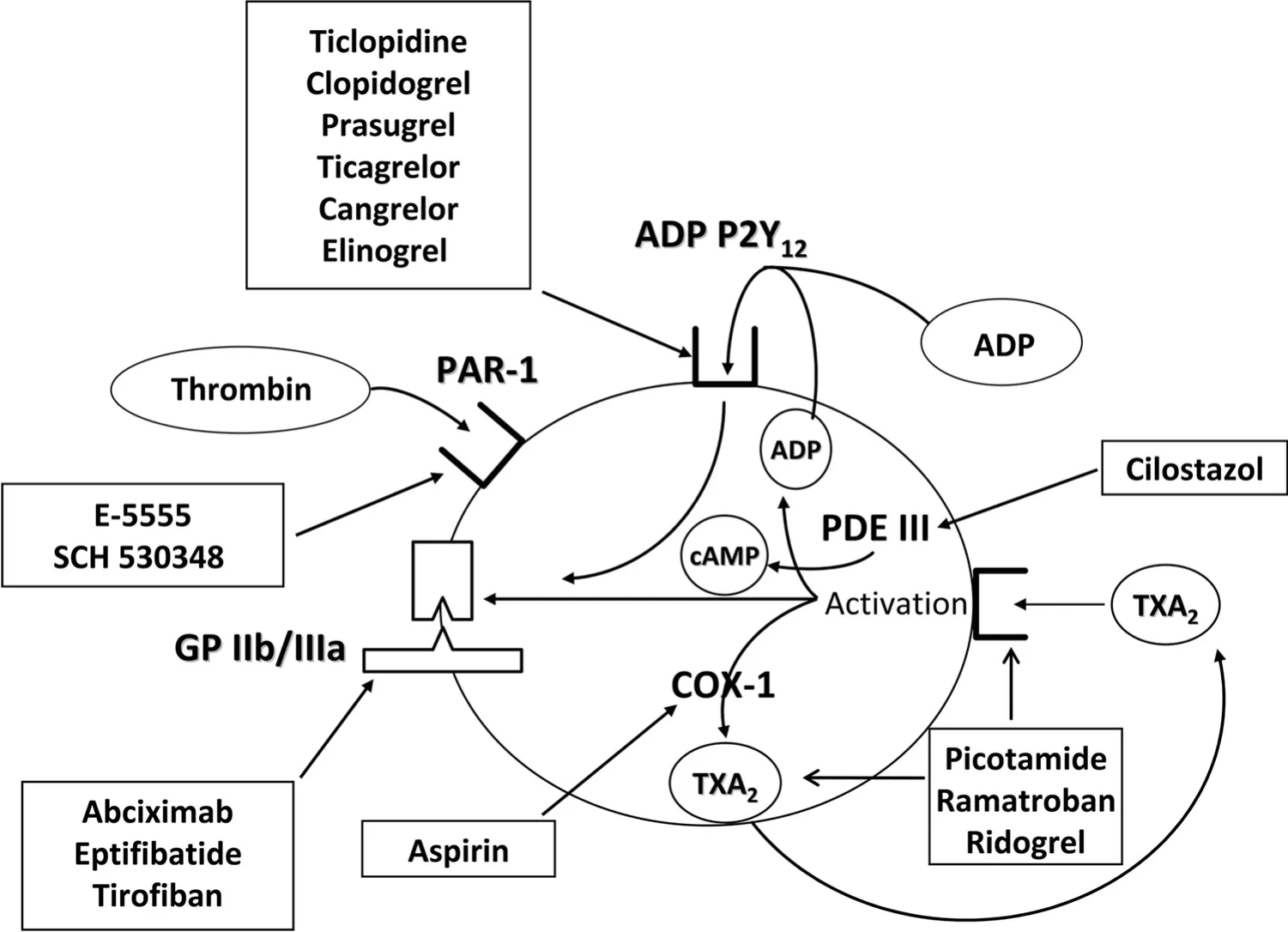
图1 抗血小板药物的作用机制
阿司匹林
阿司匹林作为选择性乙酰化的COX-1酶,阻断血小板血栓素A2的形成。这种作用是不可逆转的,因为血小板是无核的,因此,无法再合成COX-1。除了作为动脉粥样硬化疾病患者缺血事件二级预防的抗血小板药物,阿司匹林也可用于缺血事件的一级预防。事实上,虽然在普通人群中的指征存在争议,但是有一个对于阿司匹林在糖尿病患者一级预防中使用的专家共识。
阿司匹林作为糖尿病患者一级预防用药
美国糖尿病协会(ADA)建议使用低剂量阿司匹林(75-162毫克/天)作为有心血管疾病危险的1型或2型糖尿病患者的一级预防措施,这类患者包括年龄>40岁和还有其他危险因素(心血管疾病家族史、高血压、吸烟、血脂异常或蛋白尿)。然而,不应建议年龄<21岁的患者接受阿司匹林治疗,因为这可能会增加瑞氏综合征(Reye's syndrome)的发生风险。由于没有做过相关研究,阿司匹林在<30岁的糖尿病患者中的作用仍不清楚。(ADA2010年的糖尿病诊疗指南对阿司匹林的使用做了新的修订,可参见本期专家共识。——编者注)
几个临床试验评估糖尿病患者服用阿司匹林的疗效。多数研究显示了糖尿病患者服用阿司匹林的益处。然而,这些结果均基于事后分析,因为这些试验不是专为糖尿病患者设计的分析。此外,得到的结果是根据少量的样本量,这也许可以解释为什么阿司匹林并不总是显示在糖尿病患者一级预防中是有益的。
日本阿司匹林对糖尿病患者动脉粥样硬化一级预防(JPAD)试验是第一个前瞻性设计的试验,以评估在日本有心血管事件的2型糖尿病患者使用阿司匹林(81毫克或100毫克)作为一级预防的效果。这些患者有 2,539人年龄在30-85岁。平均随访4.37年后,使用阿司匹林组和非阿司匹林治疗组之间有20%的主要终点差异(分别为5.4%与6.7%),但没有达到统计学意义(P=0.16)。患者中年龄>65岁(n= 1,363)的人中,阿司匹林使主要终点危险降低了32%(6.3%与9.2%,P=0.047)。此外,对接受阿司匹林治疗的患者来说,致死性冠状动脉和脑血管事件(次要终点)的发生率显著降低了90%(0.08%与0.8%,P=0.0037),但在非致死性冠状动脉和脑血管事件上没有差异。阿司匹林耐受性良好,复合的出血性卒中和严重消化道出血没有大幅增加。这项试验的局限性,包括对阿司匹林使用开放标签和事件发生率低。因此,该研究在阿司匹林对主要终点的显著影响上显得证据不足。这项试验的结果对于在糖尿病患者一级预防中现行推荐指南对阿司匹林使用的有效性提出质疑。但是,也有其他正在进行的试验,这将为在糖尿病患者一级预防中使用阿司匹林是否适当提供进一步的见解。这些试验包括糖尿病中心血管事件研究(ASCEND)和联合使用阿司匹林和辛伐他汀预防糖尿病心血管事件试验(ACCEPT-D)。
最近,预防动脉疾病和糖尿病进展(POPADAD)试验的结果已经报告。在这次试验中,患者(n = 1,276)有1型或2型糖尿病、年龄>40 岁、踝肱压力指数≤0.99,但没有心血管疾病症状,被随机分配到阿司匹林(100毫克)组和抗氧化剂组,采用双盲、2 × 2析因设计、安慰剂对照的方式。这项试验未能显示出阿司匹林或抗氧化剂在一级预防心血管疾病的任何益处。患者总人数少和事件发生率低对该研究的结果起了一定作用。虽然这项试验中的患者无临床症状,但因为患者具有一定程度的周围动脉疾病(PAD),所以这不应该被认为是一级预防研究。
阿司匹林作为糖尿病患者二级预防用药
ADA建议所有糖尿病患者使用低剂量阿司匹林(75-162毫克/天),作为脑血管和心血管事件二级预防。这一立场是由抗血栓试验协作组(ATC)对主要的二级预防试验进行的两个大型荟萃分析结果支持的,这表明口服抗血小板药物(主要是阿司匹林)对于那些有心血管疾病高风险的患者(包括患有糖尿病)有保护作用。该荟萃分析包括287项二级预防试验,涉及212,000例有急性或既往血管疾病或其他增加血管疾病风险的状况的高危病人。阿司匹林75-325毫克/天是最常用的抗血小板药物。在主要的高风险群体(急性心肌梗死、既往有心肌梗死病史、既往有卒中或短暂性脑缺血发作、急性脑卒中以及任何其他相关的血管疾病史),抗血小板治疗减少了23%血管事件的发生率。值得注意的是,低剂量阿司匹林(75-150毫克/日)同每天服用较高剂量效果相同。此外,出血并发症在使用较低剂量时发生风险降低。在ATC研究中的超过4,500例糖尿病患者中,血管事件发生率由对照组的23.5%减少到抗血小板治疗组的19.3%(P<0.01);在大约42,000例非糖尿病患者中,血管事件发生率由对照组的17.2%降至抗血小板治疗组的13.7%(P<0.00001)。虽然糖尿病患者血管事件的总发生率明显高于非糖尿病患者,抗血小板治疗对糖尿病和非糖尿病患者的益处是一致的(每1000例糖尿病患者有42次血管事件被阻止,每1000例非糖尿病患者有35例血管事件被阻止)。
P2Y12受体拮抗剂
氯吡格雷是目前首选的噻吩吡啶类药物,因为它有一个比噻氯匹定更为有利的安全范围。在氯吡格雷vs阿司匹林对有缺血性事件高危患者的影响(CAPRIE)试验中,就氯吡格雷(75毫克/天)与阿司匹林(325毫克/天)对有近期心肌梗死、缺血性卒中或明确PAD病史患者的二级预防作用进行了大样本(n= 19,185)研究。氯吡格雷组的一级终点年发病率(血管性死亡、心肌梗死或缺血性卒中联合发病率)是5.32%,较之阿司匹林的5.83%,相对风险减少8.7%(P= 0.043),这有利于氯吡格雷。Bhatt等回顾性分析了CAPRIE中糖尿病亚组的结果,该亚组占了研究总样本量的20%。被随机分入氯吡格雷组和阿司匹林组的患者复合一级血管终点发生率分别为15.6%和17.7%(P=0.042)。每治疗1,000例糖尿病患者,这种差异可多预防21个血管事件,而在胰岛素治疗的患者中,这种差异可以多预防38个血管事件。值得注意的是,在非糖尿病患者中,氯吡格雷(11.8%)与阿司匹林(12.7%)在复合一级血管终点发生率的减少上无统计学意义。ADA目前建议使用氯吡格雷治疗极高危糖尿病患者或作为对阿司匹林不耐受的患者的一种替代疗法。
氯吡格雷预防不稳定型心绞痛复发事件(CURE)研究评估了氯吡格雷加阿司匹林与单用阿司匹林治疗不稳定型心绞痛或非ST段抬高心肌梗死(NSTEMI)患者(n = 12,562)的结果。除了接受标准的阿司匹林治疗(75-325毫克/天,最长1年),患者被随机分为接受氯吡格雷(负荷剂量300毫克、维持剂量75毫克/天)或安慰剂组。分配给双重抗血小板治疗(阿司匹林和氯吡格雷治疗)的病人在首发一级终点(血管性死亡、心肌梗死或卒中)上相比单独使用阿司匹林治疗的病人减少了20%(分别为9.3%与11.4 %,P<0.001),具有显著性。虽然双重抗血小板治疗增强了对血小板的抑制程度从而减少了缺血性事件,但这伴随了更高的严重出血发生率(3.7%与2.7%,P = 0.001)。然而,在威胁生命的出血事件发生率上没有显着差异(2.2%与1.8%,P= 0.13)。在CURE的研究中,有2,840例糖尿病患者使用阿司匹林和氯吡格雷联合治疗时较之单用阿司匹林治疗(分别为14.2%与16.7%)使首发一级终点大约减少了17%。但是,尽管阿司匹林和氯吡格雷双重抗血小板治疗对糖尿病亚组有益(在整体研究样本中也一样),但CI 0.70-1.02表明这只达到了临界统计学意义。重要的是要注意,尽管联用氯吡格雷以进行更强化的抗血小板治疗,但糖尿病亚组的事件发生率比非糖尿病亚组高的多。事实上,糖尿病亚组的主要复合心血管终点几乎比非糖尿病亚组高出一倍(分别为14.2%与7.9%)。这些发现强调了糖尿病患者有必要进行更个体化的抗血小板治疗方案,其中包括使用更强效的药物或联合其他抗血小板药物。
目前的美国心脏病学会(ACC)/美国心脏协会(AHA)不稳定型心绞痛和NSTEMI治疗指南建议,不稳定心绞痛和NSTEMI患者在阿司匹林基础上加用氯吡格雷(负荷剂量300毫克、维持剂量75毫克/天)。最近,在ST段抬高性心肌梗死(STEMI)患者中使用氯吡格雷已获美国食品和药物监督管理局(FDA)认可,并得到目前的ACC/AHA关于STEMI患者治疗指南的支持。对于急性冠脉综合征(ACS)患者,指南指出,无论采用何种治疗策略(侵入性或无创)都应该使用氯吡格雷,理想治疗是持续长达1年。需要强调的是氯吡格雷辅助治疗的依从性很重要,因为停药后死亡率和心肌梗死发生率会反跳性增加。这种现象在糖尿病患者中尤其明显,这可能是由于这些患者停用氯吡格雷后血小板反应会更加显著地增强。
与双重抗血小板治疗对ACS患者(包括那些接受PCI者)的明显益处相反,氯吡格雷用于高动脉粥样硬化风险和缺血的稳定、管理和避免(CHARISMA)试验表明,高风险但非急性患者(n=15,603)伴有心血管疾病临床证据(n=12,153)或伴多种心血管危险因素(n=3,284),阿司匹林加氯吡格雷治疗与单用阿司匹林相比,在减少心血管死亡、心肌梗死或卒中(6.8与7.3%,P值= 0.22)发生率上并无显著有效性。虽然在一个对既往有心肌梗死、缺血性卒中或有症状的PAD(“CAPRIE样”人群)的较高风险组(n = 9,478)进行的亚组分析显示双重抗血小板治疗使相对危险下降17%(P =0.01),但是 在一个较低风险组中发现了相反的结果,这些患者基于存在会增加死亡率的多种心血管危险因素而被纳入该研究。重要的是,被纳入后一项亚组分析的患者有很多人患有糖尿病,因为糖尿病诊断被作为了一个重要的纳入标准。因此,阿司匹林和氯吡格雷的双重抗血小板治疗不应提倡用作糖尿病个体的一级预防。
GP Ⅱb/Ⅲa受体拮抗剂
很多研究已经比较了各种GP Ⅱb/Ⅲa阻滞剂。目前,三种不同的GP Ⅱb/Ⅲa抑制剂(阿昔单抗、依替巴肽和替罗非班)已被批准用于临床。在6项对ACS患者的静脉内GP Ⅱb/Ⅲa抑制剂的荟萃分析试验中,22%的人患有糖尿病(n=6,458),GP Ⅱb/Ⅲa抑制剂使糖尿病患者的30天死亡率从6.2%大幅减少到4.6%(P=0.007)。在这些试验中的超过22,000例非糖尿病患者中,GP Ⅱb/Ⅲa抑制剂并未改善存活率。GP Ⅱb/Ⅲa抑制剂对1,279 例接受经皮冠状动脉介入治疗的糖尿病个体住院期间表现出来的作用甚至更大。在这些个体中,GP Ⅱb/Ⅲa抑制剂使30天死亡率从4%减少至1.2%(P =0.002)。值得注意的是,这些试验是在一个有限度使用氯吡格雷时期进行的,这挑战了糖尿病患者对GP Ⅱb/Ⅲa受体拮抗剂的需求。事实上,冠状动脉内支架置入术和抗血栓形成药物:阿昔单抗是糖尿病患者消除已提高的血栓形成风险的很好方法吗?(ISAR-SWEET)试验显示,对于术前至少2小时接受600毫克负荷剂量氯吡格雷预处理后进行PCI的糖尿病患者(n= 701),阿昔单抗对1年死亡和心肌梗死发生风险没有任何影响。但是,冠状动脉内支架置入术和抗血栓形成药物:冠心病治疗的早期快速行动2(ISARREACT 2)试验清楚地表明,对使用氯吡格雷600毫克预处理后行PCI的NSTEMI ACS患者(针对肌钙蛋白水平升高者而不针对有心电图改变者),阿昔单抗可以安全地减少不良事件的发生风险。所有亚组都被观察到了益处,其中包括糖尿病患者。总体而言,与现行指南相一致,这些结果继续支持GP Ⅱb/Ⅲa受体拮抗剂用于ACS患者,尤其是糖尿病患者。
出血率增加成为GP Ⅱb/Ⅲa药物的主要限制因素。有越来越多的证据表明,出血对预后有重要影响,包括长期死亡率。与GP Ⅱb/Ⅲa抑制剂相比,比伐卢定(直接凝血酶抑制剂)已经表现出可对ACS患者缺血事件提供类似的保护,而且严重出血更少,其结果就是带来净不良临床预后(net adverse clinical outcomes)显著减少。这些发现在最近的一项对ACUITY试 验(Acute Catheterization and Urgent Intervention Triage Strategy)中的糖尿病个体(n=3,852)进行的亚组分析中得到了证实。特别是,与GP Ⅱb/Ⅲa加肝素相比,比伐卢定单一疗法有类似的复合缺血发生率(分别为7.9%和8.9%,P=0.39)和更少的严重出血(分别为3.7%与7.1%,P<0.001),进而产生了更少的净不良临床预后(10.9%与13.8%,P=0.02)。
现有抗血小板药物的局限性
阿司匹林和氯吡格雷是稳定或不稳定性动脉粥样硬化心血管疾病患者(也包括糖尿病患者)缺血性事件二级预防的基石。然而,尽管使用了这些抗血小板药物,相当多的病人继续经历反复发生的动脉粥样硬化事件。这些发现已导致在最近几年中的抗血小板药物抵抗概念的发展。术语“抵抗”来自于实验室的发现,一个抗血小板药物未能充分阻断其血小板上的特定靶位。因此,如果抗血小板药物疗效并没有在患者身上进行测试,血栓形成事件就不能归咎于抵抗。对于阿司匹林,抵抗涉及对COX- 1介导的血栓素A2途径抑制的不足或缺乏,而对氯吡格雷,抵抗涉及P2Y12受体信号。抗血小板药物的抵抗,不应与治疗失败混淆,后者定义为虽经治疗仍再次发生缺血性事件。事实上,抗血小板药物抵抗会导致治疗失败,但并非所有治疗失败都能归咎于抗血小板药物抵抗。这符合动脉粥样硬化的多因素特性,即存在多种机制可能导致事件的复发。
阿司匹林抵抗
很多研究发现阿司匹林抵抗与长期不良临床预后有关,不仅是在冠状动脉疾病患者中,而且在缺血性卒中或周围动脉疾病患者中。阿司匹林抵抗的发病率在不同文献中的差别很大(在一些研究报告有0%的患者而另一些研究中则>50%),不同的结果可以归因于对抵抗的定义、使用不同的化验类型、阿司匹林的剂量以及研究患者的人数。许多研究所使用的化验方法并非COX–1特异性的(例如,PFT- 100还使用除花生四烯酸外的激动剂进行透光集合度测定),以及所取得的结果可能是反映多种血小板信号途径的。这些测试通常导致阿司匹林抵抗较高的发病率,尤其是糖尿病患者。然而,有越来越多的证据显示,当采用专门评估COX-1活性的检验时,阿司匹林抵抗非常少见(<5%的患者)。虽然不同的化验测试阿司匹林敏感性的相关性(对COX-1特异性和非特异性抑制)仍然需要更好的定义,采用各种实验室化验方法的荟萃分析支持阿司匹林效力不足对预后不良的影响。但是,没有发表过专为评估糖尿病患者阿司匹林抵抗的生化影响的研究。
在使用COX-1 特异性化验时,阿司匹林抵抗最主要的原因是病人依从性差。药物的相互作用,如布洛芬(可干扰阿司匹林所诱导的COX-1乙酰化),也可能是造成阿司匹林效力不足或缺乏的原因。后者还对尽管使用阿司匹林缺血事件发生风险仍然增加负有责任。此外,阿司匹林效力不足的总体发病率可能会受调查患者人数的影响。糖尿病患者的突出特点是血小板高反应性。虽然当采用COX-1特异性评估方法进行评估时阿司匹林可能会导致COX-1的完全抑制,但由于其他信号途径的上调,这些患者的高残余血小板反应性(high residual platelet reactivity)仍然存在。当使用非COX-1特异的分析方法时,这变得更为明显,糖尿病患者使用这些测试更可能出现抵抗。
只有有限的一些研究调查了糖尿病患者固有的阿司匹林抵抗的潜在机制。糖尿病患者的特点是血小板反应性增加,血栓凝结因子(prothrombotic clotting factors)的水平和活性增加,这也许可以解释他们的倾向——易产生阿司匹林效力不足。高血糖可能会被认为是阿司匹林效力不足的糖尿病特异性机制。事实上,糖基化和乙酰化之间的相互作用已被多次证明。此外,血小板和凝血因子蛋白糖基化的增加可能会干扰乙酰化过程,从而引起阿司匹林对糖尿病患者的抗血小板作用不足。但是,我们仍然未能确定改善血糖控制是否能提高阿司匹林的功效,或增加阿司匹林剂量在血糖控制差的患者中是否是有益的。
氯吡格雷抵抗
氯吡格雷是一种特异性的不可逆的血小板P2Y12ADP受体拮抗剂,因此,与阿司匹林相比,氯吡格雷用一个完全不同的方式抑制血小板的活化。与阿司匹林相同的是,文献报道的氯吡格雷抵抗的发病率差异也很大,这种差异与所使用的定义、化验的类型、氯吡格雷的使用剂量和患者总数等因素有关。尽管如此,血小板对氯吡格雷反应的个体差异是一个已广为接受的概念。基因、细胞和临床的原因都能带来氯吡格雷反应性的不足。糖尿病的存在可能会通过各种机制对氯吡格雷效力不足的产生起作用(见表1)。较之非糖尿病患者,氯吡格雷无反应(Clopidogrel nonresponsiveness)在糖尿病患者中更为普遍,在需要胰岛素治疗者中的发生率最高(图2)。这些发现也许可以解释为什么糖尿病患者,尤其是在他们的疾病的最终阶段(如需要胰岛素治疗的糖尿病),会持续反复发生动脉粥样硬化性事件,其中包括支架内血栓形成。专门在接受阿司匹林和氯吡格雷治疗的2型糖尿病患者中进行的血小板功能分析显示,尽管与非糖尿病患者相比这些患者的血小板反应性程度更高,但仍然有一个明显的反应范围。重要的是,在这个完全由糖尿病患者组成的队列中,血小板活性高的患者发生长期不良事件的风险超出3倍(图3)。这些患者的特点是其血小板处于整体功能失调状态,因为在使用激动剂测试多个信号通路时血小板表现出高反应性。

表1 氯吡格雷反应差异的机制
许多机制对氯吡格雷对糖尿病患者(特别是2型糖尿病患者)效力不足负有责任。人体血小板是胰岛素的靶细胞,其与位于血小板表面的受体
相互作用,导致G1活性丧失。这导致cAMP的抑制,P2Y12信号的抑制和血小板反应性的降低。然而,2型糖尿病患者的血小板也受到这类患者特征性的胰岛素抵抗(会导致胰岛素敏感性降低)的影响。结果导致P2Y12通路上调和血小板反应性增加。与糖尿病患者氯吡格雷无反应相关的其他机制包括ADP暴露增加、胞浆钙水平增加、血小板更新率增加。
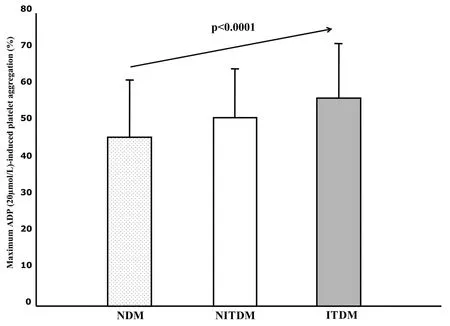
图2 在非糖尿病患者(NDM)(n=65)、非胰岛素治疗的糖尿病患者(NITDM)(n=133)、胰岛素治疗糖尿病患者(ITDM)(n=68)中ADP(20μmol/ L)刺激后的血小板聚集情况。
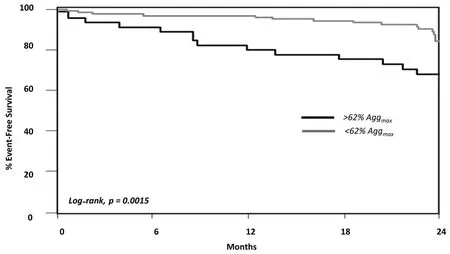
图3 伴有或不伴有高血小板反应性糖尿病患者(n=173)累积无心血管事件率。
未来方向
当前现有的用于预防动脉粥样硬化事件的抗血小板药物存在局限性,这些局限性在糖尿病患者间表现得更大,这就需要更特异的抗血小板治疗方法,特别是用于糖尿病患者。已提出三种策略来实现这一目标,其中包括调整剂量、加用其他抗血小板药物以及使用更新的药物。
抗血小板药物剂量的调整
增加现有的抗血小板药物剂量的基础理论是,这种策略可能会潜在地增加药物的生物利用度,因此,增强对血小板的抑制。在临床实践中广泛使用不同剂量的阿司匹林(75-325毫克/每日)。虽然没有随机研究评估哪些剂量最有效,ATC清楚地表明,高剂量阿司匹林并不与好的临床结果有关。相反,阿司匹林剂量与更高的不良反应发生风险相关,主要是胃肠道出血。尽管研究显示,阿司匹林剂量可能对它的独立于COX-1的作用有影响,其意义仍未知,这一剂量并不影响COX-1的阻滞程度,只需低剂量阿司匹林就能完全抑制COX-1。鉴于糖尿病患者的血小板有更新率增加的特点,有人主张每天多次用药而不是增加每日一次的药量可能会对这些病人更加有益。事实上,阿司匹林有一个非常短的半衰期,因此不能达到对新生成血小板的阻滞。不过,阿司匹林每日一次与每日多次用药在功能及临床上的影响仍未知。
几项研究关注于如何通过增加剂量克服氯吡格雷无反应。优化糖尿病抗血小板治疗(OPTIMUS)研究选择性检查了高血小板反应性的2型糖尿病患者长期服用氯吡格雷的情况。使用150毫克氯吡格雷的维持量对血小板抑制作用大于使用75毫克剂量导致的血小板抑制。最近的研究结果表明,对糖尿病患者使用高剂量的氯吡格雷达到加强P2Y12抑制的同时,也可实现降低凝血酶生成。然而,在这项研究中,尽管采用这种方法,相当多的患者仍高于后处理血小板反应性的治疗阈值。尽管缺乏大规模的临床试验数据来充分评估高剂量氯吡格雷的安全性和疗效,PCI指南对高氯吡格雷负荷剂量(600毫克)提供了一个I类建议(证据水平C)。150毫克的维持剂量提供了C级证据Ⅱb级推荐。正在进行的氯吡格雷最佳负荷剂量使用以减少反复发生的EveNTs/最优抗血小板干预(CURRENT/OASIS7)试验将评估是否高的氯吡格雷负荷量和维持量可以比接受PCI的ACS患者使用的标准剂量有较好的临床结果。此外,所有病人将随机接受服用低(75-100毫克)或高(300-325毫克)剂量的阿司匹林。
使用辅助抗血小板药物
在以上治疗上使用辅助抗血小板治疗,目前用于二级预防缺血事件可能是实现增强对糖尿病患者血小板抑制的方法。然而,实现这一目标的选择有限。GP Ⅱb/Ⅲa抑制剂的使用仅限于治疗急性期。这些药物已被证明对接受PCI的ACS患者是特别有益的,特别是糖尿病患者。然而,在当今大剂量使用氯吡格雷的时代,GPⅡb/Ⅲa抑制剂没有显示出任何在非ACS背景中使用的临床益处,包括糖尿病患者。但是,最近有迹象显示,GP Ⅱb/Ⅲa抑制剂可能有利于非 ACS环境接受非急诊PCI与阿司匹林或氯吡格雷抵抗的患者。然而,一个使用替罗非班调节治疗有抗阿司匹林和/或抗氯吡格雷患者的亚组分析(3T/2R)的研究未能显示出这一方法在糖尿病患者中的任何显著差异。提高糖尿病患者血小板抑制的另一种方法是加用西洛他唑(一种磷酸二酯酶Ⅲ抑制剂)(图1)。一些研究显示了阿司匹林、氯吡格雷、西洛他唑三联抗血小板治疗的好处,特别是裸金属支架以及药物洗脱支架治疗的糖尿病患者。OPTIMNS-2的研究显示,这些发现可能是联用西洛他唑使糖尿病患者取得更大程度的血小板抑制所致。这项研究表明,西洛他唑可增加血小板内cAMP水平,提高血管扩张刺激磷蛋白(VASP)的磷酸化作用,从而增加P2Y12的抑制作用。然而,西洛他唑治疗的主要缺点是它的副作用高发生率(如偏头痛、心悸、肠胃不适),常常导致停药。
利用新的药物
假设未来的抗血小板药物疗法能够根据个体化需要来使用,能够有效和安全地抑制血小板活化和聚集过程的新型抗血小板药物的开发似乎是一个最有前途的策略。这意味着药物可以针对特定患者人群(如糖尿病)的异常通路来使用。因此,有人建议吡考他胺作为阿司匹林的一种替代治疗。事实上,吡考他胺既抑制血栓素A2合酶又抑制血栓素A2受体,因此,能够阻止通过环氧合酶1逃避机制(escape mechanism)产生的血栓素A2的效应,而这是导致糖尿病患者阿司匹林效力不足的一条路径(图1)。在糖尿病患者动脉粥样硬化血管疾病的药物评价(DAVID)研究中,1,209名40-75岁患有2型糖尿病和PAD的成年人随机接受吡考他胺(600毫克 2次/日)或阿司匹林(320毫克 1次/日)为期24个月。服用吡考他胺的患者在2年累计总死亡率(3.0%)明显低于那些服用阿司匹林的患者(5.5%),吡考他胺与阿司匹林的相对风险比为0.55(95%CI 0.31-0.98)。然而,尽管死亡率和发病率的复合终点在吡考他胺组的发生率略低,但这种差异没有达到统计学意义。其他血栓素抑制剂,如雷马曲班,ridogrel和S18886,目前还处于临床研究中,它们可能是未来治疗的选择(图1)。
有几个P2Y12受体拮抗剂处于后期临床研究。这些药物包括普拉格雷,ticagrelor(AZD6140),坎格雷诺和 elinogrel(PRT128)(图 1)。普拉格雷和ticagrelor是口服的,cangrelor是静脉使用的,elinogrel可以通过两个途径进行给药。普拉格雷是一个不可逆转的药物,而ticagrelor,cangrelor和elinogrel是可逆的。所有这些药物效力更强,较之氯吡格雷,反应变化性更小。这些药物的药效学和药动学概况及临床前和早期临床数据超出了本文的范围,其他地方有详细的描述。普拉格雷来自大规模Ⅲ期临床试验的数据鼓励人心。普拉格雷是第三代噻吩吡啶,像氯吡格雷,选择性和不可逆地阻滞ADP P2Y12受体。然而,普拉格雷有一个更有利的药动学特征,与氯吡格雷相比,它能更有效地转变成其活性代谢产物,众多的药效学研究表明,与大剂量和维持量氯吡格雷相比,普拉格雷对血小板的抑制作用更快、更有效且可预见。这些更有利的药理学特性的临床意义在心肌梗死用普拉格雷—溶栓治疗以评估通过优化抑制血小板治疗效果的改进(TRITON-TIMI 38)试验中进行了评价,比较氯吡格雷与普拉格雷对接受PCI的中度到高度风险的ACS患者(n=13,608)的作用。经过平均14.5个月时间,主要终点(心血管死亡、非致死性心肌梗死或非致死性卒中)在两组患者的发生率为氯吡格雷组12.1%与普拉格雷组9.9%(HR 0.81;P<0.001)。然而,普拉格雷组观察到严重出血风险的增加,普拉格雷组为2.4%而氯吡格雷组为1.8%(HR 1.32;P=0.03)。尽管出血风险增加,预先确定的净临床效益分析(包括疗效和出血终点)仍然青睐普拉格雷,分别为(普拉格雷组12.2%,氯吡格雷组13.9%,HR 0.87,P=0.004)。值得注意的是,从普拉格雷治疗中收益最多的患者大多是糖尿病患者。3,146名受试者先前存在糖尿病,其中776人在接受胰岛素治疗。与非糖尿病患者相比,普拉格雷使糖尿病患者的主要终点显著减少(分别为12.2%与17.0%,HR 0.70,P<0.001)。在胰岛素治疗的糖尿病患者中(14.3%与22.2%; HR 0.63,P=0.009)和非胰岛素治疗的糖尿病患者中(11.5% 与 15.3%; HR 0.74,P=0.009)都观察到普拉格雷的益处(图4)。在糖尿病患者中普拉格雷使心肌梗死减少了40%(8.2%与13.2%;HR 0.60,P<0.001)。糖尿病患者接受氯吡格雷或普拉格雷治疗的TIMI严重出血率类似(2.6%与2.5%,HR 1.06,P = 0.81)。相比非糖尿病患者(11.5%与12.3%; HR 0.92,P=0.16),普拉格雷的净临床益处在糖尿病患者中更大(14.6%与19.2%;HR 0.74,P<0.001)。OPTIMUS-3试验目前正在评估普拉格雷和氯吡格雷的药效学差异,特别是对2型糖尿病患者而言,普拉格雷(负荷剂量60毫克和维持剂量10毫克)和氯吡格雷(负荷剂量600毫克和维持剂量150毫克)。这项研究将对氯吡格雷在TRITON-TIMI 38研究中取得的临床益处(特别是在糖尿病患者中)的机制给出解释。
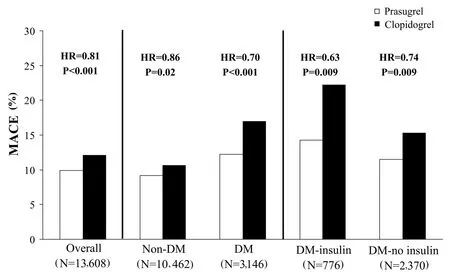
图4
最后,抑制除了COX-1和P2Y12以外的其他靶点的抗血小板药物目前正在临床开发中。这些药物可以克服糖尿病患者中导致血小板反应性增强的多种刺激。凝血酶是最有效的血小板刺激物,糖尿病患者凝血酶生成是显著的。几个可阻断蛋白酶激活受体(PAR)-1亚型的凝血酶受体拮抗剂(E5555,SCH 530348)目前已进入临床研究(图1)。重要的是要强调,血栓形成过程不是只有血小板参与也有血浆因素的参与。因此,更好地理解在高危患者中,包括糖尿病患者,这些血浆成分是如何促成严重后果的,这是确定个体化治疗策略的关键。事实上,大量的人员专门针对血栓形成过程中涉及的不同血浆组分进行研究,将为这一领域的进一步发展发挥作用。
结论
糖尿病患者动脉粥样硬化发生危险的增加部分归因于血小板功能障碍,这是这类患者的特点。特别是,糖尿病患者血小板反应性增加使得我们有必要使用血小板抑制治疗,以减少缺血的风险。虽然目前认可的抗血小板治疗策略在改善预后方面被证明有用,糖尿病患者仍然比非糖尿病患者有更高的不良心血管事件发生风险。研究提示,抗血小板药物效力降低(包括对目前常用口服抗血小板药物的抵抗)在其中起一定作用。这些发现强调了糖尿病患者需要个体化的抗血小板治疗方案。目前正在临床开发的更强效的新型抗血小板药物将有助于实现这些治疗目标。

