观察植物木质部的3种切片方法比较
朱登峰 ,唐冬英 ,李明芳 ,刘选明
(1.海南大学农学院,海南 儋州 571737;2.湖南大学生命科学与技术研究院,湖南 长沙410082;3.中国热带农业科学院生物技术研究所,海南 海口 571101)
冷冻切片法、石蜡切片法和徒手切片法是实验过程中常用的3种制作切片方法。冷冻切片主要应用于临床医学病理诊断[1],适于开展细胞免疫化学和原位杂交等研究。这是因为它不需要将样品经过长时间的脱水包埋,能更好地保证抗原分子的稳定性[2]。徒手切片法是直接利用手拿刀片将植物新鲜材料切成薄片,制成切片的一种方法。徒手切片简便易行、不需要专门的技术和仪器设备,且在切片过程中不需要特殊的化学试剂处理(如脱水剂及包埋剂),因此在植物材料中广泛应用[3]。而石蜡切片法是用石蜡作为包埋剂的一种显微制片方法,为显微制片技术中最常用的方法之一。如石蜡永久制片、石蜡切片。为了更清楚有效地观察植物木质部结构,本文采用了一种快速冷冻切片法,并与石蜡切片技术及徒手切片法进行比较,旨在探索出一种相对较好的细胞学切片方法。
1 材料与方法
1.1 材料与试剂
甘蓝型油菜(Brassica napusL.)N529及拟南芥(Arabidopsis thalianaL.)哥伦比亚生态型col-4为材料,OCT包埋剂,石蜡,二甲苯,FAA固定剂,36%甲醛,冰醋酸,乙醇,蒸馏水,1%的间苯三酚(95%乙醇配制)和25%的盐酸等。
1.2 实验方法
1.2.1 快速冷冻切片法 快速冷冻切片方法如下:取材→置于样品托头上→OCT包埋剂包埋→-30℃快速冷冻固定→切片→贴片→染色观察。首先启动Leica CM 1800冷冻切片机降温开关,把机箱温度降低至-25~-30℃,待温度稳定时,剪取油菜及拟南芥茎(长约0.1~0.3 cm)置于样品托头上,然后直接用OCT包埋剂进行包埋,涂抹均匀,使样品深埋其中,再置于速冻架上,迅速冷冻并固定在样品托头上。包埋剂OCT变白后,把样品托头移至切片机的机头上,拧紧机头螺丝,摇动旋转杠杆进行修块切片。设置切片厚度(25~100 μm),进行切片,在切片上加1~2滴1%间苯三酚和25%盐酸染色30 min;Nikon倒置显微镜下观察、拍照。
1.2.2 徒手切片法 徒手切片法如下:取材→徒手切片→湿毛笔将薄片放人盛水培养皿中→挑选透明的薄片→载玻片上染色观察。
1.2.3 石蜡切片法 石蜡切片法如下[4]:取材→FAA固定液固定24 h→脱水(依次50%、60%、70%、80%、90%、100%、100%乙醇每级1~2 h)→透明(1/2二甲苯+1/2乙醇、纯二甲苯、纯二甲苯每级2 h)→透蜡(2/3二甲苯+1/3石蜡4~8 h或过夜→1/3二甲苯+2/3石蜡2 h、纯石蜡2 h、纯石蜡2 h)→包埋→切片、贴片→展片→染色观察。
2 结果与分析
2.1 3种切片的植物茎组织观察
木质素是一种复杂的酚类聚合物,包围于管胞、导管、木纤维等纤维束细胞及厚壁细胞外,并使这些细胞具有特定显色反应:加间苯三酚溶液数滴,待片刻,再加盐酸数滴,即显红色;在倒置显微镜下观察3种切片结构,实验过程中可以发现,快速冷冻切片在处理硬度较大的材料时,组织细胞间易破裂(图1 A),而在处理油菜顶端茎组织和拟南芥嫩茎切片时,可得到较完整且清晰的切片(图1 B、C);石蜡切片和徒手切片结构都很完整(图1 D、E、F)。木质素组织化学染色分析结果显示石蜡切片经过各级脱水处理后,染色对比度不好,木质素染色颜色不深,为淡红色。徒手切片容易产生视野较暗的切片(图1 F),主要可能是切片透明度不够,厚薄不均匀产生。
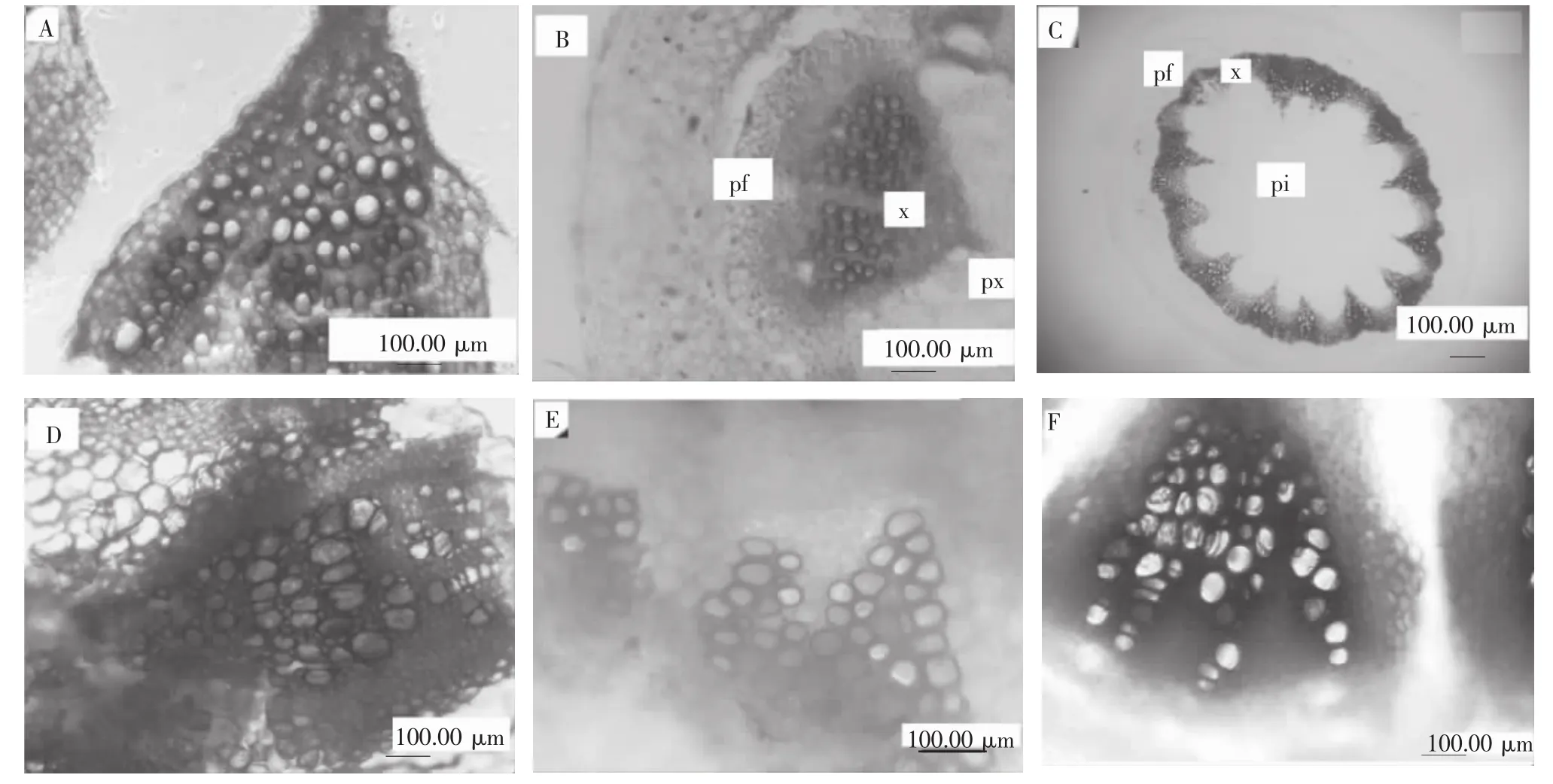
图1 油菜和拟南芥主茎横切面间苯三酚-HCl组织化学染色图(100×)
2.2 3种切片方法的比较
3种细胞学切片方法的比较如表1所示,从表中可以看出,3种方法各有优点和缺点。徒手切片法方法简单,操作简便,但切片质量不高,对材料有要求;石蜡切片法切片质量好,但操作繁杂,成本较高;快速冷冻切片法比较简便、有效、易操作,能切出较高质量的切片。
3 讨论
在植物学及细胞生物学实验上,切片制作的质量非常重要,直接影响到教学和实验的进展。通过应用上述3种切片方法鉴定生物组织中的有机物质,实验结果显示:3种方法都可以获得细胞形态完整、组织结构清晰、对比度较好的切片。徒手切片技术在植物学实验中应用较早、且比较普遍。它可以观察新鲜材料组织和细胞的天然色彩,直接观察活体细胞结构状态。通常不经染色或经简单染色后,制成临时的水装片,亦可以通过脱水与染色制成永久制片。徒手切片易产生视野较暗的切片,结合石蜡切片的透明剂,观察效果可能会更好。石蜡切片法为制片技术的经典方法,是植物学、病理学和医学等学科观察及判断细胞组织的形态结构变化的主要方法,也广泛地用于生物教学实验和其他许多学科领域的研究中。石蜡切片也与其他新技术相结合,如张舍郁[5]将免疫荧光检测技术与石蜡切片相结合,用于抗原定位。它还用于细胞原位核酸分子杂交技术中[6-7],可对材料中被杂交的DNA分子进行定位、定量分析或观察分析基因表达(mRNA)水平。快速冷冻切片多应用在细胞免疫化学和原位杂交等研究中,主要在于它能很好地保存细胞内生物分子的活性,因此在动物和人体的组织研究中得以广泛应用。由于植物细胞有细胞壁和大液泡,含水量大,在低温冷冻过程中容易形成冰晶,硬度变大,材料硬度太大是造成组织切片破碎的主要原因[8],难以切出结构完整的组织切片;而且细胞内产生的冰晶会损伤细胞的内膜系统,影响其在植物细胞学、细胞免疫化学等研究中的应用。细胞严重伤害主要发生在速冻的降温及解冻的过程中[9],因此普遍采用冷冻保护剂的方法来解决上述植物冷冻切片中存在的问题。陈丹[2]等用蔗糖保护-液氮速冻法及林月惠[10]用甘油作冷冻保护剂分别进行冷冻切片,从而获得薄且结构完整的切片;宁代锋[11]等人采用冷冻切片技术结合适当回温的方法也制作出了植物细胞基本结构完整的切片。冷冻切片技术已逐渐在植物组织切片中得到应用[12-15]。谢佩松[14]和刘剑锋[15]等认为通过冷冻切片法可在短时间内(1 d)获得高质量切片。在快速冷冻切片过程中切片不宜过薄过厚,切片太薄(小于10 μm)易碎、易卷曲;反之,切片太厚(大于50 μm),有皱折及折叠形成。快速冷冻切片法制作的切片,整体结构完整,导管、木纤维细胞、韧皮纤维细胞及髓部薄壁细胞结构清晰。实验证实快速冷冻切片法是一种简便有效的制作植物组织切片的方法。

表1 3种切片方法的比较
[1]Sathyanesan S N,Antonia D,Rose T,et al.A simplified method for combined immunohisto chemistry and in-situ hybridization in fresh-frozen,cryocut mouse brain sections[J].Brain Research Protocols,2002,9:214-219.
[2]陈 丹,赵 洁.适合于植物花器官的冰冻切片技术[J].武汉植物学研究,2005,23(3):285-290.
[3]李 岩,王幼群.徒手切片与植物细胞微管免疫荧光定位[J].农业生物技术学报,1997,7(4):382-385.
[4]李晓梅.大豆茎顶端分生组织石蜡切片的制备 [J].大豆科学,2008,27(4):708-710.
[5]张舍郁,程安春,汪铭书,等.间接免疫荧光检测石蜡切片中鸭肿头出血症病毒及抗原定位方法的初步建立 [J].中国农业科学,2008,41(3):868-874.
[6]程安春,廖永洪,朱德康,等.检测石蜡切片中鸭病毒性肠炎病毒间接原位PCR方法的建立[J].中国农业科学,2008,41(12):4365-4371.
[7]王春燕,黄秀燕.适合植物组织原位杂交和原位PCR的切片制作[J].安徽农学通报,2007,13(7):37-38.
[8]刘剑锋,程云清,阎秀峰.植物冰冻切片技术的改进[J].南京林业大学学报,2006,30(3):128-130.
[9]曾继吾,易干军,张秋明,等.番木瓜茎尖超低温保存过程中的细胞超微结构[J].园艺学报,2005,32(1):15-19.
[10]林月惠,李寒冰,贺新强.高度木质化材料的冰冻切片技术[J].植物学通报,2001,18(1):118-120.
[11]宁代锋,尹增芳,张 菁,等.一种简单快速植物组织冰冻切片方法[J].热带亚热带植物学报,2008,16(4):386-389.
[12]张新成,李志刚,李素丽,等.冰冻切片法在植物微管骨架研究中的应用[J].广西植物,2008,28(2):164-166.
[13]焦 石,段玉玺,孙 华,等.大豆根部冰冻切片最佳方法试验[J].湖北农业科学,2009,48(4):806-808.
[14]谢佩松,徐中根,韦存虚.冰冻切片技术在植物显微结构和组织化学中的应用[J].生物学杂志,2009,26(3):72-74.
[15]刘剑锋,阎秀峰,程云清,等.冰冻切片技术在高山红景天细胞学研究中的应用[J].东北林业大学学报,2006,34(4):110,119.

