取代酞菁光敏剂的光动力疗法研究进展*
吴丽荣 黄丽英许慧
(福建医科大学药学院 福建福州350004)
今日化学
取代酞菁光敏剂的光动力疗法研究进展*
吴丽荣 黄丽英**许慧
(福建医科大学药学院 福建福州350004)
酞菁类化合物作为新一代光敏剂用于光动力学治疗癌症,因表现出良好的光动力活性、靶组织选择性和低毒等优点而备受关注。本文对近几年取代酞菁光敏剂的光动力疗法研究进展作一简单介绍。
据世界卫生组织(WHO)国际癌症研究中心报道,每年诊断出的癌症新患者达1200万,死亡人数700万;癌症将取代心脑血管病成为威胁人类生命的头号杀手。长期以来,世界各国一直在投入巨资用于研究治疗癌症的新药。专家预测世界抗癌药物的市场年递增13%[1]。肿瘤,特别是恶性肿瘤是人类21世纪期待攻克的主要难题之一。因此,肿瘤预防药物的研究已成为目前国内外肿瘤学和药学的研究热点之一。
光动力疗法(PDT)又称光敏疗法、光化学疗法,是现代肿瘤微创或无创治疗的最新进展。PDT广泛用于治疗各种肿瘤,如鳞状细胞癌、上皮内上皮瘤和光化性角化病等[2],以及肺癌[3]、食管癌[4]和乳腺癌[5]等。
影响PDT效果的关键因素之一是光敏剂,能作为光敏剂的酞菁配合物以其高效低毒的优点成为人们研究抗肿瘤药物的焦点。目前已有几种酞菁配合物进入临床试用,如俄罗斯的Photosense(一种磺化酞菁铝光敏剂),美国的Pc4(一种轴向带有季胺基的硅酞菁),瑞典的脂质体包裹的酞菁锌[6]。我国福州大学黄金陵和陈耐生两位教授领导的课题组成功研制了新型抗癌光敏剂“福大赛因”,这是一种双取代酞菁化合物——二磺基二邻苯二甲酸亚胺甲基酞菁锌二钾盐,是中国第一个全化学合成的抗癌光敏剂。该药物已获得两项国家发明专利授权,并开始进入临床一期实验。
酞菁(图1)是具有四氮杂四苯并卟啉结构的化合物,它由4个异吲哚环组成,在酞菁分子结构中,中心的氢原子可被金属元素取代后形成金属酞菁配合物。绝大多数无取代酞菁及其金属配合物溶解性不好,不利于在体内的转运。通过在酞菁分子上引入取代基,可以改善其溶解性、稳定性,聚集倾向和吸收特性等,从而调节药物在体内的转运和穿透癌细胞的能力以及肿瘤组织对药物的摄取等。

图1 酞菁分子的结构
因此,在酞菁金属配合物上引入适当的取代基一直是人们重视的课题。取代基既可以取代周环上的氢(即周环取代),也可以加到中心金属的轴向上(即轴向配位)。根据取代基的种类、数目、位置等不同情况,本文将目前研究较多的取代酞菁金属配合物分别按以下几种类型逐一介绍。
1 对称性取代
1.1 四取代
四取代是指在酞菁外周每个苯环上同时只有一个α氢(或同时只有一个β氢)被同一种基团取代。迄今报道的四取代酞菁光敏剂的研究较多。Gao Ling-dong等[7]合成了一系列4,8,12,16-四(多氟烷氧基)金属酞菁化合物,这些化合物在大多数有机溶剂中是可溶的,在Q带670~695nm处和B带302~360nm处有最大吸收,说明适用于PDT治疗。另外他们还报道了[8]以四-(三氟乙氧基)酞菁锌(图2)与乳化剂普郎尼克F68形成的复合物作为光敏剂,用骨髓瘤细胞做PDT离体试验。光照(>610nm)24h后,细胞明显被抑制,而光敏剂为100mg/mL时细胞即死亡,表明该化合物具有明显的光动力活性。可见通过引入多氟烷氧基来增加脂溶性,可提高光敏剂在癌组织中的选择性。

图2 四-(三氟乙氧基)酞菁锌的结构
周锦兰等人[9]报道了在红光区具有良好PDT抗癌活性的新型四酰胺基取代铝酞菁光敏剂(图3),以4-硝基邻苯二甲酸为原料,用苯酐尿素法合成了四氨基铝酞菁(TAAlPc)、四乙酰胺基铝酞菁(TAcAAlPc)、四丙酰胺基铝酞菁(TPrAAlPc)和四丁酰胺基铝酞菁(TBuAAlPc)。并测定了其在输出波长532nm下的光动力抗癌活性,结果表明,剂量至40mg/kg时,抑瘤率依次为39.16%,42.81%,40.56%和51.82%。在此剂量下,四丁酰胺基铝酞菁表现出较高的光动力治疗抗癌活性。

图3 新型四酰胺基取代铝酞菁化合物的结构式
Clara Fabris和Marina Soncin等[10]研究了以1(4),8(11),15(18),22(25)-四-[3-(N,N,N-三甲胺基)苯氧基酞菁锌碘化物(RLP068)(图4)为光敏剂的在体试验。试验结果显示:这种酞菁锌衍生物具备作为PDT光敏剂的良好性质,如高光敏活性、能快速渗透且局限在表皮层。RLP068的单线态氧的量子产率比未取代的锌酞菁高1.3倍,且介导的光动力治疗不会导致皮肤功能上或形态学上不可逆的或持久的改变,副作用小,是一种很有应用前景的PDT试剂。

图4 RLP068的化学结构
黄剑东等[11]将乙酰哌嗪苯氧基引入到酞菁锌的周环,得到了α位四取代的酞菁锌和β位四取代的酞菁锌,即α(β)-四(4-(4-乙酰哌嗪)苯氧基))酞菁锌(C80H72N16O8ZnPc)(图5)。同时,制备了1-BSA,2-BSA,1-HAS,1-apoTf和1-FeTf等以非共价键结合的酞菁-蛋白质复合物。离体光动力活性测试实验结果显示复合物的活性较高,对MCF-7乳腺癌细胞具有光动力杀伤能力。说明该类型的复合物有望发展为靶向型的光敏剂,值得进一步开展研究。

图5 α(β)-四(4-(4-乙酰哌嗪)苯氧基)酞菁锌的结构
Yslas E I等[12]研究了2,9,16,23-四(甲氧基)酞菁锌作为光敏剂对人体喉癌细胞Hep-2的PDT效果。这种化合物能有效地渗透到培养的癌细胞的细胞质并局部地集中在溶酶体,诱导细胞凋亡。在光照下,ZnPc(OCH3)4对Hep-2细胞有很敏感的光动力效应,而在暗处没有细胞毒性,有望成为临床上PDT的理想光敏剂。
李晓丽等[13]先合成了两亲性β-四(对羟甲基苯氧基)酞菁锌(Ⅱ),用苏木精-伊红染色法(HE染色法)和四唑盐比色法(MTT法)研究了该化合物对Bel-7402人体肝癌细胞的抑制作用。实验结果表明,当质量浓度为50mg/L时,抑癌率达67%,其IC50=30.1mg/L。同年他们又合成了[14]α-四(对羟甲基苯氧基)酞菁锌(Ⅱ)(合成路线见图6),在光诱导条件下,采用四甲基偶氮唑蓝比色法研究了此酞菁锌配合物对Bel-7402细胞抑制作用,考察了质量浓度对配合物的抑瘤效果的影响。质量浓度为100mg/L时,抑癌率可达65.0%,IC50约为64.4mg/L。可见,这两种酞菁锌是很有潜力的抗癌光敏剂。

图6 α-四(对羟甲基苯氧基)酞菁锌(Ⅱ)的合成
除了以上介绍的几种四取代酞菁外,在表1列举了近年来研究的一些具有光动力活性的四取代酞菁。

表1 某些具有光动力活性的四取代酞菁
1.2 八取代
八取代指在酞菁外周每个苯环上两个α氢(或两个β氢)同时被同一种基团取代。Vittar N B等[25]研究了一种新型酞菁衍生物2,3,9,10,16,17,23,24-八((N,N-二甲氨基)乙硫基)锌酞菁(图7)的光动力效应,以它为光敏剂对人体乳腺癌细胞MCF-7C3和Balb/c(系)小鼠皮下植入腺癌细胞LM2作PDT实验。结果表明:该配合物具有光动力活性并主要通过诱导坏死途径杀伤癌细胞。

图7 2,3,9,10,16,17,23,24-八((N,N-二甲氨基)乙硫基)酞菁锌的结构式
Machado A H等[26]研究了以八溴酞菁锌ZnPcBr(8)为光敏剂对L929细胞的PDT效果。结果显示:ZnPcBr(8)在浓度为1μmol/L时PDT效果最显著,1h后抑癌率63%,12h后达99%,24h后达100%。试验同时证实ZnPcBr(8)介导的PDT在L929细胞中诱导线粒体依赖的细胞凋亡。
陈燕梅和黄剑东等[27]利用光谱法研究了2,3,9,10,16,17,23,24-八(3,5-二羧基苯氧基)酞菁锌(图8)与白蛋白BSA(或HSA)的相互作用,制备分离得到了该化合物与白蛋白BSA (或HAS)的组成比为1:1的复合物。在复合物中,该种酞菁锌以单体形式存在,吸收波长在685nm处,这对发挥光敏活性是很重要的。研究结果显示该复合物有可能是具有靶向功能的光敏剂。
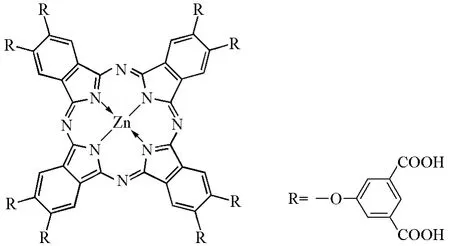
图8 2,3,9,10,16,17,23,24-八(3,5-二羧基苯氧基)酞菁锌的结构
M.J.Cook等[28]合成了1,4,8,11,15,18,22,25-八(癸基)酞菁锌(ZnODPc)和1,4,8,11,15,18,22,25-八(戊基)酞菁锌(ZnOPPc)。Lars Kaestner等[29]用这两种化合物作为PDT的光敏剂进行体外试验,二者都具有良好的光敏活性,有望用于治疗银屑病。I.G.Meerovich[30]研究了八-4,5-癸硫基-3,6-氯酞菁的光敏活性,该化合物在730nm处有最大吸收。给药5h后,用激光(波长为732nm,功率密度为100~300mW/cm2)照射20~30分钟,光敏剂对大多数动物的Erlich癌细胞生长的抑制率可达到100%。
1.3 周环全取代
周环全取代指酞菁周边苯环上的16个H原子全部被取代。如Barbara A.Bench等[31]首次合成了全卤代金属酞菁[F64PcZn(acetone)2](图9),并分析了其结构特征和理化性质。X射线构造显示:这是一种非平面的双凹形单晶体;在以锌原子为中心的酞菁环上,氟取代基团(C3F7)与酞菁环不在同一个平面,两个丙酮分子是轴向配位。该配合物的 Q带吸收是686nm,摩尔消光系数是1.73×105L·mol-1·cm-1,比之前报道的F16PcZn红移23nm。三重激发态的寿命比F16PcZn长,较少出现聚集状态,也没有发现它的光漂白作用,具有较高的稳定性。在小鼠的乳腺癌细胞EMT-6的体内试验中,该化合物在剂量2.5μmol/kg时,抑癌率达到100%,说明它是良好的光敏剂。
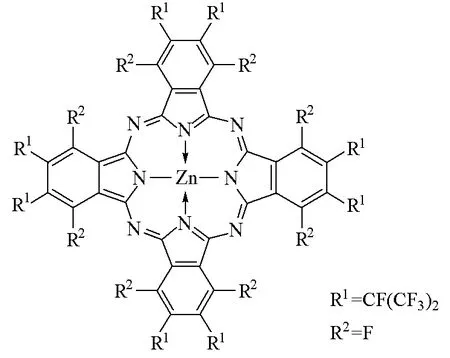
图9 F64PcZn的结构式(丙酮分子省略)
2 不对称取代
在酞菁平面大环上,由于具有不同的取代基,或者有相同的取代基但取代位置不同,或是苯环上被取代的数目不同都会引起酞菁对称性发生改变,形成不对称酞菁。不对称酞菁因其合成和分离较困难而报道和研究较少。但不对称酞菁由于其结构上的特殊性表现出许多独特的优越性能。如当在酞菁的苯环上同时引入吸电子基团和供电子基团后,其三阶非线性光学效应更为优越,产生二阶非线性光学效应等[32],因此近几年日益受重视。
Wesley M.Sharman等[33]合成了一系列3:1不对称的十二氟取代酞菁锌化合物,并以它作为光敏剂,用于PDT小鼠乳腺癌细胞EMT-6的体外实验,结果证明它比之前报道的十六氟化锌酞菁具有更高的光动力活性。Alexander A.Chernonosov等[34]研究了金属酞菁偶合寡核苷酸后修饰DNA的机制,提出金属酞菁——寡核苷酸偶合物有望成为人工调节基因表达或治疗癌症的新型光敏剂。
陈锦灿等[35]制备了一种组成结构单一、带有五聚赖氨酸靶向基团的新型两亲性酞菁光敏剂——五聚赖氨酸-2-羰基酞菁锌(图10),研究了在光照下该化合物对3种肿瘤细胞(人源肝癌细胞Bel7402、人源胃癌细胞BGC823和人源白血病细胞K562)与一种正常细胞(人源胚肺成纤维细胞HELF)的杀灭活性。结果表明:该光敏剂不仅克服了酞菁锌在水中溶解度低的问题,且因所偶联的五聚赖氨酸对肿瘤细胞有靶向作用,具有较高的杀灭肿瘤细胞活性,有望成为临床使用的新型光动力治疗恶性肿瘤的药物。酞菁类光敏剂通过用氨基酸修饰使底物具有两亲性,从而改善化合物的溶解性和靶向性。

图10 五聚赖氨酸-2-羰基酞菁锌的结构
另外,J.Y.Liu等[36]合成了3种新型的不对称锌酞菁(图11),并研究了它们的光物理性质和体外光动力活性。这些化合物作为光敏剂在对人肠腺癌细胞HT29和人肝癌细胞HepG2细胞系的PDT试验中显示了很高的光动力活性,IC50均低于0.02μmol/L。

图11 3种新型的不对称酞菁锌的结构式
3 轴向配位
酞菁分子的中心金属原子可以与一些配体形成轴向配合物,配体位于酞菁大环平面的上下两侧,分子从平面构型转变为立体构型。这种结构可增加分子间距,减弱分子的聚集倾向,增强光动力效应。
Barge J等[37]研究了一些新型的接有庞大轴取代基的硅酞菁(图12):Chol-SiPc、Chol-OSiPc、EpGl-O-SiPc、Oct-O-SiPc,将这些化合物与ClAlPc和Hex-SiPc分别进行体外试验,比较对黑色素瘤细胞的杀伤作用。结果显示了Chol-O-SiPc的活性最高(LD50约(6~8)×10-9mol/L)。Chol-O-SiPc能迅速诱导线粒体依赖的细胞凋亡,因此有望成为有效的PDT光敏剂,用来治疗一些皮肤病,如黑色素瘤或巨痣。

图12 轴向取代新型硅酞菁配合物的结构
张国才等[38]合成了一种轴向被尼泊金甲酯取代的酞菁硅(图13),即二(4-甲酯基苯氧基)酞菁硅,并通过IR,NMR,HPLC和元素分析等手段进行了表征。它在含2%聚氧乙烯醚蓖麻油(Cremophor EL),20%丙二醇的生理盐水中,以单体形式存在,Q带最大吸收位于683nm附近,荧光量子产率为0.34,荧光寿命为4.7ns。初步的离体光动力活性测试表明,该配合物对B16黑色素瘤细胞具有光动力灭活能力,半致死量LD50为1.2×10-4mol/L。

图13 二(4-甲酯基苯氧基)酞菁硅的结构
曹育红等[39]在四磺酸钛氧酞菁(TiOPcS4)的中心金属原子Ti的轴向上引入天然配体苏木精,合成轴向取代酞菁配合物苏木精-四磺酸钛氧酞菁(TiOPcS4-hematoxylin)(图14)。天然轴向配体引入到TiOPcS4,降低了分子的对称性,并使配合物的吸收长移,提高了产物的稳定性,在水溶液中不易聚集,有助于提高光动力治疗活性。该化合物有望成为治疗老年黄斑变性(AMD)的一种有效光敏剂。

图14 苏木精-四磺酸钛氧酞菁的合成
Leung SCH课题组合成了许多新型酞菁衍生物,如BAM-SiPc(bisamino silicon(Ⅳ)phthalocyanine)(图15)。后来还报道了[40]对 BAM-SiPc的光动力活性的研究。体内试验显示BAM-SiPc对裸鼠中的肝癌细胞HePG2和肠腺癌细胞HT29有显著抑制,而且没有明显的肝脏和心脏毒性等副作用。

图15 BAM-SiPc的结构
4 总结和展望
随着光动力疗法的临床运用和发展,酞菁类光敏剂的研究也越来越广泛和深入。人们通过在分子不同位置引入各种取代基或偶合生物分子等手段来改善酞菁的抗癌活性。然而这个领域还处于初步研究阶段,还有很多问题有待解决。如酞菁结构与PDT效能的关系,环取代基和轴向配体的空间位阻影响,亲水性和亲脂性应为何种比例才达到最佳靶向选择,光敏剂在体内如何转运和排泄等。这些问题的解决将对酞菁类光敏剂的合成和应用具有重要意义。相信随着医疗水平的发展和科学研究的进步,PDT将越来越成熟地被发展和应用于临床,为病人延长寿命和提高生活质量带来福音。
[1] Falconer JS.BR JCancer,2009,69:826
[2] Wang X L,Wang HW,Guo M X,et al.Photodiagnosis and Photodynamic Therapy,2008,5(2):127
[3] Kato H,Harada M,Ichinose S,et al.Photodiagnosisand Photodynamic Therapy,2004,1(1):49
[4] Moghissi K,Dixona K,Thorpe JA C,et al.European Journal of Cardio-Thoracic Surgery,2000,17(2):95
[5] 蔡君,刘剑仑.现代肿瘤医学,2006,14(10):1312
[6] 黄剑东.中国激光医学杂志,2005,14(4):264
[7] Gao L D,Qian X H,Zhang Y X,et al.Photographic Science and Photochemistry,2001,19(4):244
[8] Gao L D,Qian X H,Zhang L,et al.Photochemistry and Photobiology B:Biology,2001,65:35
[9] 周锦兰,程红,万福贤,等.中国激光医学杂志,2005,32(8):1155
[10] Fabris C,Soncin M,Mazzon E,et al.Experimental Dermatology,2005,14:675
[11] 黄剑东,刘丰冉,陈燕梅,等.无机化学学报,2006,22(3):435
[12] Yslas E I,Durantini E N,Rivarola V A.Bioorg Med Chem,2007,15(13):4651
[13] 李晓丽,陈伟,王玉,等.合成化学,2008,16(6):640
[14] 李晓丽,陈伟,李涛,等.河北师范大学学报(自然科学版),2008,32(6):803
[15] 董润安.化学试剂,2004,26(6):321
[16] 洪湖铭,薛金萍,孙纲春,等.福州大学学报(自然科学版),2005,33(3):382
[17] 叶廷秀,薛金萍,陈耐生,等.福建医科大学学报,2006,40(5):474
[18] 林萍萍,彭亦如,张宏,等.合成化学,2007,15(6):681
[19] 季春,包富荣,卢珊,等.南京师范大学学报(工程技术版),2007,7(2):90
[20] 邸凯,陈伟,李涛,等.信阳师范学院学报(自然科学版),2008,21(3):439
[21] 黄紫洋,薛金萍,陈锦灿,等.高等学校化学学报,2008,29(3):445
[22] 黄紫洋,黄剑东,陈锦灿,等.无机化学学报,2008,24(1):55
[23] 刘强,赵福群,张先付,等.北京化工大学学报,2008,35(5):24
[24] Chidawanyika W,Nyokong T.Photochemistry and Photobiology A:Chemistry,2009,202(2-3):99
[25] Vittar N B,Prucca CG,Strassert C,et al.Int JBiochem Cell Biol,2008,40(10):2192
[26] Machado A H,Braga FM,Soares C P,et al.Photomed Laser Surg,2007,25(3):220
[27] 陈燕梅,黄剑东,刘丰冉,等.光谱学与光谱分析,2006,26(8):1387
[28] Cook M J,Chambrier I,Cracknell S J,et al.Photochemistry and Photobiology,1995,62:542
[29] Kaestner L,Cesson M,Kassab K,et al.Photochem Photobiol Sci,2003,2:660
[30] Meerovich IG,Meerovich G A,Lukyanets E A,et al.Nanotech,2008,2:38
[31] Bench B A,Beveridge A,Sharman W M,et al.Angew Chem Int Ed,2002,41(5):747
[32] 陈伟,段武彪,贺春英,等.无机化学学报,2005,21(12):1880
[33] Sharman W M,Van Lier JE.Bioconjugate Chem,2005,16(5):1166
[34] Chernonosov A A,Koval V V,Knorre D G,et al.Bioinorganic Chemistry and Applications,Volume 2006,Article ID 63703
[35] 陈锦灿,陈宏炜,李永东,等.高等学校化学学报,2008,29(11):2131
[36] Liu JY,Jiang X J,Fong W P,et al.Metal-Based Drugs,Volume 2008,Article ID 284691
[37] Barge J,Decreau R,Julliard M,et al.Experimental Dermatology,2004,13:33
[38] 张国才,黄剑东,陈燕梅,等.光谱学与光谱分析,2005,25(10):1622
[39] 曹育红,彭亦如,郑思宁,等.福建医科大学学报,2006,40(4):394
[40] Leung SC H,Lo PC,Ng D K P,et al.British Journal of Pharmacology,2008,154:4
福建省自然基金项目(No.C0710025)
** 通讯联系人,E-mail:fjmuhly88@sina.com

