富血小板血浆 /人工骨修复兔桡骨骨缺损的实验研究
浦津,何耀华,刘卫华
(1.上海市闸北区市北医院骨科,上海 200443;2.上海交通大学附属第六人民医院骨科,上海 200233)
20世纪 90年代初 ,研究发现富血小板血浆(platelet rich plasma,PRP)中含有大量的生长因子,对骨的自然修复有良好的促进作用。其中以血小板源性生长因子(platelet derived growth factor,PDGF)和转移生长因子-β(transforming growth factor-β,TGF-β)最为重要。近年来的研究表明 ,PRP有较强的成骨能力[1,2]。骨科界已将其引入骨重建领域。本实验研究以兔桡骨缺损为模型,用 PRP与羟基磷灰石生物陶瓷复合进行骨缺损的修复 ,取得良好效果,报告如下。
1 资料与方法
1.1 实验动物 新西兰大白兔 12只(由新华医院动物实验中心提供),体重 2.5~ 3.1 kg,雌雄不限。采用自身对照方法,所有动物均在其双前肢桡骨中下段连同骨膜制成长 1cm的骨缺损,选择左侧前肢为实验侧,右侧前肢为对照侧。实验侧缺损区植入 PRP和羟基磷灰石生物陶瓷(由北京华意健科贸有限公司生产),对照侧缺损区单纯植入羟基磷灰石生物陶瓷。
1.2 PRP的制作 动物麻醉后,用 10 mL注射器抽取 1 mL复方枸橼酸钠抗疑剂,再从兔耳中央动脉抽取 5 mL血液,摇匀,置入离心管中 ,离心(3650r/min)10min。液体分成上清液层和红细胞层,吸取上清液及交界面以下 1~2 mm的红细胞至另一离心管,再次离心(3000 r/min)10 min。弃去上清液上 3/4,剩余液体约 0.8mL,摇匀 ,即为 PRP。取 1个2mL注射器,依次吸入 0.8mL的 PRP,0.2mL凝血剂 (由1 mL10%的氯化钙与 1000 U凝血酶混合组合而成)和 0.2 mL空气(吸入空气便于摇匀),摇匀,放置 10 s左右 ,制成PRP凝胶。整个 PRP的制作过程均需无菌操作。
1.3 手术方法 实验动物术前 12 h禁食、禁水,局部脱毛,用 2%的硫喷妥钠(30 mg/kg)兔耳静脉麻醉后,取俯卧位。于双前肢桡侧中下段作 2 cm长皮肤切口,锐性分离显露桡骨中下段,于中下段截骨 1cm(含骨膜),造成节段性桡骨骨缺损模型,生理盐水冲洗伤口,压迫止血,按计划在左侧缺损区植入 PRP和羟基磷灰石生物陶瓷,右侧缺损区植入羟基磷灰石生物陶瓷,全层缝合皮肤切口。均不行内、外固定。
1.4 术后处理 术后常规饮食,完全负重并允许自由活动,术后 3 d青霉素(40万 U/d)肌肉注射治疗。术后 2、4、8和 12周分别处死 3只兔子进行观察。
1.5 观察指标
1.5.1 血小板计数 在 12只新西兰大白兔取血制作 PRP过程中,用血红蛋白吸管分别从装有全血及 PRP的离心管中吸取样本 10μL,血小板稀释液稀释后,高倍光镜下人工计数。
1.5.2 生长因子浓度测定 采用双抗体夹心 ABC-ELISA法进行 TGF-β和 PDGF的浓度测定。
1.5.3 大体形态观察 术后 2、4、8和 12周各时间点取骨缺损修复标本作大体观察,观察骨缺损修复程度,缺损交界面骨连接情况。
1.5.4 组织学观察 术后各时间点取缺损区及两端各 0.4 cm正常骨组织,标本置于 10%中性甲醛中固定,脱钙,石蜡包埋,以缺损区为中心纵行切片,HE染色后,光镜下观察两端及中央部位新骨生成情况。同时应用 MDGS图像分析系统采集图像并分析,统计新骨在缺损区所占的面积百分比。
1.5.5 射透电镜 术后各时间点,所取标本经 2.5%戊二醛固定液固定,4.13%乙二胺四乙酸二钾脱钙,1%锇酸固定,0.5%醋酸铀染色,脱水包埋。观察新生骨细胞成熟度。
1.5.6 统计学方法 所有数据用 SPSS11.0软件处理,样本用(均数±标准差)表示。实验侧和对照侧之间的差异用样本均数 t检验,以 P<0.05为有统计学意义。
2 结 果
所有动物术后无感染和死亡,植入物无脱落,全部进入结果分析。伤口 2周愈合,无感染。兔全血中的血小板浓度为2.8× 105/mm3,PRP中血小板浓度为 9.325×105/mm3,PRP中血小板浓度为全血的 3.18倍。
2.1 生长因子浓度 兔全血的 TGF-β为(36.4±5.1)ng/mL,PDGF为 (149.5± 30.1)ng/mL;PRP中 TGF-β为(23.4± 5.8)ng/mL,PDGF为 (95.9± 12.5)ng/mL。
2.2 大体形态观察 术后第 2周,实验侧和对照侧人工骨与自体骨交界处及人工骨表面均以肉芽组织包裹连接,无明显差异 ,实验侧肉芽组织量略多,且血供较为丰富。第 4周,实验侧在人工骨表面有较多骨痂生成,人工骨与自体骨交界面不清晰;对照侧两端仅有少量骨样组织,人工骨表面有较多结缔组织,而骨样组织较少。第 8周,实验侧人工骨表面大部分被骨组织覆盖,人工骨表面的腔隙已被充填;对照侧骨组织少,骨痂限于人工骨两端,表面的腔隙可见。第 12周,两侧骨组织形成量均增加,实验侧人工骨已被骨痂完全包裹;对照侧人工骨中段仍有部分未被骨组织覆盖。
2.3 X线片观察 术后第 2周,两侧的人工骨与自体骨交界处断端整齐,间隙清晰,实验侧断端及缺损处骨密度略高于对照侧。第 4周,实验侧骨缺损两端可见均匀的高密度影,人工骨周围骨痂已形成,骨折线模糊;对照侧断端处密度欠均匀,人工骨周围未见明显骨痂。第 8周 ,实验侧可见大量骨痂包绕人工骨表面,骨折线已消失;对照侧断端骨痂较前增多,靠近尺侧的骨痂相对较为明显,骨缺损处密度欠均匀。第12周时,两侧自体骨与人工骨交界处可见明显骨性连接,实验侧人工骨外周同时见有皮质骨包绕,密度与正常骨相似,对照侧人工骨表面仍有较多骨痂 (见图 1)。
2.4 组织学观察 第 2周,实验侧人工骨内纤维结缔组织增生,纤维及软骨性骨痂形成,可见纤维直接成骨及软骨内骨化的方式形成网状新生骨小梁,小梁边缘覆以丰富的成骨细胞,骨基质内成骨细胞逐渐转化为骨细胞,小梁间纤维组织内富于毛细血管;对照侧纤维组织、毛细血管明显少于实验侧 ,未见新生骨岛、骨小梁。第 4周,实验侧纤维性软骨性骨痂逐渐向骨性骨痂过渡,新生的骨小梁逐渐变得粗大,边缘成骨细胞数量减少,不同成熟度的骨小梁排列成网架状编织骨,断端大量骨小梁通过;对照侧人工骨空隙内骨组织稀疏,主要为纤维组织,断端可见成骨。第 8周,实验侧断端已被骨组织桥接,并逐渐形成板状骨,人工骨空隙内可见大量新生骨组织生成替代,在应力的作用下出现骨的重建现象,原始哈佛氏管形成,外周见大量骨痂形成,并连成片状;对照侧新生骨主要集中在截骨端,骨小梁紊乱、不规则,成熟度较差,人工骨空隙内新生骨组织爬行距离较短。第 12周,实验侧人工骨完全修复,新生骨组织替代人工骨表面被皮质骨完全覆盖,缺损中心区大量人工骨孔隙内见较成熟骨组织;对照侧仅在截骨端见板层骨,缺损中心区大多数人工骨孔隙内无新生骨组织或骨组织成熟度较差 (见图 2)。

图1 术后 12周 X线片双侧骨缺损修复情况
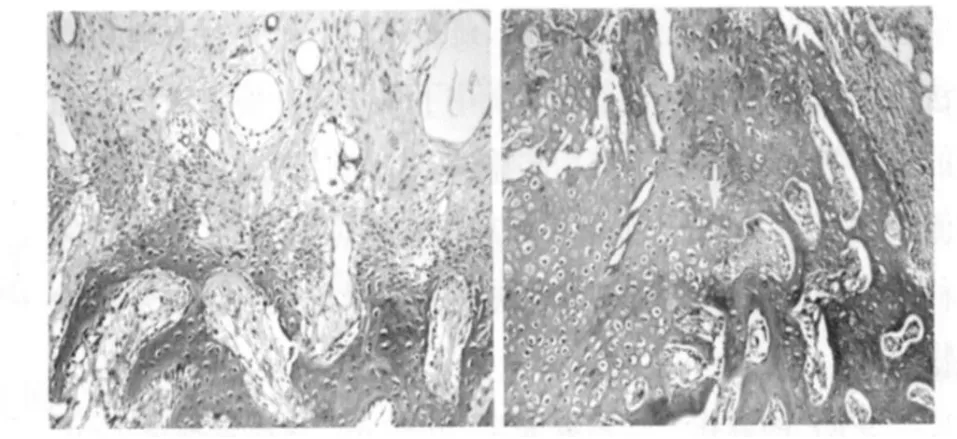
图2 术后 12周组织学观察
2.5 射透电镜观察 术后第 2周,两侧破骨细胞较多,细胞内溶酶体较丰富,成骨细胞均较少,细胞表现较为幼稚,细胞内线粒体、内质网等细胞体器较少,且不活跃,细胞周围胶原纤维均较少;但实验侧成骨细胞内线粒体和粗面内质网较多,细胞周围胶原纤维也较对照侧多,且排列整齐。第 4周 ,两侧的破骨细胞明显减少,成骨细胞和细胞周围胶原纤维明显增多;实验侧成骨细胞数量多,表现较成熟,细胞内线粒体、内质网等细胞体器较丰富,细胞周围胶原纤维较丰富,排列较为整齐;对照侧成骨细胞少,细胞内线粒体、内质网等细胞体器相对少,胶原纤维少且排列紊乱。第 8周,两侧以成骨细胞为主,部分成骨细胞已向骨细胞转化,可见板层骨雏形形成,未见破骨细胞;实验侧成骨细胞向骨细胞转化较多,板层骨雏形较多,偶见局部钙盐沉积现象。对照侧细胞周围胶原纤维较丰富 ,排列紊乱。第 12周,实验侧以骨细胞为主,可见大量板层骨,骨陷窝形成,对照侧以成骨细胞向骨细胞转化型为主,板层骨已形成,但数量较少。
2.6 计算机图像分析 用 SPSS11.0软件处理后 ,均有统计学意义,光镜下观察两端及中央部位修复性新骨生成情况。同时应用 MDGS图像分析系统采集图像并分析,统计新骨在缺损区所占的面积百分比。实验侧修复新生骨占骨缺损面积百分数随观察时间的延长而增加,并显著高于同一时期对照组的所有数据(见表 1)。
表1 两侧术后各周新生骨所占面积(%,)

表1 两侧术后各周新生骨所占面积(%,)
组 别 第 2周 第 4周 第 8周 第12周实验组 19.58± 7.651) 50.15± 12.692) 84.44± 9.772) 96.50± 7.052)对照组 10.98± 5.35 19.66± 10.15 42.94± 12.92 54.97± 7.65注:与同一期对照组比较:1)P<0.05;2)P<0.001。
3 讨 论
骨缺损的修复一直是骨科研究领域的难题,1998年Marx首次将 PRP复合自体骨移植修复下颌骨缺损,显示了良好的成骨效应。此后有大量应用不同载体复合 PRP修复骨缺损的实验报道,从影像学、组织学与组织形态学上也证实了 PRP能明显促进骨缺损的修复[3,5,6]。也有部分实验报道认为 ,只有当 PRP与自体骨混合植入,才能表现出对骨缺损修复的促进作用,而单纯和异体骨或人工骨混合使用,未能表现出对于骨缺损修复的促进作用。Choi[7]的实验表明,PRP并不能促进自体骨移植后颌骨缺损的修复。本实验的目的是为了探讨 PRP与人工骨复合,在同一个体上是否具有促进骨缺损修复作用。
从自体全血中提取的 PRP,制作简单 ,无免疫原性 ,且含有多种有利于骨愈合的生长因子如 TGF-β、PDGF和类胰岛素生长因子等。骨形成过程中,既与单一骨生长因子的分泌和表达水平有关,同时又受到因子间复杂的网络调节,PRP中各种生长因子间浓度比例最接近正常比例,提供的就是一种与体内生长因子修复系统相似而浓度更高的生长因子网络系统。各种生长因子间能发挥最佳协调作用,从而促进移植骨的生长。国内外研究者也证实添加多种生长因子比用单一生长因子更有利于促进骨愈合。
PRP促进骨愈合是由于其内所含的血小板能释放多种高浓度生长因子。生长因子是一系列有丝分裂原因子的传递工具,可增强未分化间充质细胞增殖和血管形成,对移植物的血管化起着重要作用,在骨修复的早期尤为关键。在骨折的自然愈合过程中,骨折端血凝块中的纤维蛋白和血小板聚集并释放各种生长因子,对骨折的愈合起主导作用。但有研究发现,血小板在伤口内的寿命和生长因子直接效应不超过5 d。 Marx等[8]认为一次性植入的血小板凋亡以后,巨噬细胞将替代血小板,成为生长因子的主要来源。但在本实验中,术后第 2周时实验组并未有大量的巨噬细胞的出现。
有研究表明 PRP与固体材料β-磷酸三钙 (β-tricalcium phosphate,β-TCP)、同种异体骨、自体骨等复合后,在骨再生的各个不同阶段,通过直接或间接的作用,促进细胞的增殖与分化[9~11],从而促进新骨再生。由于 PRP自身没有强度,而且还需要凝血酶、钙离子激活才能发挥生物效应,限制了它的应用[12]。本实验利用 PRP中含有多种生长因子的特性,与羟基磷灰石生物陶瓷结合后 ,提供抗压强度、骨传导性,用于修复兔桡骨骨缺损。实验结果表明,从大体标本、组织学,X线片及射透电镜观察,术后早期 2周时实验组和对照组并无明显差异。随着观察时间的延长,实验侧新骨生长速度和数量明显优于对照侧,显示了 PRP良好的促成骨效应。
由于本实验样本量较少,且仅对 PRP对成骨的影响进行研究,对 PRP与不同材料结合后成骨的生物力学方面影响尚待进一步研究。
[1]Froum SJ,Wallace SS,Tarnow DP,et al.Effect of platelet-rich plasma on bone growth and ossteointegration in human maxillary sinus grafts:three bilateral case reports[J].Int J Periodontics Restoratiye Dent,2002,22(1):45-53.
[2]Tischler M.Platelet rich plasma The use of autologous growth factors to enhance bone and soft tissue grafts[J].N Y State Dent J,2002,68(3):22.
[3]Fennis JP,Stoelinga PJ,Jansen JA.Mandibular reconstruction: a histologicaland histomorphometric study on the use of autogenous scaffolds,particulate cortico-cancellous bone grafts and platelet rich plasma in goats[J].Int J Oral Maxillofac Surg,2004,33(1):48-55.
[4]Kovacs K,Velich N,Huszar T,et al.Comparative study of betatricalcium phosphate mixed with platelet-rich plasma versus betatricalcium phosphate,abone substitute material in dentistry[J].Acta Vet Hung,2003,51(4):475-484.
[5]张长青,袁霆,曾炳芳,等.富血小板血浆促进骨缺损修复的实验研究 [J].中国修复重建外科杂志,2003,17(5):355-358.
[6]Kassolis JD,Reynolds M A.Evaluation of the adjunctive benefits ofplatelet-rich plasma in subantral augm augmentation[J].J Craniofac Surg,2005,16(2):280-287.
[7]Choi BH,Im CJ,Huh JY,et al.Effect of platelet-rich plasma on bone regeneration in autogenous bone graft[J].Int J Oral Maxillofac Surg,2004,33(1):56-59.
[8]Marx RE,Carlson ER,Eichstaedt RM,et al.Plateletrich plasma:Growth factor enhancement for bone grafts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85(6):638-646.
[9]Gerard D,Carlson ER,Gotcher JE,et al.Effects of platele-rich plasma at the cellular level on healing of autologous bone-grafted mandibular defects in dogs[J].J Oral Maxillofac Surg,2007,65(4):721-727.
[10]Kanno T,Takahashi T,Tsujisawa T,et al.Platelerich plasma enhances human osteoblast-like cell proliferation and differentiation[J].J Oral Maxillofac Surg,2005,63(3):362-369.
[11]程文俊,金丹,赵艳 ,等.富血小板血浆对青山羊骨髓间充质干细胞增殖分化的影响 [J].中国修复重建外科杂志,2007,21(4):386-389.
[12]Martineau I,Lacoste E,Gognon G.Effects of calcium and thrombin on growth factor release from platelet concentrates:kinetics and regulation of endothelial cell proliferation[J].Biomaterials,2004,25(18):4489-4502.

