人PBMCs内表达CCR5Delta32蛋白对HIV-1辅受体抑制作用的研究①
李翠莹 安群星 甘新宇 (成都军区总医院输血科,成都 610083)
获得性免疫缺陷综合征(AIDS)是一种由人类免疫缺陷病毒(HIV)引起的严重传染病,迄今仍缺乏特别有效的治疗方法。HIV-1辅受体及其基因多态性的发现给AIDS的治疗研究带来新的契机。CCR5和CXCR4是HIV-1最为主要的辅受体,CCR5辅受体在人群中存在有多种突变,其中CCR5Delta32是一种最常见、也是最重要的辅受体突变形式。据研究[1-5],CCR5Delta32纯合子突变个体能有效抵制HIV-1感染,其杂合子个体也不易被HIV-1感染或感染后病程进展缓慢。我们从CCR5Delta32突变个体获得目的基因并将其克隆至pLenti6/V5-D-TOPO载体,经慢病毒包装后转染人外周血单个核细胞(PBMCs),研究目的基因的表达对靶细胞表面HIV-1辅受体CCR5和CXCR4的抑制作用。这些工作为今后AIDS的基因治疗研究奠定了基础。
1 材料与方法
1.1 材料 E.coli DH5α菌株和293T细胞为本室保存。载体 pUCm-T、pLP1、pLP2、pLP/VSVG 和 pLenti6/V5-D-TOPO均购自Invitrogen公司。基因组DNA提取试剂盒购自QIAGEN公司,胶回收试剂盒购自宝信公司,质粒快速提取试剂盒购自Promega公司。Taq DNA聚合酶、T4 DNA连接酶,以及限制性内切酶EcoRⅠ、BamHⅠ和 PstⅠ均购自 TaKaRa公司。转染试剂GeneCompanionⅡ购自GeneTrans公司,培养基DMEM+10%胎牛血清购自Hyclone公司。Anti-CD4-FITC、Anti-CCR5-PE和Anti-CXCR4-PE-Cy5购自eBioscience公司。
1.2 方法
1.2.1 重组慢病毒载体的构建及包装 从CCR5Delta32突变个体外周血提取基因组DNA,以其为模板利用设计的一对引物进行PCR扩增。将扩增产物克隆至pLenti6/V5-D-TOPO载体,随后转化E.coli DH5α宿主菌。碱裂解法小量提取质粒进行酶切鉴定及测序。用 pLP1、pLP2、pLP/VSVG 及pLenti-CCR5Delta32四种质粒共转染293T细胞,获得重组慢病毒液并测定其滴度。
1.2.2 重组慢病毒转染PBMCs 用淋巴细胞分离液从新鲜外周血中提取PBMCs,用10%FCS RPMI1640 培养液(含 10 μ g/ml PHA,100 U/ml rIL-2)培养48小时。加入包装好的重组慢病毒液1 ml(5×105TU/ml),加入 polybrene(6 μ g/ml),感染 2 ~ 3 小时。移除感染上清,加入新培养液(含PHA和rIL-2)培养24小时,观察转染情况。
1.2.3 Western blot鉴定 裂解转染有目的基因的PBMCs,之后行12%SDS-PAGE,结束后将蛋白转移至NC膜上。以抗CCR5Delta32兔血清(参照文献[3]本室自制)为一抗,以鼠抗兔IgG-HRP为二抗,用ECL显色后观察结果。
1.2.4 FACS分析 用PBS调整经转化的PBMCs为1×106个/100 μ l/管 ,分别加入 20 μ l荧光抗体(Anti-CD4-FITC、Anti-CCR5-PE和Anti-CXCR4-PE-Cy5),4℃避光孵育30分钟。结束后加入1.5 ml PBS洗涤2次,用400 μ l 2%多聚甲醛固定后进行FACS分析。
2 结果
2.1 重组慢病毒载体的构建及包装 以CCR5Delta32突变个体基因组DNA为模板PCR得到约650 bp的扩增片段。测序正确后构建pLenti-CCR5Delta32质粒,用包括pLenti-CCR5Delta32在内的四种质粒共转染293T细胞,产生重组慢病毒,测定其滴度为5×105TU/ml。
2.2 Western blot鉴定 用Lenti-CCR5Delta32重组慢病毒感染人PBMCs,培养48小时后裂解细胞进行 Western blot鉴定。结果证实,目的蛋白在人PBMCs内成功表达(图1)。
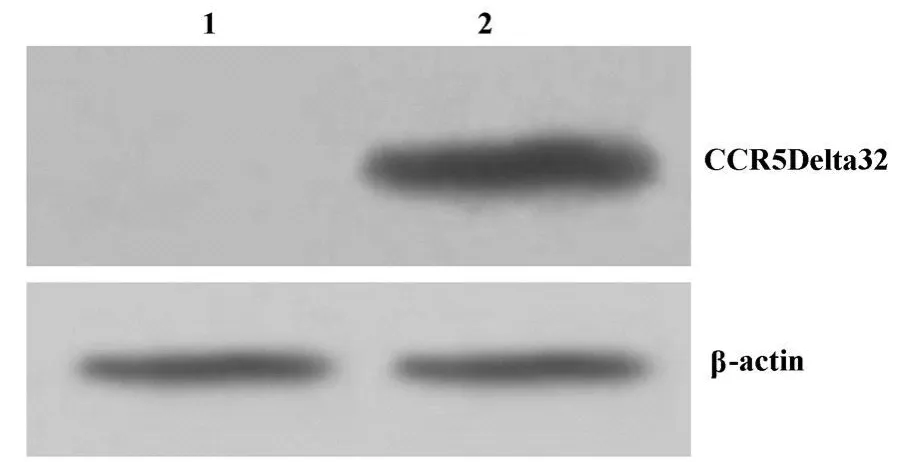
图1 Western blot检测目的蛋白的表达Fig.1 The expressed proteins were confirmed by Western blot analysis

图2 FACS分析转染前后 PBMCs表面CCR5辅受体变化Fig.2 FACS analysis of CCR5 expression on human PBMCs before and after transfection with Lenti-CCR5Delta32
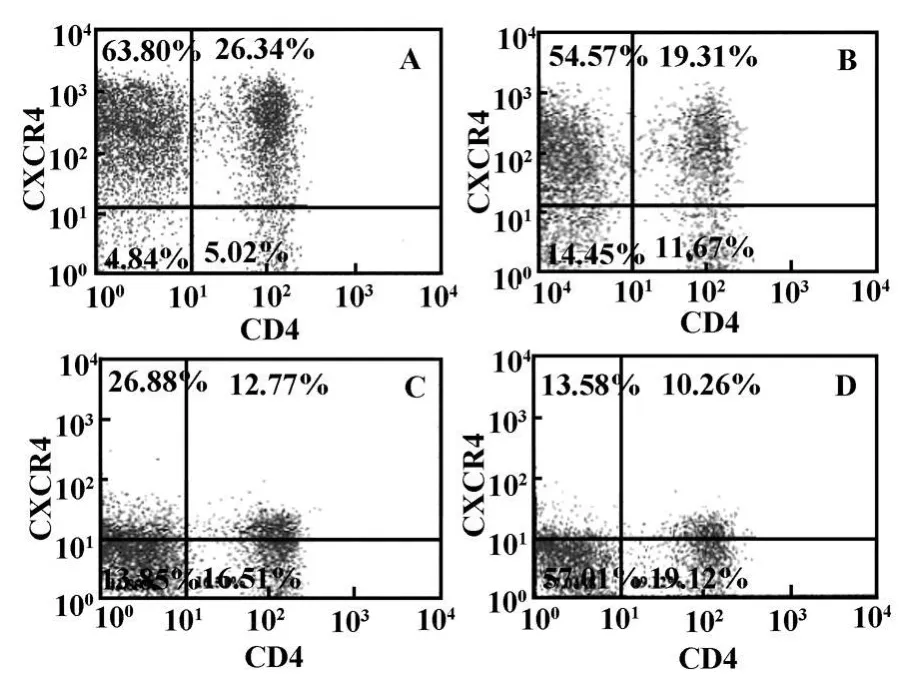
图3 FACS分析转染前后 PBMCs表面CXCR4辅受体变化Fig.3 FACS analysis of CXCR4 expression on human PBMCs before and after transfection with Lenti-CCR5Delta32
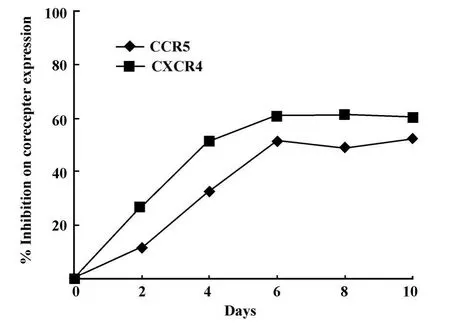
图4 PBMCs内CCR5Delta32蛋白表达对细胞表面辅受体产生的抑制作用Fig.4 Inhibition of CCR5Delta32 protein on human PBMCs surface expression of coreceptor
2.3 FACS分析 培养经转化的PBMCs,每隔2天对其表面CCR5和CXCR4辅受体进行FACS分析。结果表明,靶细胞内目的蛋白的表达对靶细胞表面辅受体CCR5和CXCR4的产生起抑制作用,抑制率在转染后第6天达到高峰(CCR5的抑制率为51.69%,CXCR4的抑制率为61.05%),以后维持在此水平(图2~4)。
3 讨论
HIV-1必需与CD4受体及一些必要的辅受体结合,才能感染进入靶细胞。现已明确,CCR5和CXCR4是HIV-1两类最为主要的辅受体,其中CCR5辅受体在人群中存在有多种突变。CCR5Delta32是一种最常见,也是最重要的辅受体突变形式。它是由于CCR5辅受体基因在自然进化过程中发生了32个碱基缺失的突变,即在CCR5基因编码区域第185位氨基酸密码子以后发生了32个碱基的缺失,导致开放读码框错位,造成蛋白质翻译的提前终止,在细胞内产生出一种截短的、无功能的CCR5Delta32突变蛋白。正常CCR5分子量约为46 kD,而这种截短的突变蛋白分子量只有30 kD。据调查研究,CCR5Delta32纯合子突变个体能有效抵制HIV-1感染,其杂合子个体也不易被HIV-1感染或感染后病程进展缓慢。通过Hardy-Weinberg测试及其他研究,这类突变个体其生理及生殖发育等方面均未受到任何影响。据流行病学调查发现,在美国白人和欧洲后裔中,CCR5Delta32等位基因突变率约为10%左右[6,7]。在我国,各民族CCR5Delta32平均突变率还不到0.2%,而且主要为杂合子突变[8]。从遗传学角度认为,我国人群普遍对HIV-1易感。目前,CCR5Delta32突变个体抗HIV-1感染的机理已基本清楚,可归纳如下:由于这种突变个体淋巴细胞内产生的CCR5Delta32蛋白,通过反式显性失活(transdominant negative,TDN)效应抑制细胞表面CCR5和CXCR4两类辅受体的表达,从而阻止了嗜T、嗜M及双嗜性HIV-1毒株的感染[1,3,9,10]。具体地说,是细胞内产生的CCR5Delta32突变蛋白,与胞内新合成的两类辅受体通过异源二聚体形式结合并将之扣押,使其无法到达细胞表面。经过数天的新陈代谢,细胞表面两类辅受体就会减少乃至消失,从而达到抑制各类HIV-1毒株感染的作用。
这个发现给AIDS的治疗带来新的契机。我们拟通过构建含CCR5Delta32基因的真核表达载体,体外转染人PBMCs或造血干细胞,通过表达产物与细胞内新合成的两类辅受体(CCR5和CXCR4)结合并将之扣押在胞内,从而达到同时阻断嗜T、嗜M及双嗜性HIV-1毒株感染的目的。
本研究成功地构建了重组慢病毒载体pLenti-CCR5Delta32,转染人PBMCs后检测到目的蛋白的表达。FACS分析显示,靶细胞内目的蛋白的表达对靶细胞表面辅受体CCR5和CXCR4的产生起抑制作用。这些工作为后续的AIDS基因治疗研究奠定了基础。
1 Agrawal L,Jin Q,Altenburg J et al.CCR5Delta32 Protein expression and stability are critical for resistance to HIV-1 in vivo[J].J Virol,2007;81(13):8041-8049.
2 Huang Y,Paxton W A,Wolinsky S M et al.The role of a mutant CCR5 allele inHIV-1 transmissionand disease progression[J].NatMed,1996;2(11):1240-1243.
3 Agrawal L,Lu X,Qingwen J et al.Role for CCR5Delta32 protein in resistance to R5,R5X4,and X4 human immunodeficiency virus type 1 in primary CD4+cells[J].J Virol,2004;78(5):2277-2287.
4 Liu R,Paxton WA,Choe S et al.Homozygous defect inHIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection[J].Cell,1996;86(3):367-377.
5 Dean M,CarringtonM,Winkler C et al.Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene[J].Science,1996;273(5283):1856-1862.
6 Zimmerman P A,Buckler-White A,Alkhatib G et al.Inherited resistance to HIV-1 conferred by an inactivating mutation in CC chemokine receptor 5:studies in populations with contrasting clinical phenotypes,defined racial background,and quantified risk[J].Mol Med,1997;3(1):23-36.
7 Samson M,Libert F,Doranz B J et al.Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptorgene[J].Nature,1996;382(6593):722-725.
8 Wang F S,Jin L,Hong W G et al.Low frequencies of CCR5-△32 and CCR5-m303,but high frequencies of CCR2-641 and SDF1-3′A alleles in indigenous ethnic groups in mainland China[J].Chin J Sex Transm Inf,2002;2(1):7-12.
9 Marmor M,Sheppard HW,Donnell D et al.Homozygous and heterozygous CCR5-Delta32 genotypes are associated with resistance to HIV infection[J].J Acquir Immune Defic Syndr,2001;27(5):472-481.
10 Chelli M,AlizonM.Determinants of the trans-dominant negative effect of truncated forms of the CCR5 chemokine receptor[J].J Biol Chem,2001;276(50):46975-46982.