γ δT细胞诱导与分化的初步研究-Ⅰ①
胡朝英 钱 柳 程伟志 黄秋愉 汪 萍 余奇文 张继英 陈雪华 张冬青
(上海交通大学医学院上海市免疫学研究所,上海 200025)
人类γ δ T细胞据其δ链可分为δ 1和δ 2两个亚群,δ 1亚群主要分布于外周器官的粘膜和皮下,在不同的组织部位,其数量不等;δ 2亚群主要存在于外周血中,占T淋巴细胞的0.5%~10%[1,2]。外周血中的γ δ T细胞约占人体总γ δ T细胞的90%以上,且主要取用Vγ 9Vδ 2 TCR基因片段,它能够直接识别抗原分子而不受MHC分子限制,在固有免疫中发挥重要作用[3,4]。近年来γ δ T细胞是免疫学的一个研究热点,国内外学者对其分化和功能进行了广泛深入的研究[5,6],但以动物实验多见,且集中在抗感染和抗肿瘤等方面[7,8],而有关人类γ δT细胞的亚型分化及免疫调节功能的研究尚处早期。本文旨在应用异戊烯焦磷酸(Isopentenyl pyrophosphate,IPP)诱导健康人外周血和新生儿脐带血γ δT细胞扩增,分析其不同亚型的分化格局,从而进一步丰富对人类γ δ T细胞异质性的认识,为深入研究γ δT细胞与自身免疫病关联性提供实验依据,更为应用γ δT细胞干预自身免疫性疾病探索其可能性。
1 材料与方法
1.1 标本来源 本实验所用的人外周血细胞均来自本校健康学生志愿者,共15名,其中男8名,女7名;年龄18~35岁;新生儿脐带血来自妇幼保健院足月自然分娩健康新生儿结扎剪断脐带后脐静脉采血。
1.2 主要试剂 RPMI1640培养基(Gibco,BRL);胎牛血清(FBS,Gibco);IL-2(Roche);异戊烯焦磷酸(Sigma);结核杆菌多肽抗原(Mtb-Ag)由蚌埠医学院李柏青教授惠赠;γ δ TCR,CD4,CD8磁珠分选试剂盒(Miltenyi Biotec);抗 CD3-FITC/PerCP,抗 γ δ TCR-PE,抗 γ 9-FITC,抗 δ 2-FITC/PE,抗 CD80/86-FITC,抗HLADR-PE/PE-Cy5,抗 CD69-PE,抗 CD27-PE,抗CD45RA/RO-PE-Cy5(所有荧光标记单抗均购自BD公司);淋巴细胞分离液(LymphoprepTM,Axis-shield)。1.3 实验方法
1.3.1 细胞分选 密度梯度离心法分离全血获取外周血单个核细胞(PBMC)和脐带血单个核细胞(CBMC)。部分PBMC经γ δ TCR磁珠分选获取γ δT细胞(纯度大于90%),用于细胞增殖实验的效应细胞;余阴选细胞经CD4和CD8磁珠分选去除CD4+T细胞和CD8+T细胞后,用于增殖实验的辅佐细胞。部分PBMC和全部CBMC用于流式分析细胞表型和细胞培养。
1.3.2 细胞增殖实验 将磁珠分选得到的γ δT细胞用含20%FBS的RPMI1640培养基稀释成1×106ml-1,加入 96孔培养板,每孔 100 μ l;含或不含 IL-2(20 U/ml)、不同浓度的 IPP(0.08 、0.8、3.2、8.0、20、80.0 μ g/ml)或 Mtb-Ag(20.0 μ g/ml)[9]的 RPMI1640培基每孔50 μ l;将辅佐细胞用RPMI1640培养基稀释成4×105ml-1,每孔 50 μ l,37℃、5%CO2 饱和湿环境中培养。6天后加入3[H]-TdR 1μ Ci/孔,继续培养16小时后,收集细胞,β液闪计数仪测定3[H]-TdR掺入量,结果以每分脉冲数(cpm)表示。
1.3.3 细胞培养 将PBMC和CBMC分别用含10%FBS、IL-2(5 U/ml)和最佳浓度IPP的 RPMI 1640培养基稀释成1×106ml-1,加入24孔培养板,每孔1 ml,37℃、5%CO2饱和湿环境中培养。
1.3.4 γ δ T细胞诱导前后的表型分析 流式细胞术分析γ δ T细胞在健康人外周血和新生儿脐带血T细胞中的比例、Vγ 9Vδ 2 T细胞亚群在 γ δ T 细胞中的分布及其亚型;检测IPP诱导后γ δ T细胞的比例,同时分析Vγ 9Vδ 2 T细胞的亚型和表型变化。流式细胞仪检测结果使用BD CellQuest软件进行分析。
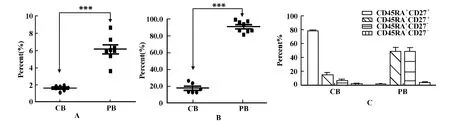
图1 外周血和脐带血γ δT细胞数量及亚群的异质性Fig.1 The heterogeneity of γ δT cells in the quantity and subgroups between peripheral blood and cord blood
1.4 统计学分析 所有数据均使用Prism(Graph-Pad)软件进行分析。用双侧配对 t检验对两组数值进行比较;用方差分析处理组内数据;将P<0.05视为有统计学差异并在图中进行标注(*.0.01<P<0.05;**.0.001<P<0.01;***.P<0.001)。
2 结果
2.1 外周血和脐带血γ δT细胞数量及亚群的异质性 外周血 γ δ T细胞比例明显高于脐带血 γ δT细胞的比例,前者为6.161±1.456,后者为1.644±0.307,两者具有统计学差异(图1A);外周血和脐带血Vγ 9Vδ 2 T细胞亚群比例差异显著(17.98±6.07,91.39±6.67)且其各亚型分布格局不同(图1B、C)。2.2 IPP诱导γ δ T细胞的扩增存在剂量依赖 微量浓度IL-2具有协同IPP对γ δT细胞的促增殖作用。IPP诱导γ δ T细胞增殖效能以2 μ g/ml协同微量IL-2(5 U/ml)作用最显著。如图2所示。
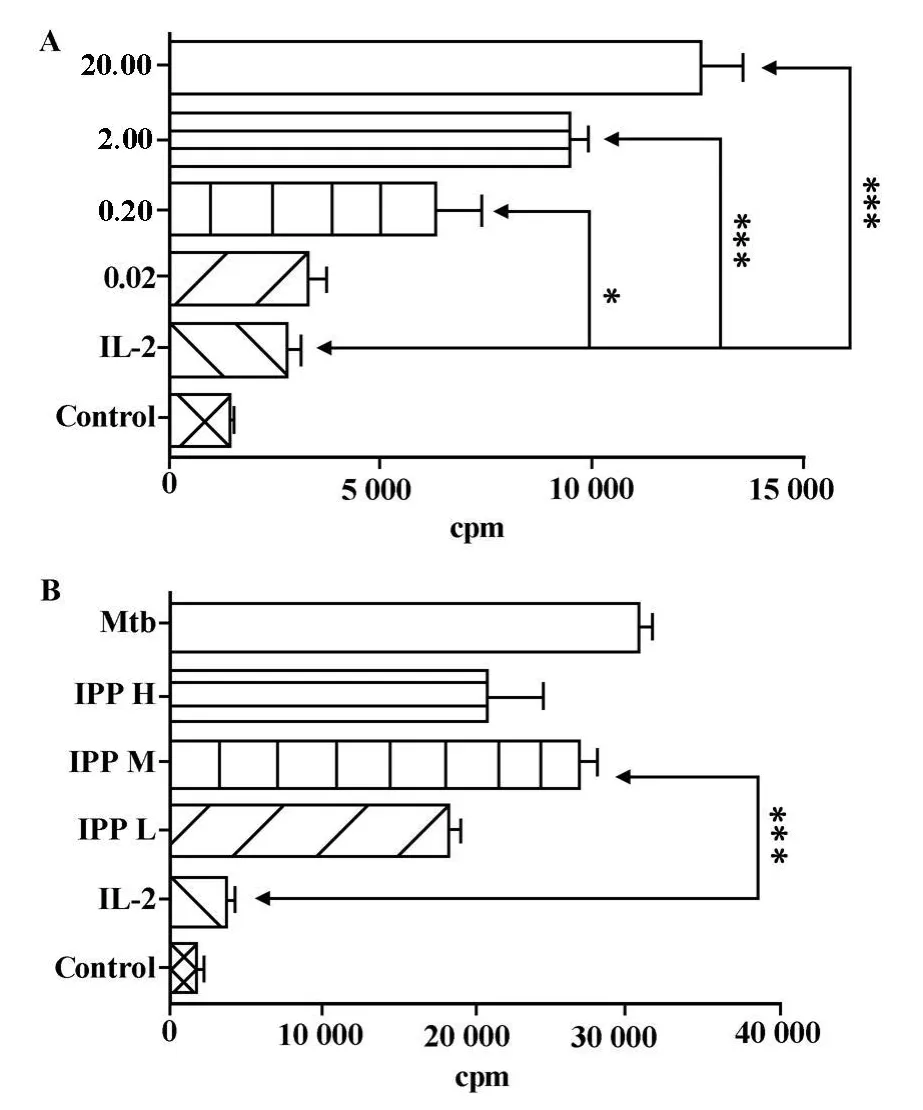
图2 IPP诱导γ δT细胞扩增呈剂量依赖Fig.2 IPP-induced expansion of γ δT cells is dose-dependent
2.3 IPP对脐带血γ δ T细胞的诱导作用 在 IPP作用下,外周血 γ δT细胞比例明显增高,且大部分Vγ 9Vδ 2 T细胞被活化成效应记忆型(CD27-CD45RA-);IPP同样诱导脐带血γ δT细胞扩增,但不同的是Vγ 9Vδ 2 T细胞虽趋向中央记忆型(CD27+CD45RA-)和效应记忆型(CD27-CD45RA-)分化,但仍以幼稚型(CD27+CD45RA+)为主,见图3。
2.4 IPP活化的外周血Vγ 9Vδ 2 T细胞特征 被IPP活化的外周血Vγ 9Vδ 2 T细胞的特征之一在于高表达HLA-DR和 B7分子(图4)。而脐带血Vγ 9Vδ 2 T细胞表面HLA-DR和B7分子也有一定程度的表达。
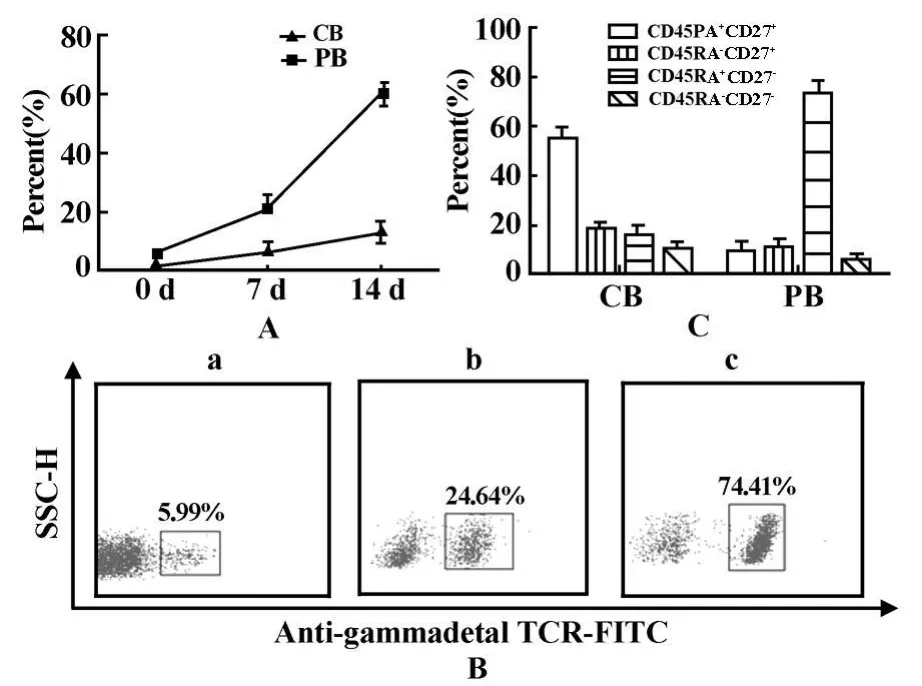
图3 IPP对γ δT细胞的诱导作用Fig.3 γ δT cells induced with IPP
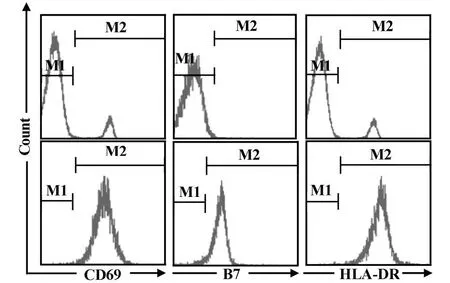
图4 IPP活化的外周血Vγ 9V δ 2 T细胞表型特征Fig.4 The phenotype characteristic of PB V γ 9Vδ 2 T cells activated by IPP
3 讨论
人类γ δ T细胞根据其TCRγ、δ链的不同组合可分为多个亚群,由于其亚群的异质性而呈现了不同的生物学特性[3,10]。最初人们对γ δ T细胞的认识只限于其在固有免疫中的作用,然而自上个世纪八、九十年代,越来越多的研究发现γ δT细胞在适应性免疫中同样扮演着重要的角色。因此对于γ δ T细胞的定义,就有“第一道防线”,“调节细胞”或“先天性和适应性免疫应答之间的桥梁”等,但这些都只是描述了其复杂行为的某一层面[11]。事实上,在胸腺和外周组织中,γ δ T细胞的发育受其它免疫活性细胞的影响,形成了一个具有独特生物学特征的淋巴细胞亚群系统,对健康组织、免疫细胞,病原体持续感染的组织以及宿主对病原体的免疫应答都有很多直接或间接的影响。近年来,γ δT细胞具有的专职性抗原递呈细胞的特性已成为人们研究的热点。Moser等研究了人扁桃体来源的γ δT细胞,发现其具有专职性抗原递呈细胞的表型和功能[12,13];随后国内外科学家陆续在小鼠和牛的实验中也发现了这一现象[14,15]。此外 ,γ δT细胞通过分泌 IL-17、IFN-γ等细胞因子在感染性疾病和肿瘤中的作用也再次受到关注[16-18]。目前发现γ δT细胞在感染免疫、自身免疫和肿瘤免疫中都发挥着重要的作用[19,20],可见γ δT细胞是一种“全能细胞”,与人类的很多疾病都有或多或少的联系,有很大的研究空间和临床价值。
由于γ δT细胞在外周血中数量很少,为我们深入研究其分化过程和生物学功能带来一定困难,目前已有多种扩增外周血中γ δT细胞的方法[21,22],特别是何维教授的课题组成功建立了一例健康人γ δT细胞的克隆[23]。本课题组一直致力于应用脐带血为 γ δ T 细胞的来源,尤其是研究 γ δT 细胞的分化 。若能从新生儿脐带血扩增出γ δ T细胞必将为我们提供丰富的细胞来源,为进一步研究γ δT细胞奠定实验基础。本文通过对外周血和脐带血中γ δ T细胞的诱导活化扩增,分析两者的差异及其不同阶段的表型特征,以期确定发挥抗原递呈作用的主要亚型以及此亚型的其它生物学功能,为探索其与临床疾病的关联性打下基础。
本实验结果表明外周血和脐带血γ δ T细胞在数量、亚群诸方面都有明显的差异,且二者对IPP的反应性不同。外周血γ δ T细胞被有效地活化成效应记忆型的同时,高表达抗原递呈相关的表面分子。由于脐带血来源的γ δT细胞主要是幼稚型细胞,在体外培养过程中,仍需相关细胞因子(如:IL-7、IL-15等[24,25])的协同作用,才能完全呈现出其分化成熟为可用于理论研究和临床实验的效应记忆型γ δ T细胞的潜能。
本文旨在报道我们对γ δ T细胞分化和表型分析的前期研究,为深入研究γ δ T细胞的功能,尤其是其抗原递呈作用做一铺垫,更为将γ δT细胞用于免疫调节和干预自身免疫病与肿瘤提供实验依据。
真诚感谢蚌埠医学院李柏青教授的指导和惠赠结核杆菌多肽抗原(Mtb-Ag)。
1 Fischer S,Scheffler A,Kabelitz D.Activation of human gamma delta T-cells by heat-treated mistletoe plant extracts[J].Immunol Lett,1996;52(2-3):69-72.
2 胡朝英,张冬青.γ δ T细胞的专职性抗原递呈作用[J].细胞生物学杂志,2008;31(3):344-348.
3 Beetz S,Wesch D,Marischen L et al.Innate immune functions of human gammadelta T cells[J].Immunobiology,2008;213(3-4):173-182.
4 Kabelitz D,Glatzel A,Wesch D.Antigen recognitionby human gammadelta T lymphocytes[J].Int Arch Allergy Immunol,2000;122(1):1-7.
5 Dieli F,Poccia F,LippM et al.Differentiation of effector/memory Vdelta2 T cells and migratory routes in lymph nodes or inflammatory sites[J].J Exp Med,2003;198(3):391-397.
6 Ferlazzo V,Sferrazza C,Caccamo N et al.In vitro effects of aminobisphosphonates on Vgamma9Vdelta2 T cell activation and differentiation[J].Int J Immunopathol Pharmacol,2006;19(2):309-317.
7 Gong F,Ma Y H,Ma A L et al.A lectin from Chinese mistletoe increases γ δT cell-mediated cytotoxicity through induction of caspase-dependent apoptosis[J].Acta Biochim Biophys Sin,2007;39(6):445-452.
8 Ma Y H,Cheng W Z,Gong F et al.Active chinese mistletoe lectin-55 enhances colon cancersurveillance through regulating innate and adaptive immune responses[J].World J Gastroenterol,2008;14(34):5274-5281.
9 陈 勇,吕合作,李柏青 et al.纯化的结核杆菌多肽抗原刺激人γ δ T细胞的效应分析[J].分子与细胞免疫学,2004;20(10):661-664.
10 Hayday A C.[gamma][delta]cells:a right time and a right place for a conserved third way of protection[J].Annu Rev Immunol,2000;18:975-1026.
11 Born W K,Reardon C L,O'Brien R L.The function of gammadelta T cells in innate immunity[J].Curr Opin Immunol,2006;18(1):31-38.
12 BrandesM,Willimann K,Moser B.Professional antigen-presentation function by human gammadelta T cells[J].Science,2005;309(5732):264-268.
13 Moser B,Brandes M.Gammadelta T cells:an alternative type of professional APC[J].Trends Immunol,2006;27(3):112-118.
14 Lan C,Yan C,Hui S et al.Mouse γ δT cells are capable of expressing MHC classⅡmolecules,and of functioning as antigen-presenting cells[J].J Neuroimmunology,2008;203(1):3-11.
15 Collins R A,Werling D,Duggan S E et al.γ δT cells present antigen to CD4+α β T cells[J].J Leuko Bio,1998;63(6):707-714.
16 Roark C L,Simonian P L,Fontenot A P et al.gammadelta T cells:an important source of IL-17[J].Curr Opin Immunol,2008;20(3):353-357.
17 Umemura M,Kawabe T,Shudo K et al.Involvement of IL-17 in Fas ligand-induced inflammation[J].Int Immunol,2004;16(8):1099-1108.
18 Umemura M,Yahagi A,Hamada S et al.IL-17-mediated regulation of innate and acquired immune response against pulmonary Mycobacteriumbovis bacille Calmette-Guerin infection[J].J Immunol,2007;178(6):3786-3796.
19 Kabelitz D,Wesch D,He W.Perspectives of gammadelta T cells in tumor immunology[J].Cancer Res,2007;67(1):5-8.
20 高学平,宋秀宇,陈 勇 et al.γ δ T细胞的细胞毒活性研究[J].肿瘤,2001;21(2):94-97.
21 陈复兴,刘军权,冯 霞 et al.一种体外扩增人γ δT细胞的新方法[J].细胞与分子免疫学杂志,2007;23(7):662-664.
22 王克强,侯彦强,李 雁.一种简单快速扩增和获取外周血γ δT细胞的方法[J].中国实验血液学杂志,2004;12(3):372-374.
23 何小鹃,康宁,陈 慧 et al.一株健康人γ δT细胞克隆的建立及鉴定[J].基础医学与临床,2009;29(1):24-28.
24 Laky K,Lewis J M,Tigelaar R E et al.Distinct requirements for IL-7 in development of TCRγ δcells during fetal and adult life[J].J Immunol,2003;170(8):4087-4094.
25 Rochman Y,Spolski R,LeonardW J.New insights into the regulation of T cells by γ c family cytokines[J].Nature Reviews Immunology,2009;9(7):480-490.