壮族人群少精不育患者精细胞GSTT1和GSTM1基因研究①
陈文成 康熙雄 韦叶生 潘 云 周亚莉 张国军 (右江民族医学院医学检验学院,百色 533000)
根据世界卫生组织估计,全球有近6000万人罹患不孕症,约占育龄人口的10%。其中近一半由男性因素所致,称为男性不育[1]。导致男性不育的原因很多,其中相关基因的突变是一个重要的因素。大量的研究表明,人体内特别是生殖腺里的毒性物质对精子的成熟和精液的质量有很大影响,谷胱甘肽转硫酶(Glutathione s-transferase,GST)能催化多种Ⅰ相酶代谢活化产生的毒性代谢产物与谷胱甘肽(GSH)巯基(-SH)共轭结合,形成亲水性物质排出体外,从而提高机体的解毒作用。GST几乎广泛存在于人体所有的细胞和组织,尤其在生殖腺、肝脏、结肠中表达较高,其基因的缺失和人体对环境中毒性物质的解毒能力相关,从而影响到精子的成熟和精液的质量,导致男性不育。
本工作运用PCR法对75名壮族少精不育患者精细胞GSTT1和GSTM1基因进行多态性研究,探讨壮族人群中该基因多态性与少精症的关系。
1 对象与方法
1.1 对象 实验组:75例均为少精症(精子密度<20×109L-1且精子形态正常在45%以下,精子活率在30%~60%之间),年龄25~40岁,平均 32岁,婚后不育年限2~8年,平均3.5年。所有患者性功能正常,无生殖系统器质性病变及炎症、阻塞等。检测前抽静脉血检查染色体核型(G显带技术)、抗精子抗体(ELISA)及血清激素水平,异常者不列入研究对象。对照组:36例为已生育且精液正常(精子密度≥20×109/L,A级精子>25%或A+B级精子>50%)的健康男性,年龄25~40岁,平均32.5岁。研究对象禁性生活3天后,取精液检查,连续2次异常予以确诊。精液标本均来自右江民族医学院附属医院检验科,研究对象均为壮族人。
1.2 实验方法 精液DNA提取:吸取精液200 μ l,加1ml灭菌生理盐水混匀,5 000 r/min离心5分钟,弃上清,加STE直至加到溶液均一、不混浊,37℃水浴1 小时 ,加蛋白酶K(终浓度 100 μ g/m1),55℃水浴3小时,加等体积酚/氯仿,12 000 r/min离心5分钟,吸上清于另一管中,加2倍体积无水乙醇。置-20℃沉淀30分钟,12 000 r/min离心15分钟。弃上清,自然干燥,加TE液10 μ l,混匀,4℃保存待用。
1.3 PCR反应体系 引物设计参照文献[2]的报道,由上海生工生物工程技术有限公司合成。GSTM1 引物:正向 5′-GAACTCCCTGAAAAGCTAAAGC-3′,反向 5′-GTTGGGCTCAAATATACGGTGG-3′;GSTT1 引物:正向 5′-TTCCTTACTGGTCCTCACATCTC-3′,反向 5′-TCACCGGATCATGGCCAGGCGCA-3′。 内对照β-globin 基因引物:正向 5′-CAACTTCATCCACGTTCACC-3′;反向 5′-GAAGAGCCAAGGACAGGTAC-3′。 反应体积为 25 μ l,含基因组 DNA 0.5 μ g,2.5 mmol/L MgCl2,200 μ mol/L dNTP,上下游引物各 0.5 μ mol/L,1U Taq DNA聚合酶。PCR循环:94℃60秒,59℃30秒,72℃80秒,共32个循环。将扩增的PCR产物加在1.5%琼脂糖凝胶上电泳,电流45 mA,电压100 V,电泳载样缓冲液为1×TBE缓冲液,用溴乙锭染色,在紫外灯下观察结果。
1.4 结果判断 有电泳条带者为GSTM1基因携带者(present),无显示则为缺失(deleted)。
1.5 统计学分析 实验组和对照组的基因(型)频率比较分析用 χ2检验,用SPSS软件包进行分析。
2 结果
2.1 结果判断 精细胞基因经PCR扩增后,将扩增的PCR产物加在20 g/L琼脂糖凝胶上电泳,用溴乙锭染色,在紫外灯下观察结果,有电泳条带者为GST基因携带者(present),无显示则为缺失(deleted)。GSTT1 为 480 bp、GSTM1为 215 bp,内对照 βglobin为268 bp,见图1。
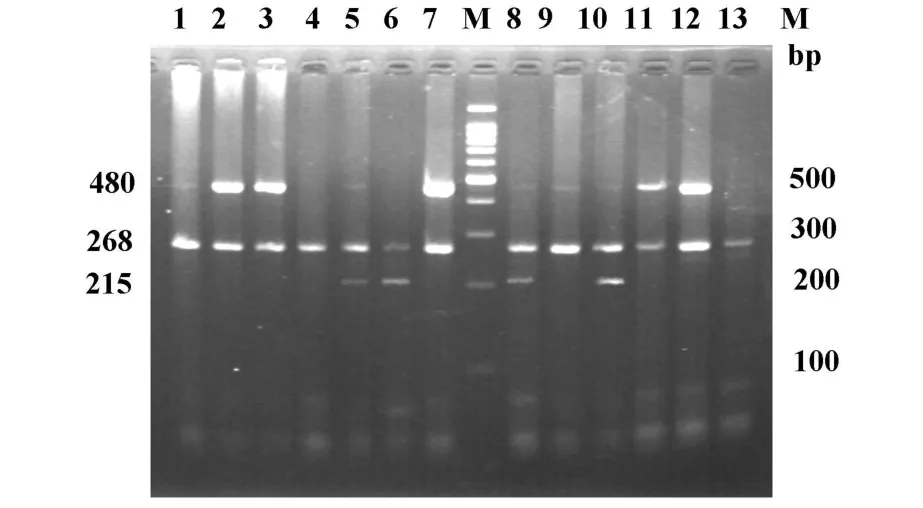
图1 精细胞GSTM1和GSTT1基因电泳图Fig.1 PCR product of GSTM1 and GSTT1 genes

表1 GSTM1基因分析Tab.1 Analysis of the GSTM1 genotypes AA,AG,and GG

表2 GSTT1基因分析Tab.2 Analysis of the GSTT1 genotypes AA,AG,and GG
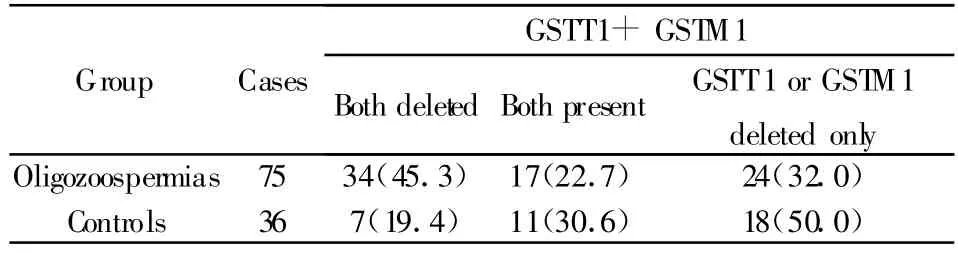
表3 GSTM1和GSTT1基因分析Tab.3 Analysis of the GSTM1 and GSTT1 genotypes AA,AG,and GG
2.2 实验组与对照组GSTM1基因多态性比较 结果如表1,实验组的缺失型基因高于对照组,差异有统计学意义(P<0.05)。
2.3 实验组与对照组GSTT1基因多态性比较 结果如表2,实验组的缺失型基因与对照组比较,差异没有统计学意义(P>0.05)。
2.4 实验组与对照组GSTM1基因、GSTT1基因多态性同时比较 结果如表3,实验组的均缺失型基因与对照组比较,差异有统计学意义(P<0.05)。
3 讨论
男子不育症的发病原因复杂,多种因素均可以影响男性生育力,包括染色体异常、生殖道感染、睾丸生精功能异常、精子结构异常和精浆异常、男性性功能障碍等。其中部分与遗传因素有关,深入研究各种基因变异导致生殖损伤的分子作用机理,可以进一步揭开男性不育的奥秘,从而维护和促进人类生殖健康。
GSTs是一组具有多种生理功能的超基因家族酶系[3]。它能催化机体内有害极性化合物与谷胱甘肽相结合,还可由非酶结合方式将体内各种潜在毒性代谢产物、染料致癌剂及亲脂性化合物从体内排出,从而参与机体内抗氧化和保护细胞内许多物质合成、储存和转运的过程[4],因此GSTs在解毒功能上起着重要作用,是参与代谢外源性和内源性化学物质的重要酶系,与人体健康和疾病有着密切的关系[5],国外已经有研究显示GSTM1和GSTT1基因多态性和男性特发性不育症有密切联系[6]。GSTs分布较广,几乎广泛存在于人体所有的细胞和组织,尤其在生殖腺中表达较高,许多外源性诱导剂或损伤性刺激均可引起细胞内GSTs异常表达[7]。由于GSTs同工酶亚型种类的多样化,所以分类也较复杂,目前研究最多的是GSTT1和GSTM1基因多态,因为这两个基因都存在纯合性缺失这一多态现象[8],GSTM1和GSTT1基因缺失可导致相应酶活性降低或无结合活性。
本研究发现,实验组与对照组GSTM1和GSTT1基因多态性进行比较,实验组GSTM1基因及GSTM1+GSTT1组合的缺失型基因均高于对照组(58.7%∶33.3%,45.3%∶19.4%),差异有统计学意义(P<0.05),说明GSTM1与壮族人群少精症患者有着密切的联系。需要强调的是与男性不育的相关基因很多,而且这些基因并不是单独起作用的,而是与其他基因一起对男性生殖系统发挥作用,有研究显示:组合基因缺失对DNA的生物学影响比单个的基因变异大[5],因此在研究男性不育相关基因时,我们也应该着眼于多基因研究。从本试验结果可以看出,GSTT1基因在两组间的比较并无统计学意义(P=0.56),但是GSTT1+GSTM1基因组合其缺失型在壮族人群少精症患者中出现频率却较高,差异有统计学意义(P<0.05),说明GSTT1和GSTM1一起,与壮族人群少精症患者可能也有一定的关系。正常人受到有毒化学物质的刺激后,GSTM1和GSTT1表达增高,起到解毒作用,以免细胞受损。正是由于GSTM1和GSTT1在体内物质代谢中有很重要的作用,当GSTM1和GSTT1基因发生突变或缺失时,体内的有毒物质代谢将受影响,与生殖系统相关的一些有毒物质将得不到及时的降解和排出,在体内蓄积到一定程度后即可通过氧化应激等作用危害男性生殖器官的功能,影响生精过程,使精子数目下降、畸形率上升、精子活动力下降、卵子受精率下降等,从而引起不育。GST在人群中存在遗传多态性,多态性包括基因的完全或部分缺失,可以导致GSTT1及GSTM1蛋白的酶活性丢失。这种多态性与人体对环境中毒性物质的解毒能力相关,从而影响到个体对疾病的易感性,影响精子的成熟和精液的质量。这一点可因不同的种族、地域而存在相应的差异[9]。
精液主要由精子和精浆两部分组成。研究发现,精液中的代谢产物如氧自由基、二氧化碳、组胺等会影响到精子的成熟及运动[10]。而GSTM1和GSTT1则是参与代谢外源性和内源性化学物质的重要酶系,当其缺乏时,精液中的代谢物的转化将受影响,氧化过程中对机体有害的产物聚集,从而影响到精子的成熟与质量。大量的研究表明[11],精液内存在大量有毒代谢产物可以使睾丸的精子发生减退,引起精子凝集。其活性产物(蛋白酶、细胞因子等)通过精子膜过氧化等机制对精子的形态结构和功能造成损害而影响生育力,例如畸形精子比例增加、尖头精子和尾部畸形精子显著增加等。
由本研究结果可以看出:精细胞GSTM1基因和GSTT1+GSTM1基因多态性与壮族男性少精症有着较为密切的联系。但由于人类生殖的复杂性,尽管对男性不育的研究已经有了大量的临床和实验基础的积累,人类对自身生殖的了解仍然非常有限,人类生殖还有很多未解之谜。相信随着医学科学的发展,很多谜底都将被揭开,特别是随着人类基因组测序的完成和功能基因组计划的开展,为研究男性不育的基因机制及它对睾丸、附睾功能的影响提供了条件,男性不育的机制和诊治终将会得到解决。
2 Gaspari L,Pedotti P,Bonafe M et al.Metabolic gene polymorphisms and p53mutations in healthy centenarians and younger controls[J].Biomarkers,2003;8(6):522-528.
3 Van der Logt E M,Bergevoet S M,Roelofs H M et al.Genetic polymorphisms in UDP-glucuronosyltransferases and glutathione S-transferases and colorectal cancer risk[J].Carcinogenesis,2004;25(12):2407-2415.
4 Patel B P,Rawal U M,Rawal R M et al.Tobacco,antioxidant enzymes,oxidative stress and genetic susceptibility in oral cancer[J].Am J Clin Oncol,2008;31(5):454-459.
5 陈文成,潘尚领,林伟雄 et al.巴马县长寿老年人代谢相关基因及抑癌基因的多态性研究[J].中华老年医学杂志,2008;27(4):281-282.
6 Finotti A C,Costa E Silva R C,Bordin B M et al.Glutathione S-transferase M1 and T1 polymorphism in men with idiopathic infertility[J].Genet Mol Res,2009;8(3):1093-1098.
7 李苏平,吴建中,丁建华 et al.GSTM1、GSTT1基因多态性和饮酒习惯与原发性肝癌发生的危险性[J].实用癌症杂志,2004;19(3):229-232.
8 Kondo S,Sturgis E M,Li F et al.GSTM1 and GSTT1 null polymorphisms and risk of salivary gland carcinoma[J].Int J Clin Exp Med,2009;2(1):68-75.
9 韩艳波,冯向先,李佩珍.CYP1A1、GSTM1基因多态性与食管癌遗传易感性[J].中国公共卫生,2005;21(1):3-6.
10 Lanzafame F M,La Vignera S,Vicari E et al.Oxidative stress and medical antioxidant treatment in male infertility[J].Reprod Biomed Online,2009;19(5):638-659.
11 Miki K.Energy metabolism and sperm function[J].Soc Reprod Fertil Suppl,2007;65:309-325.

