中国经采供血HIV感染长期不进展者CD4+T淋巴细胞趋化因子受体表达研究①
张子宁 尚 红 姜拥军 王亚男 张 韩晓旭 施万英 李革飞 金 鑫
(中国医科大学附属第一医院卫生部艾滋病免疫学重点实验室,沈阳 110001)
目前,艾滋病仍无治愈的方法,疫苗的研发多以失败告终,原因之一在于未能阐明病毒与人体免疫系统相互作用的复杂性。HIV感染后,90%的HIV感染者经8~10年进入艾滋病期,疾病呈现典型进展状态。但5%~10%的HIV感染者,虽然感染时间已超过10年,未经高效抗逆转录病毒(Highly active anti-retroviral therapy,HAART)治疗,CD4+T细胞数却仍为正常,免疫功能接近于正常状态,被称为长期不进展者(Long-term non progressors,LTNP)[1]。目前长期不进展者的保护机制仍未彻底阐明,对这一人群的研究对于明确HIV的致病机制及人体抗感染免疫应答至关重要,可为艾滋病的疫苗设计及治疗提供重要靶点。
HIV感染需要细胞表达CD4分子及趋化因子受体,趋化因子受体或其配体的基因突变CCR2-641、SDF1-3′A和CCR5A32可保护宿主,延缓病程的发展[1]。国外及我们的前期研究显示,CD4+T细胞趋化因子受体的表达水平同样与艾滋病疾病进程相关,感染HIV后CD4+T细胞趋化因子受体CCR5表达水平增加,而CXCR4表达水平下降[2,3],但外周血CD4+T细胞趋化因子受体表达水平是否与HIV感染长期不进展状态有关尚无报道。静息细胞主要表达CXCR4,活化细胞则主要表达CCR5,我国经采供血HIV感染长期不进展者趋化因子受体表达是否与免疫活化状态有关,目前尚未见报道。我国经采供血传播的感染者与经性、吸毒等感染者相比,感染时间相对明确,可准确定义长期不进展者。本研究通过对河南、吉林等地经采供血感染,病毒亚型均为B′的44例长期不进展者进行了研究,并与相同感染途径的无症状HIV感染者、艾滋病人进行对比,对CD4+T淋巴细胞趋化因子受体表达与疾病进展的关系进行了探讨。
1 材料与方法
1.1 研究对象 165例未经抗病毒治疗的HIV/AIDS患者来自中国河南、吉林、辽宁省,感染途径均为既往有偿采全血和/或单采血浆,经本实验室病毒序列分析病毒亚型均为B′,未接受抗病毒治疗。依据感染时间、CD4+T细胞数量及临床症状将HIV感染者进行分期:长期不进展组(LTNP)感染时间大于10年,CD4+T细胞>500个/μ l,无艾滋病指征性症状;无症状HIV感染组(HIV)CD4+T细胞介于200~500个/μ l之间,无艾滋病指征性症状;艾滋病组(acquired immunodeficiency syndrome,AIDS),CD4+T细胞<200个/μ l或出现艾滋病指征性症状。依据上述分期标准,本研究病例中长期不进展组43例,HIV组82例,AIDS组35例。未暴露于HIV的健康对照40例。四组年龄、性别经One Way ANOVA或卡方检验比较后均无差异。研究对象一般状况及基本病毒学、免疫学状况见表1。
1.2 实验设备及试剂 主要实验设备及试剂均购自美国BD公司,包括流式细胞仪(FACSCalibur),EDTA抗凝管,绝对计数管,TriTEST CD4FITC/CD8PE/CD3PerCP抗体,单克隆抗体:FITC标记的抗CD4和抗 CD8单抗、PE标记的抗 CD38、抗CCR5和抗CXCR4单抗及PerCP标记的抗CD3、抗HLA-DR单抗。
1.3 CD4+T细胞趋化因子受体及淋巴细胞活化水平检测 FACSCalibur流式细胞仪检测研究对象全血T淋巴细胞活化(HLA-DR、CD38)及CCR5、CXCR4表达情况。应用以下FITC/PE/PerCP标记单抗组合进行染色:CD4/CCR5/CD3;CD4/CXCR4/CD3;CD4/CD38/HLA-DR;CD8/CD38/HLA-DR。室温孵育 30分钟,加入溶血素3ml,室温孵育8分钟,1200 r/min离心5分钟,弃上清。加入2 ml PBS悬浮,室温,1 200 r/min离心5分钟,洗涤两次。加入1%多聚甲醛的 PBS 200 μ l悬浮,FACS CELLQuest软件进行检测分析。
1.4 CD4+T细胞绝对值及病毒载量检测 CD4绝对值采用单平台法应用BD公司FACSCalibur流式细胞仪MultiSET软件检测。病毒载量采用RT-PCR方法,用美国Roche公司的COBAS AMPLICOR自动载量仪测定病毒载量。
表1 HIV/AIDS患者一般状况及基本病毒学、免疫学状况(±s)Tab.1 Clinical and immunological characteristics of included subjects(±s)
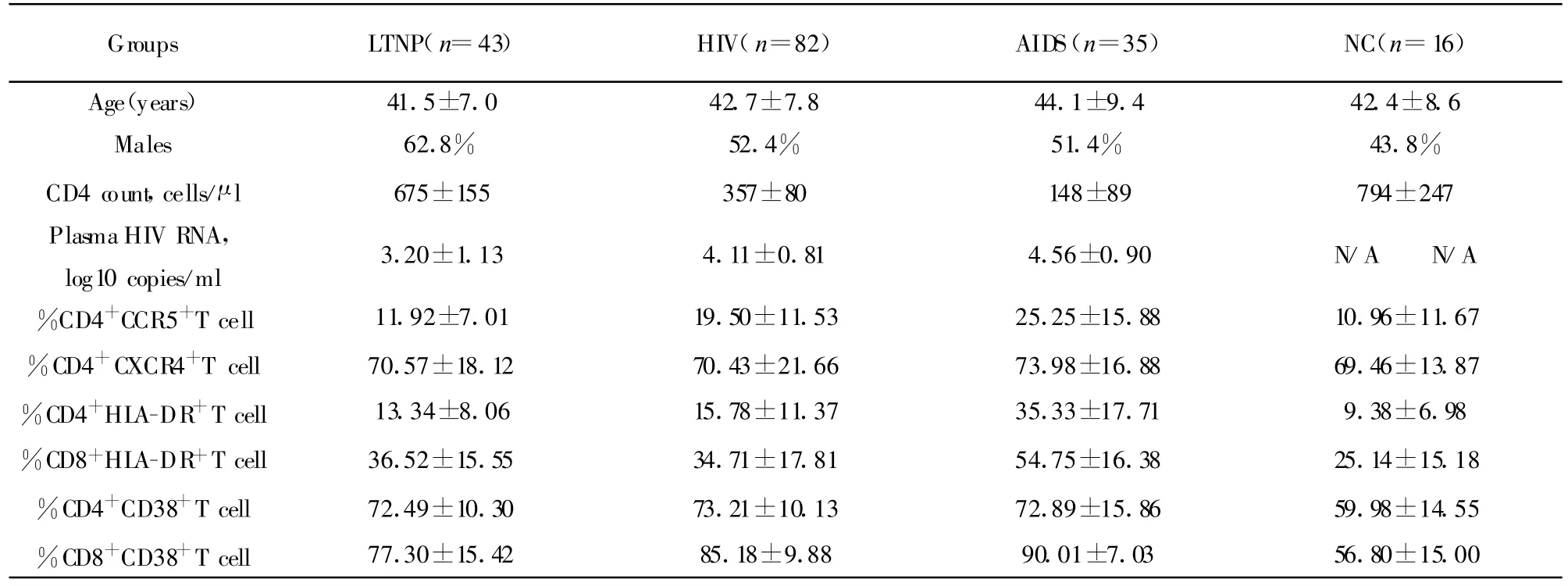
表1 HIV/AIDS患者一般状况及基本病毒学、免疫学状况(±s)Tab.1 Clinical and immunological characteristics of included subjects(±s)
Groups LTNP(n=43) HIV(n=82) AIDS(n=35) NC(n=16)Age(years) 41.5±7.0 42.7±7.8 44.1±9.4 42.4±8.6 Males 62.8% 52.4% 51.4% 43.8%CD4 count,cells/μ l 675±155 357±80 148±89 794±247 Plasma HIV RNA,log10 copies/ml 3.20±1.13 4.11±0.81 4.56±0.90 N/A N/A%CD4+CCR5+T cell 11.92±7.01 19.50±11.53 25.25±15.88 10.96±11.67%CD4+CXCR4+T cell 70.57±18.12 70.43±21.66 73.98±16.88 69.46±13.87%CD4+HLA-DR+T cell 13.34±8.06 15.78±11.37 35.33±17.71 9.38±6.98%CD8+HLA-DR+T cell 36.52±15.55 34.71±17.81 54.75±16.38 25.14±15.18%CD4+CD38+T cell 72.49±10.30 73.21±10.13 72.89±15.86 59.98±14.55%CD8+CD38+T cell 77.30±15.42 85.18±9.88 90.01±7.03 56.80±15.00
1.5 流式细胞仪分析 用于三色荧光标记法流式细胞术测定的激发光为氩离子激光488 nm谱线,使用前向散射角(FSC)及侧向散射角(SSC)确定淋巴细胞群,再分别以CD4+、CD8+T淋巴细胞为门,分析CD4+、CD8+T淋巴细胞表面活化分子HLA-DR、CD38的表达。CCR5、CXCR4表达:用FSC及SSC 确定淋巴细胞群,以CD3+T淋巴细胞为门,分析CD4+T淋巴细胞表面CCR5、CXCR4的表达。
1.6 统计学分析 用SPSS13.0软件包对资料进行方差分析,全部数据用±s表示。各组间数据的比较采用ONE-ANOVA方法比较,用Spearman相关分析趋化因子受体CCR5、CXCR4表达与病毒载量、CD4+T淋巴细胞数量、T淋巴细胞活化(HLA-DR、CD38)的相关性。P<0.05为有统计学意义。
2 结果
2.1 HIV感染长期不进展者CD4+T淋巴细胞趋化因子受体表达水平 用流式细胞仪方法检测HIV感染者及健康对照趋化因子受体表达水平,发现LTNP组CD4+T细胞表面CCR5的表达明显低于HIV组及AIDS组(P<0.01),与健康对照无显著差异;CD4+T细胞表面CXCR4的表达 LTNP组、HIV组、AIDS组无显著差异。数据见图1。结果显示,LTNP组CD4+T细胞CCR5表达水平要低于典型进展的HIV及AIDS组,维持正常水平。
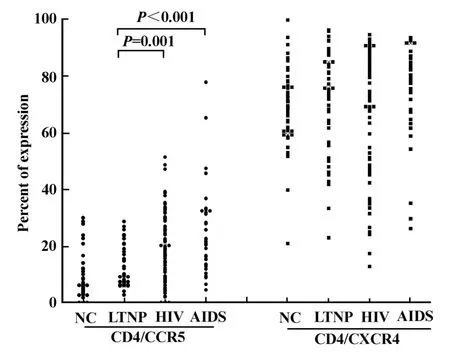
图1 HIV感染长期不进展者CD4+T淋巴细胞趋化因子受体表达水平Fig.1 Chemokine receptor expression on CD4+T cells in HIV infected long term nonprogressors
2.2 HIV感染长期不进展者T淋巴细胞活化水平
淋巴细胞活化可影响趋化因子受体表达水平,我们对HIV感染者淋巴细胞活化水平进行了分析,发现LTNP组 HLA、CD38在 CD4、CD8+T细胞的表达低于HIV组及AIDS组,高于健康对照,其中除CD38在CD4+T细胞的表达外,其余指标LTNP组均显著低于AIDS组(P<0.05);除HLA在CD4+T细胞的表达外,其余指标 LTNP组均显著高于健康对照(P<0.05);LTNP组与HIV组各活化指标间无显著差异,数据见表1。结果表明,感染HIV后,尽管LTNP组免疫活化水平较健康对照升高,仍低于HIV及AIDS组。
2.3 HIV/AIDS患者CD4+T淋巴细胞趋化因子受体表达水平与CD4+T细胞、病毒载量及淋巴细胞活化的相关性 为探讨趋化因子受体表达是否与疾病进展及免疫活化水平相关,我们对上述指标之间的相关性进行了研究,结果显示 CD4+T细胞表面CCR5的表达与CD4+T细胞数量显著负相关(r=-0.498,P<0.05),与病毒载量无显著相关性。CXCR4的表达与CD4+T细胞数量、病毒载量无显著相关性。CD4+T细胞表面CCR5的表达与HLA、CD38在CD4、CD8+T细胞的表达水平显著正相关(P<0.001;HLACD4:r=0.428,HLACD8:r=0.266,CD38CD8:r=0.389),CD4+T细胞表面CXCR4的表达与HLA在CD4、CD8+T细胞的表达水平显著负相关(P<0.01;HLACD4:r=-0.268,HLACD8:r=-0.254)。结果表明,CD4+T细胞CCR5表达与疾病进展关系密切,其表达水平的变化与CD4+T细胞数量及免疫活化水平密切相关。
3 讨论
上世纪80年代及90年代早期,我国部分地区经非法单采血浆等途径造成艾滋病病毒在供血(卖血浆)员中的传播。截至目前,陈旧献血员中的多数感染者已进入发病期,但流行病学调查显示,部分感染者感染时间已超过10年,CD4+T细胞仍大于500个/μ l,成为HIV感染疾病长期不进展者。对这部分人群免疫学等因素的深入研究有助于明确其抗病毒的保护性因素,为HIV的疫苗设计及治疗提供线索。
趋化因子受体与配体结合后,可以引起粒细胞和单核巨噬细胞的定向迁移,对白细胞的活性及其功能的发挥有重要影响[4]。1996年,Feng等[5]发现部分趋化因子受体可作为HIV感染细胞的辅助受体,使其成为艾滋病防治的新靶点。HIV感染早期的病毒多应用趋化因子受体CCR5感染CD4+T细胞,晚期多应用CXCR4受体或两个受体均可应用,趋化因子受体的表达水平可通过影响HIV对靶细胞的易感性及致病能力等影响疾病进程[6]。CCR5和CXCR4作为主要的辅助受体,其表达水平、基因型等在决定CD4+T细胞易感性中发挥了重要作用[7]。以往研究显示,HIV感染后 CD4+T细胞CCR5表达升高,CXCR4表达降低[2],我们的前期研究也证实,我国HIV/AIDS患者CD4+T淋巴细胞表面CCR5的表达增高[3],但CD4+T细胞趋化因子受体在长期不进展者中的表达情况目前尚无报道。我们对经血HIV感染长期不进展者的研究中发现,长期不进展者CD4+T细胞表面CCR5的表达水平明显低于HIV组及AIDS组,与健康对照并无显著差异,表达水平与CD4+T细胞数量显著负相关,提示靶细胞低水平的CCR5表达与疾病长期不进展状态相关。国外研究显示,CD4+T细胞表面CCR5的密度越高,病毒载量越高,如细胞表面CCR5数量低于1万个,则该细胞对HIV-1的易感性明显降低[8],我们观察到的长期不进展者CD4+T细胞CCR5表达水平低可能通过降低靶细胞对病毒的易感性从而延缓疾病进展。我们并未发现长期不进展者CD4+T细胞CXCR4表达与典型进展者的差别,前期研究也未观察到典型进展者与健康对照这一指标的差异[3],提示靶细胞表面CCR5的表达在评价HIV感染者免疫状态及预测疾病进展等方面具有更重要作用。
国外研究显示,细胞活化水平是影响趋化因子受体表达的重要因素之一[2,7]。CCR5主要表达在活化的淋巴细胞表面,CXCR4主要表达在静息细胞表面。淋巴细胞活化可诱导表面活化标志物表达,其中HLA-DR作为经典的活化标志物,其增高与T细胞功能缺失相关,且随HIV疾病进展增高[9],CD38则表达在早期造血细胞表面,细胞成熟后消失,活化后再次表达,是HIV感染疾病进展的重要标志之一[10]。我们应用HLA-DR及CD38对淋巴细胞活化水平进行了研究,发现长期不进展者淋巴细胞活化水平高于健康对照,但明显低于典型进展者,CD4+T细胞表面CCR5的表达与T细胞活化水平显著正相关,焦艳梅等[11]亦发现中国HIV感染长期不进展者CD4+T细胞活化程度没有明显增高,提示长期不进展者CD4+T细胞CCR5表达水平较低与其低水平的细胞活化状态有关。我们还发现CD4+T细胞表面CXCR4的表达与活化水平显著负相关,提示随着HIV感染细胞活化水平的增加,静息细胞数量的下降将导致CXCR4表达水平的下降。
综上,我国经采供血感染HIV的长期不进展者CD4+T细胞表面趋化因子受体CCR5表达维持较低水平,与低水平的淋巴细胞活化相关,为探讨长期不进展者的保护机制,评价感染者免疫状态及预测疾病进展提供了有益数据。
1 Hogan C M,Hammer S M.Host determinants in HIV infection and disease.Part 1.Cellularand humoral immune responses[J].Ann InternMed,2001;(9 Pt1)134:761-776.
2 Ostrowski M A,Justement S J,Catanzaro A et al.Expression of chemokine receptors CXCR4 and CCR5 in HIV-1-infected and uninfected individuals[J].J Immunol,1998;161(6):3195-3201.
3 张子宁,尚 红,叶晓卉 et al.HIV/AIDS患者CCR5、CXCR4的表达与疾病进展的关系[J].中华微生物学和免疫学杂志,2003;23(11):895-897.
4 Kinter A,Arthos J,Cicala C et al.Chemokines,cytokines and HIV:a complex network of interactions that influence HIV pathogenesis[J].Immunol,2000;177(1):88-98.
5 FengY,Broder C C,Kennedey P E et al.HIV-1 entry cofactor:functional cDNA cloning of a seven-transmembrane G protein-coupled receptor[J].Science,1996;272(5263):872-879.
6 Baribaud F,Doms R W.The impact of chemokine receptor conformational heterogeneity on HIV infection[J].Cell Mol Biol,2001;47(4):653-660.
7 Giovannetti A,Ensoli F,Mazzetta F et al.CCR5 and CXCR4 chmokine receptor expression and β-chemokine production during early T cell repopulation induced by highly active anti-retroviral therapy[J].Clin Exp Immunol,1999;118(1):87-94.
8 Lin Y L,Metting C,Portales P et al.Cell surface CCR5 density determines the postentry efficiency of R5 HIV-1 infection[J].Proc Natl Acad Sce USA,2002;99(24):15590-15595.
9 Peakman M,Mahalingam M,Pozniak A et al. Marker s of immune cell activation and disease progression.Cell activation in HIV disease[J].Adv Exp Med Biol,1995;374:17-26.
10 Savarino A,Bottarel F,Malavasi F et al.Role of CD38 in HIV-1 infection:an epiphenomenon of T-cell activation or an active player in virus/host interactions?[J].AIDS,2000;14(9):1079-1089.
11 焦艳梅,福军亮,张 政 et al.CD4+T淋巴细胞的活化在HIV-1感染长期非进展者及典型进展者之间差异的研究[J].中华实验和临床病毒学杂志,2007;21(1):11-13.

