松弛素对高糖环境心脏成纤维细胞胶原基因表达的影响
王 萍,李虹伟,王宇朋,张 盼,陈 晖,马文英
松弛素(relaxin,RLX)是1926年 Hisaw从怀孕的猪黄体细胞中提取出的妊娠相关激素。生物体内多种组织细胞均可以合成和分泌RLX,黄体和前列腺是RLX生成的主要部位。非生殖系统,如大脑、胃肠道及心房、心室[1]也发现有RLX、RLX前体或RLX样活性物质的存在。近年大量实验资料显示:RLX对多种组织器官(包括心脏)的纤维化都具有防治作用,可能是机体内源性抗纤维化因子。RLX能够抑制高血压大鼠的心肌纤维化;形成心肌纤维化的β2肾上腺素受体转基因小鼠[1],接受RLX治疗 2周,成纤维细胞的增殖显著受到抑制,心脏胶原含量显著下降。RLX能够抑制受前纤维化因子,如血管紧张素Ⅱ(AngⅡ)作用的心脏成纤维细胞的增殖和活化。RLX拮抗心肌纤维化有一定的优点:起效迅速;剂量依赖;对正常组织没有影响。
近年来大量研究发现,独立于高血压、冠心病和其他心脏基础疾病外,糖尿病导致心脏结构和功能的改变。即使不同时存在高血压、动脉粥样硬化,糖尿病患者心力衰竭的发生率较高[2,3]。此外,糖尿病是多种心脏病的高危因素,而且如果心脏基础病合并糖尿病,其预后更差。糖尿病动物发生心肌梗死后生存率更低,左室重塑及心肌纤维化、心肌细胞的凋亡更严重[4,5]。心肌纤维化是导致糖尿病心脏损害的主要病理过程之一,心肌纤维化表现为胶原大量沉积,增加了心室壁的僵硬度,降低了心室顺应性,导致心室收缩及舒张功能不全。
高血糖是糖尿病的主要病理表现。高血糖本身及其上调前纤维化因子-AngⅡ[6,7],转化生长因子β1(transforming growth factor,TGFβ1)[8]等的表达都可以导致心脏成纤维细胞数目和心肌间质胶原成分的增多,即导致心肌纤维化。笔者推论,重组人松弛素(recombinant human relaxin,rhRLX)能够抑制或延缓、逆转高血糖引起的心肌纤维化。为了证实这一推论,本研究进行相关的体外实验。此外,在心血管病理状态下,心脏也有RLX的表达和释放。已有研究显示,心力衰竭患者血浆和心脏局部 RLX表达增加,并且和心力衰竭的程度呈正相关[9]。自发性高血压大鼠心脏RLXmRNA和蛋白水平显著升高[10]。在异丙肾上腺素诱导的大鼠心肌缺血损伤模型中,心脏和血浆中RLX水平明显升高[11]。这些研究结果提示在病理条件下,RLX的表达发生变化。因此,本研究额外观察高血糖是否可以导致RLX表达的变化。
1 材料和方法
1.1 实验材料 出生1~3d的Sprague-Dawley大鼠,雌雄不限,由维通利华实验动物技术公司提供;rhRLX购自美国R﹠D公司;胎牛血清购自美国Gibco公司;T rizol Reagen购自美国Invitrogen公司;抗鼠波形蛋白单克隆一抗、即用型 SABC免疫组化染色试剂盒、DAB显色试剂盒购自武汉博士德生物工程有限公司;胰蛋白酶购自美国Amresco公司;引物由北京奥科生物公司合成和纯化。
1.2 实验方法 (1)心脏成纤维细胞的分离和培养:在无菌条件下取乳鼠心脏,用0.25%的胰酶消化心肌组织,差速贴壁60 min,获得心脏成纤维细胞,用含DMEM+10%胎牛血清+谷胺酰胺+双抗的培养液培养心脏成纤维细胞。通过细胞形态学和波形蛋白免疫组化染色鉴定心脏成纤维细胞,心脏成纤维细胞的纯度为95%。传代细胞用0.125%胰酶消化。以二代至四代心脏成纤维细胞为研究对象。(2)实验分组:正常糖(normal glucose,NG)组:DMEM内含5.6 mmol/L D-葡萄糖的DMEM。NG+rhRLX组:DMEM 内含5.6 mmol/L D-葡萄糖+100 μ g/L的rhRLX。高糖(high glucose,HG)组:DMEM 内含25 mmol/L D-葡萄糖。HG+rhRLX组:DMEM内含25 mmol/L D-葡萄糖+100 μ g/L的rhRLX。OSM组:DMEM培养液内含5.6 mmol/L D-葡萄糖+19.4 mmol/L甘露糖。(3)RT-PCR:①RT-PCR步骤:提取总RNA。紫外分光法确定RNA的量和纯度。逆转录反应合成单链cDNA。mRNA逆转录成cDNA程序:37℃保温60 min,95℃5 min,以灭活反转录酶,4℃1~5 min,可迅速放入-80℃长期冻存。RTPCR 体系 :cDNA 2 μ l;10 ×Buffer 2.5 μ l;dNTPs(10 mmol/L)0.5 μ l;正向引物(20 μ mol/L)0.25 μ l;反向引物(20 μ mol/L)0.25 μ l;Taq 酶(2 ×106U/L)0.5 μ l;ddH2O 19 μ l。所有RT-PCR的扩增体系相同。②引物序列:β-actin引物序列(349bp):正向引物:GAAATCGTGCGTGACATTA;反向引物:TAGGAGCCAGGGCAGTAA。Pro-collagenⅠ引物序列(196bp):正向引物 5'-T TCACCTACAGCACGCTTGT-3';反向引物:5'-T TGGGATGGAGGGAGT TTAC-3'。Pro-collagenⅢ引物序列(201bp):正向引物 F5'-T TGAATA TCAAACACGCAAGGC-3';反 向 引 物 5'-GGTCACT T T CACTGGT TGACGA-3'。relaxin-1引物序列(213bp):正向引物5'-CGT TGAGCGATTCCGT TGT-3';反向引物 R5'-CTCCGTATCAGCAGAGTT TAGC-3'。
取 PCR扩增产物10 μ l置于1.5%琼脂糖中电泳(电压80 V,电流40 mA,电泳时间60 min)。将电泳完毕的琼脂糖凝胶置于紫外成像扫描仪上观察并照相。用图像分析软件进行分析,分别用Procollagen Ⅰ/β-actin、Pro-collagenⅢ/β-actin 、RLX-1/β-actin灰度值表示mRNA的表达量。
1.3 统计学方法 应用SPSS11.5统计软件包进行统计分析。所有计量资料数据以±s表示。多组资料比较采用方差分析(one-way ANOVA),组间差异用SNK检验。P<0.05为差异有统计学意义。
2 mRNA表达结果
如图1和图2所示,与NG组比较,HG组Ⅰ型前胶原mRNA和Ⅲ型前胶原mRNA的表达均明显增加(P<0.01);OSM组和NG组与HG组比较,Ⅰ型前胶原mRNA的表达和Ⅲ型前胶原 mRNA均没有明显差别(P>0.05);HG+rhRLX组Ⅰ型前胶原mRNA和Ⅲ型前胶原mRNA的表达均明显减少(P<0.01)。

如图3和表1所示,HG组RLX-1 mRNA的表达明显强于NG组(P>0.05)。
3 讨 论
心脏成纤维细胞是一种在细胞外基质内能自由移动的多潜能细胞,能合成胶原等细胞外基质成分,心脏成纤维细胞的增殖和(或)胶原蛋白合成分泌的“过度”增加是纤维化发生的细胞生物学基础。
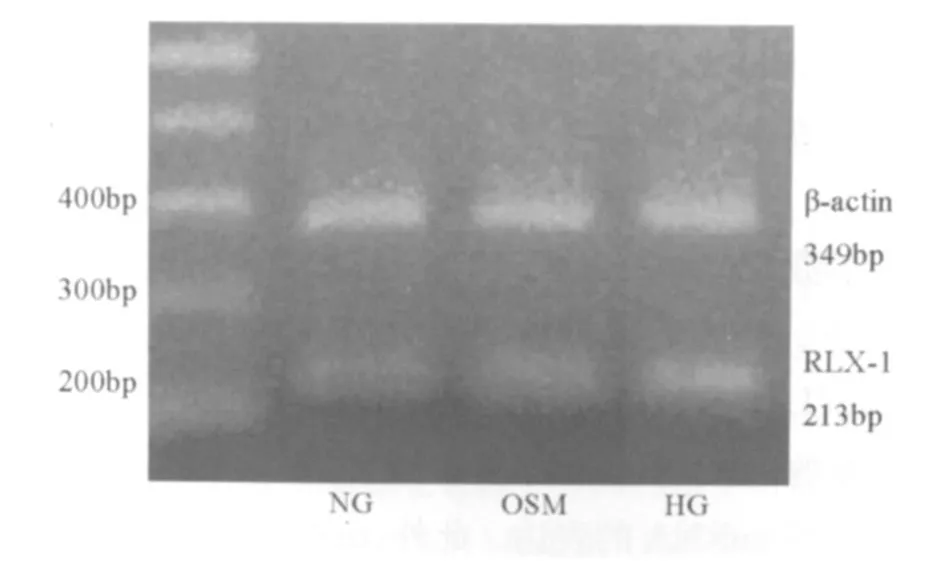
图3 各组RLX-1 mRNA的电泳图(n=3)
在心肌细胞外间质中,Ⅰ型和Ⅲ型胶原占主要部分。Ⅰ型胶原占胶原总量的85%,具有较大张力,但伸展回缩性小,主要聚合成粗纤维网,其多少决定着心脏的僵硬度;Ⅲ型胶原占11%,具有较大伸展回弹性,主要形成细纤维网,与室壁弹性有关。它们的适当比值对维持心肌组织结构及心脏功能的完整性具有重要意义。心肌胶原合成分为细胞内前胶原合成和细胞外前胶原转化聚合成胶原纤维的两个阶段,前胶原需在蛋白水解酶的作用下裂解氨基和羧基末端才能发生构型改变,形成胶原纤维的相互交联和三螺旋结构。大多数研究都发现高糖增加Ⅰ型胶原的合成[12],对Ⅲ型胶原的研究较少。本研究观察高糖对Ⅰ型胶原和Ⅲ型胶原合成的影响。HG组Ⅰ型前胶原mRNA的表达明显高于NG组,HG组Ⅲ型前胶原mRNA表达明显高于NG组。提示高糖增加成纤维细胞内Ⅰ型和Ⅲ型前胶原的表达,此外,高糖对Ⅰ型胶原纤维形成的促进作用比对Ⅲ型胶原纤维形成的促进作用强。本研究结果表明,OSM组Ⅰ型和Ⅲ型前胶原的表达与NG组比较没有差异,这说明高糖促进的Ⅰ型和Ⅲ型前胶原的表达是由于高糖浓度导致的,而不是高渗透压引起的。
本研究中NG+rhRLX组Ⅰ型前胶原 mRNA和Ⅲ型前胶原mRNA的表达都比NG组明显,提示在转录水平100 μ g/L rhRLX可能是促进前胶原的表达;另外,有研究显示给予低剂量rhRLX(使血清浓度维持20 μ g/L)的雌性和雄性大鼠心输出量增加和外周血管阻力降低,但高剂量rhRLX(血清浓度达80 μ g/L)不改变动物心输出量和外周血管阻力,表明血管对 rhRLX呈剂量依赖的双向反应[12,13]。雌性大鼠妊娠期间RLX的血浓度是50~100 μ g/L,本研究中 rhRLX 的作用浓度是100 μ g/L,其他浓度的rhRLX可能抑制Ⅰ型前胶原mRNA和Ⅲ型前胶原mRNA的表达。此外,rhRLX能够完全抑制高糖引起的Ⅲ型前胶原mRNA的表达上调,但不能完全抑制高糖引起的Ⅰ型前胶原mRNA的表达上调调。这提示高糖对不同类型胶原合成的促进作用是通过不同机制实现的,rhRLX对高糖环境促进Ⅲ型胶原表达的机制能够完全拮抗。在Samuel等[1]的研究中,未发现乳鼠心脏成纤维细胞RLX-1 mRNA的表达。本研究发现,NG环境下培养的乳鼠心脏成纤维细胞RLX-1 mRNA的表达很微弱。HG促进心脏成纤维细胞RLX-1 mRNA的表达,提示在一定的病理条件下(糖尿病)心脏成纤维细胞能够产生RLX。
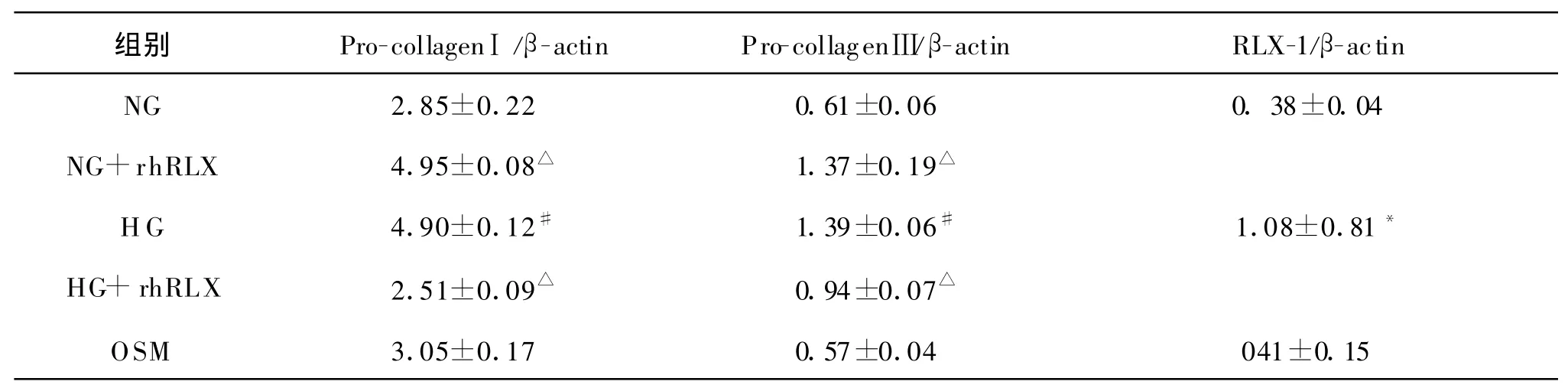
表1 各组Pro-collagenⅠ,Pro-collagenⅢ,RLX-1 mRNA的比较(n=3)
结论:人rhRLX能够抑制高糖环境下心脏成纤维细胞胶原的合成。高糖能够促进内源性RLX的表达。
[1]Samuel CS,Unemori EN,Mookerjee I,et al.Relaxin modulates cardiac fibroblast proliferation,differentiation,and collagen production and reverses cardiac fibrosis in vivo[J].Endocrinology,2004,145(9):4125-4133.
[2]Hamby RI,Zoneraich S,Sherman L.Diabetic cardiomyopathy[J].JAMA,1974,229(13):1749-1754.
[3]Wold LE,Relling DP,Colligan PB,et al.Characterization of contractile function in diabetic hypertensive cardiomyopathy in adult rat ventricular myocytes[J].J Mol Cell Cardiol,2001,33(9):1719-1726.
[4]Shiomi T,Tsutsui H,Ikeuchi M,et al.Streptozotocin-induced hyperglycemia exacerbates left ventricular remodeling and failure after experimental myocardial infarction[J].J Am Coll Cardiol,2003,42(1):165-172.
[5]Backlund T,Palojoki E,Saraste A,et al.Sustained cardiomyocyte apoptosis and left ventricular remodelling after myocardial infarction in experimental diabetes[J].Diabetologia,2004,47(2):325-330.
[6]Fiordaliso F,Li B,Latini R,et al.Myocyte death in streptozotocin-induced diabetes in ratsin angiotensin II-dependent[J].Lab Invest,2000,80(4):513-527.
[7]Asbun J,Manso AM,Villarreal FJ.Profibrotic influence of high glucose concentration on cardiac fibroblast functions:effects of losartan and vitamin E[J].Am J PhysiolHeart Circ Physiol, 2005, 288(1):H227-H234.
[8]Way KJ,Isshiki K,Suzuma K,et al.Expression of connective tissue growth factor is increased in injured myocardium associated with protein kinase C beta 2 activation and diabetes[J].Diabetes,2002,51(9):2709-2718.
[9]Dschietzig T,Richter C,Bartsch C,et al.The pregnancy hormone relaxin is a player in human heart failure[J].FASEB J,2001,15(12):2187-2195.
[10]Lekgabe ED,Kiriazis H,Zhao C,et al.Relaxin reverses cardiac and renal fibrosis in spontaneously hypertensive rats[J].Hypertension,2005,46(2):412-418.
[11]Zhang J,Qi YF,Geng B,et al.Effect of relaxin on myocardial ischemia injury induced by isoproterenol[J].Peptides,2005,26(9):1632-1639.
[12]Debrah DO,Conrad KP,Danielson LA,et al.Effects of relaxin on systemic arterial hemodynamics and mechanical properties in conscious rats:sex dependency and dose response[J].J Appl Physiol,2005,98(3):1013-1020.
[13]Debrah DO,Conrad KP,Novak J,et al.Recombinant human relaxin(rhRLX)modifies systemic arterial properties in conscious rats irrespective of gender,but in a biphasic fashion[J].Ann N Y Acad Sci,2005,1041:155-162.

