强化胰岛素治疗老年脓毒症114例临床分析
颜默磊,严 静,蔡国龙,龚仕金,张召才,虞意华,戴海文
脓毒症是感染引起的一种严重的全身炎症反应综合征,病情进一步发展可导致多器官功能障碍综合征,是临床危重病死亡主要原因之一 。国外报道,脓毒症发病率以每年1.5% ~9%速度增长,严重脓毒症死亡率高达30%~50%[1,2],降低脓毒症导致的死亡是临床医师面临的共同难题。脓毒症患者血糖升高不仅是疾病严重程度的标志,也是影响预后的一个重要因素[3,4]。而老年患者本身常已经合并糖尿病或胰岛素抵抗,一旦发生脓毒症更容易出现血糖的进一步升高,进而导致内环境紊乱、血管内皮损伤及脏器功能失代偿。外源性胰岛素具有抑制脓毒血症时炎性介质释放及纠正应激性高血糖、改善心肌功能的作用,在此理论基础上提出的强化胰岛素治疗是指相对传统危重病患者血糖水平的正常化(10.0~11.1 mmol/L而言)将血糖控制在4.4~8.3 mmol/L范围,以进一步控制脓毒症患者的高血糖及相关的胰岛素抵抗,进而逆转脓毒症的病理生理环节。本研究通过对114例老年脓毒症患者随机分组后分别进行强化胰岛素治疗和常规胰岛素治疗,并对两组的相关临床终点事件发生率进行比较,来探讨强化胰岛素治疗老年脓毒症患者的临床疗效。
1 资料与方法
1.1 研究对象 2005年6月到2008年6月入住浙江医院重症监护室(ICU)、符合2001年国际脓毒症定义会议[5]脓毒症诊断标准"的老年患者114例。入选标准:(1)年龄≥60岁;(2)符合sepsis诊断标准;(3)APACHEⅡ评分≥12分或MODS评分≥5分。排除标准:(1)肿瘤患者;(2)治疗未超过24 h死亡或出院;(3)对胰岛素过敏者。按照随机原则分为研究组:血糖控制目标值4.4~8.3 mmol/L,对照组:血糖控制目标值10.0~11.1 mmol/L。前者59例,后者55例。两组患者的年龄、性别、感染部位、基础疾病、有无糖尿病以及APACHEⅡ评分差异均无显著性(P均>0.05),有可比性(表1)。
1.2 研究方法 研究组按照强化胰岛素治疗方案(图1),用微量泵静注胰岛素,使血糖维持在(4.4~8.3 mmol/L)。本方案由护士执行。采用人重组胰岛素-优泌林。血糖>13.9 mmol/L时暂不用营养支持。营养支持方案:热卡摄入20~25 kcal/(kg·d)(糖∶脂=2∶1),氮量摄入0.18~0.22 kcal/(kg·d),测定采用床边快速血糖法。对照组按照经验应用微量泵静注胰岛素,每4 h检测血糖一次,使血糖维持在10.0~11.1 mmol/L)。
表1 两组老年脓毒症患者的基线资料±s)
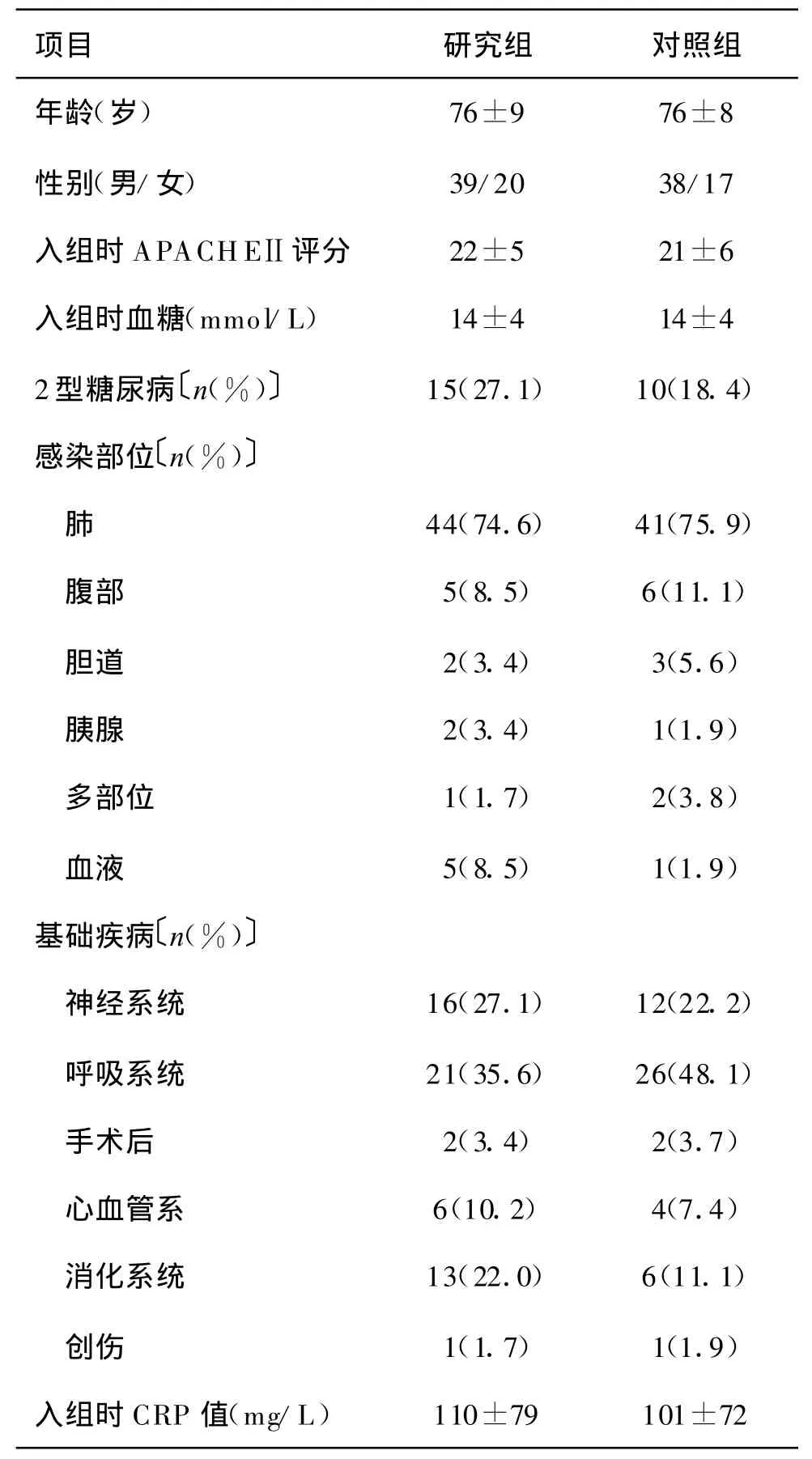
表1 两组老年脓毒症患者的基线资料±s)
注:CRP:C反应蛋白。与对照组比较,均P>0.05
项目 研究组 对照组年龄(岁) 76±9 76±8性别(男/女) 39/20 38/17入组时APACHEⅡ评分 22±5 21±6入组时血糖(mmol/L) 14±4 14±4 2型糖尿病〔n(%)〕 15(27.1) 10(18.4)感染部位〔n(%)〕肺44(74.6) 41(75.9)腹部 5(8.5) 6(11.1)胆道 2(3.4) 3(5.6)胰腺 2(3.4) 1(1.9)多部位 1(1.7) 2(3.8)血液 5(8.5) 1(1.9)基础疾病〔n(%)〕神经系统 16(27.1) 12(22.2)呼吸系统 21(35.6) 26(48.1)手术后 2(3.4) 2(3.7)心血管系 6(10.2) 4(7.4)消化系统 13(22.0) 6(11.1)创伤 1(1.7) 1(1.9)入组时CRP值(mg/L) 110±79 101±72
1.3 研究指标 记录两组血糖达标情况,胰岛素用量,监测血清C反应蛋白水平变化、抗生素应用时间、院内新发感染发生率、血管活性药物应用量、机械通气天数、需要血液净化治疗的急性肾衰竭的发生率、入住ICU天数、死亡率、28 d生存率等指标。并记录低血糖(包括严重低血糖、低血糖昏迷,低血糖指血糖浓度<3.0 mmol/L,严重低血糖指血糖水平<2.0 mmol/L)的发生情况,
1.4 统计学分析 采用SPSS13.0统计软件进行分析。计量资料以±s表示,组间比较用t检验,计数资料比较用χ2检验。P<0.05为差异有统计学意义。
2 结 果

图1 老年脓毒症患者强化胰岛素治疗方案

表2 两组胰岛素治疗老年脓毒症的疗效比较
两组的达标率及达标所用的胰岛素用量无统计学差异(表2)。与常规组比较,研究组老年危重病患者的C反应蛋白水平、抗生素应用时间、院内新发感染发生率、血管活性药物应用量、需要血液净化治疗的急性肾衰竭的发生率显著降低,28d生存率提高,差异有统计学意义;机械通气天数和住ICU天数无明显统计学差别(表2)。低血糖发生例数:研究组41例(占69.5%),对照组15例(占27.3%),P值为0.00。严重低血糖例数:研究组15例(占25.4%),对照组4例(占7.3%),P值为0.00。低血糖昏迷例数:研究组3例(占5.1%),对照组1例(占1.8%),P值为0.35,无统计学差异。
3 讨 论
有研究发现,脓毒症伴发的应激性高血糖不仅导致机体分解代谢增加,负氮平衡,创口愈合不良及感染率增高,还严重影响机体内环境,增加患者的病死率[3,4],并且血糖持续高水平与危重病病情呈正相关[7]。而老年人常存在胰岛素抵抗,甚至已经合并糖尿病,一旦发生脓毒症更容易出现血糖的进一步升高。研究表明,创伤患者中60岁以上老年人与年轻人的高血糖发生率分别为38%比0[6]。老年危重病患者在遭受感染、创伤、严重的心脑肺和肾功能不全等疾病的打击下出现糖代谢改变,糖的生成率超过糖的清除率是出现应激性高血糖的主要原因;其他因素包括胰岛素反应不足和胰岛素抵抗。目前尚不明确对老年脓毒症患者血糖控制的最佳范围和胰岛素用量[8]。
本研究发现,与对照组比较,研究组老年脓毒症患者的 C反应蛋白水平 、抗生素应用时间、院内新发感染发生率、血管活性药物应用量、需要血液净化治疗的急性肾衰竭的发生率显著降低,28 d生存率提高。Van-Den Berghe等[9]研究显示,应用胰岛素强化降糖治疗严格控制血糖24 h,维持在正常水平(4.1~6.1 mmol/L),危重患者死亡率明显降低,即使运用于无糖尿病危重患者,对限制器官损伤也有所帮助。而两项研究观察了患者平均血糖水平与死亡率、多发性神经病变、急性肾功能衰竭、院内获得性菌血症及输液量的关系,提出降低患者死亡率的血糖阈值介于8.0~10.0 mmol/L[10,11],与本研究结果一致。胰岛素强化治疗是控制应激性高血糖简单有效的手段,能在短时间内行之有效地将糖降至正常水平;胰岛素作为体内重要的促合成激素,能够纠正危重病患者的高分解状态和负氮平衡,促合成代谢,增加骨骼肌重量,并促进损伤组织的修复[12];另外,研究显示胰岛素在体内具有抗炎效应,如拮抗肿瘤坏死因子-α、白细胞介素-6作用,拮抗巨噬细胞阻滞因子作用等[13],胰岛素强化治疗可拮抗全身炎症反应综合征患者高炎症状态,具有抗炎效应,这可能是改善老年脓毒症患者预后的又一重要机制。值得注意的是,本研究中研究组和对照组在血糖达标率和胰岛素用量方面均无显著性差异,说明血糖水平本身的降低而不是胰岛素用量的增加改善了患者的预后,这与既往的研究结果也一致[11]。
本研究还发现,研究组低血糖发生率有所增高。以往亦有研究显示,与传统治疗相比,在内科ICU中使用Leuven方案强化胰岛素治疗,患者发生低血糖的风险增加约3倍(18%vs 6.2%)[9,14]。一项大样本观察性研究(7049例)发现,降低平均血糖水平与减少血糖波动同样重要[15]。
综上所述,对于老年脓毒症患者,强化胰岛素治疗能更及时有效地控制血糖,并显著改善临床疗效。
[1]Shapiro N,Howell MD,Bates DW,et al.The association of sepsis syndrome and organ dysfunction with mortality in emergency department patients with suspected infection[J].Ann Emerg Med,2006,48(5):583-590.
[2]Kleinpell RM,Graves BT,Ackerman M H.Incidence,pathogenesis,and management of sepsis:an overview[J].AACN Adv Crit Care,2006,17(4):385-393.
[3]Yendamuri S,Fulda GJ,Tinkoff GH.Admission hyperglycemia as a prognostic indicator in trauma[J].J T rauma,2003,55(1):33-38.
[4]Laird AM,Miller PR,Kilgo PD,et al.Relationship of early hyperglycemia to mortality in trauma patients[J].J Trauma,2004,56(5):1058-1062.
[5]Levy MM,Fink MP,Marshall JC,et al.2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J].Crit CareMed,2003,31(4):1250-1256.
[6]Frankenfield D,Cooney RN,Smith JS,et al.Age-related differences in the metabolic response to injury[J].J Trauma,2000,48(1):49-56.
[7]Umpierrez GE,Isaacs SD,Bazargan N,et al.Hyperglycemia:an independent marker of in-hospital mortality in patients with undiagnosed diabetes[J].J Clin Endocrinol Metab,2002,87(3):978-982.
[8]Wilson M,Wwinreb J,Hoo GW.Intensive insulin therapy in critical care:a review of 12 protocols[J].Diabetes Care,2007,30(4):1005-1011.
[9]Van-Den-Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in the critically ill patients[J].N Engl J Med,2001,345(19):1359-1367.
[10]Finney SJ,Zekveld C,Elia A,et al.Glucose control and mortality in critically ill patients[J].JAMA,2003,290(15):2041-2047.
[11]Krinsley JS.Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients[J].Mayo Clin Proc,2003,78(12):1471-1478.
[12]M adibally SV,Solomon V,Mitchell RN,et al.Influence of insulin therapy on burn wound healing in rats[J].J Surg Res,2003,109(2):92-100.
[13]Das UN.Is insulin an antiinflammatory molecule[J].Nutrition,2001,17(5):409-413.
[14]Van-Den-Berghe G,Wilmer A,Hermans G,et al.Intensive insulin therapy in the medical ICU[J].N Engl J Med,2006,354(5):449-461.
[15]Egi M,Bellomo R,Stachowski E,et al.Variability of blood glucose concentration and short-term mortality in critically ill patients[J].Anesthesiology,2006,105(2):244-252.

