FHIT基因的MSI、LOH及甲基化修饰与胃癌关系的研究*
胡宏波,贾安平,刘振鹏,郑 玲,梁秀兰,冯 金,詹前美
(广西壮族自治区柳州市柳铁中心医院:1.检验科;2.消化内科,广西柳州545007)
脆性组氨酸三联体(fragile histidine triad,FHIT)基因是抑癌基因,位于人类染色体3p14.2上,其cDNA由 10个外显子组成,外显子5~9组成一长约500 bp的开放性阅读框,编码一个由147个氨基酸组成的相对分子质量为16.8 kd的蛋白质。该基因表达蛋白参与一系列的细胞进程,包括对细胞周期调控、细胞凋亡和微管活动的调节以及二腺苷三磷酸(AP3A)的水解等[1]。该基因内含FRA3B脆性位点,易断裂,断裂后使该基因失活,引起细胞异常增生,最终导致肿瘤的发生。本研究对胃癌FHIT基因遗传学和表观遗传学的改变进行检测,探讨FHIT基因的异常改变在胃癌的发生和发展中的作用。
1 资料与方法
1.1 一般资料 2006年1月至2009年10月本院腔镜中心胃镜检查并经病理证实为胃癌的患者74例,男46例,女28例,年龄36~87岁,平均58.5岁;所有患者均取病变组织和正常胃黏膜组织各一份,样本离体后30 min内均迅速放置于-80℃冰箱中。临床病理学分期采用国际抗癌联盟1997修订的TNM分期标准,其中Ⅰ期 19例,Ⅱ期13例,Ⅲ期 22例,Ⅳ期20例。Lauren分型:肠型28例,弥漫型33例,混合型13例。
1.2 研究方法
1.2.1 基因组DNA提取 参照大连TaKaRa公司试剂盒说明书进行,提取产物用美国Bio-Rad公司SmartSpec plus核酸测定仪检测DNA的浓度和纯度,如OD260/OD280在1.6~1.8则置于-20℃的冰箱备用。
1.2.2 FHIT基因微卫星不稳定(MSI)和杂合性缺失(LOH)分析 利用聚合酶链反应(PCR)扩增微卫星标记D3S1300,D3S1300引物和扩增参数见表1。PCR反应体系的构成:Taq酶 0.5 μ L,模板 DNA 2.5 ng,上游引物(20 μ mol/L)1 μ L,下游引 物(20 μ mol/L)1 μ L,GC Buffer I 25 uL,dNTP(含Mg2+)8μL,灭菌蒸馏水加至 50 μ L。PCR产物行3%琼脂糖电泳(80 V,120 min),结果经美国Bio-Rad公司Gel DocTMXR凝胶成像系统进行分析。非变性聚丙烯酰胺凝胶电泳(Native-PAGE)采用美国Bio-Rad公司Mini P-4垂直凝胶电泳系统。配制8%聚丙烯酰胺凝胶:30%的丙烯酰胺4 mL、5×TBE 3 mL 、10%过硫酸胺 0.11 mL、T EMED 10 μ L,加ddH2O至总体积15 mL。灌胶并插好梳子,待胶凝固移去样品梳后,加入1×TBE于上下两电泳槽内,用1×TBE冲洗加样孔,样品点样(10 μ L 扩增产物与 2 μ L 6×DNA Loading Buffer混合),60 V电压进行电泳,观察溴酚蓝完全泳出凝胶时结束。将凝胶小心剥入0.5μ g/mL EB溶液中,室温染色30 min,用ddH2O冲洗凝胶 2次,将凝胶移至 Bio-Rad凝胶成像仪下照相,保存。结果判断:选择基因组DNA等位片段表现为杂合子者进行LOH分析,纯合子则为无信息个体。与正常胃黏膜组织相比,癌组织PCR扩增产物出现等位基因条带的增多或位置的移动判定为 MSI,条带消失或相对密度减少50%以上判定为LOH。
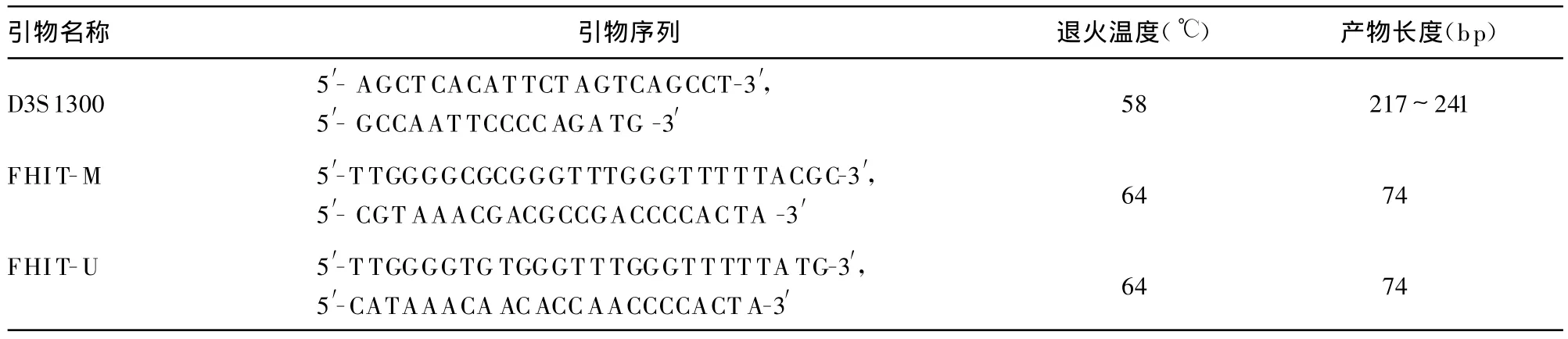
表1 FHIT基因引物和扩增参数
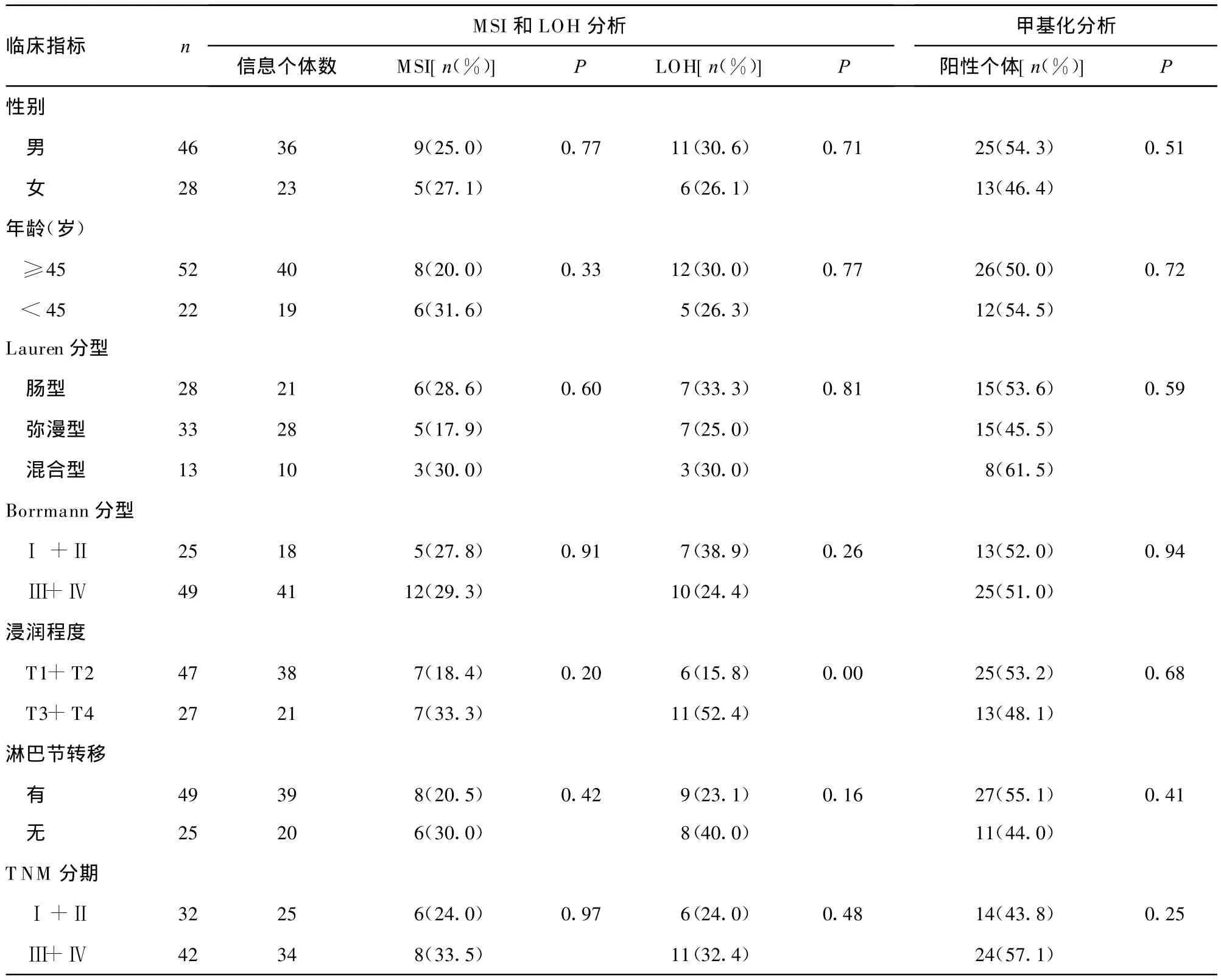
表2 FHIT基因MSI和LOH及甲基化修饰与胃癌临床指标的关系
1.2.3 甲基化特异性PCR(MSP-PCR)甲基化修饰参照美国Epigentek公司产品说明书进行;将已修饰的DNA分别用甲基化特异性引物和非甲基化特异性引物进行PCR扩增。FHIT基因引物设计参照文献[2],引物和扩增参数见表1。PCR反应体系构成、产物电泳及成像同1.2.2。将经电泳鉴定存在单一明亮目的条带的未纯化PCR产物各取 50 μ L,即FHIT-M和FHIT-U为引物的PCR产物各1管,送广西医科大学医学科学实验中心进行序列测定。
1.3 统计学处理 应用SPSS13.0统计分析软件进行χ2检验或者Fisher精确检验,相关性分析采用Spearman检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 FHIT基因MSI和 LOH 74例胃癌患者中,59例为提供信息的杂合子个体,其中MSI有14例,占 23.7%;LOH的有17例,占 28.8%,二者总和为 31例,占 52.5%(图 1)。FHIT基因MSI和LOH均与胃癌患者年龄、性别、Lauren分型、Borrmann分型、淋巴结转移以及 TNM 分期无关(P>0.05),但 LOH与浸润程度存在正相关(P<0.05),见表2。
2.2 FHIT基因的甲基化特异性 PCR(MSP)扩增结果 FHIT基因行MSP扩增后,产物经琼脂糖凝胶电泳得到约79 bp特征性片段,与预期的FHIT-M和FHIT-U为引物的目的片段大小相符,见图2。
2.3 FHIT基因的MSP扩增后的测序结果 甲基化片段所有CpG位点保持不变,非甲基化片段所有C变成T。两结果对比证实,有CpG二核苷酸存在于序列中则为甲基化的CpG,而在对应位置为TpG则为非甲基化的CpG。
2.4 FHIT基因甲基化状态 正常胃黏膜组织均为FHIT基因非甲基化,74例胃癌组织中FHIT基因甲基化阳性为38例,检出率为51.4%,其中完全甲基化9例。FHIT基因甲基化率在正常胃黏膜组织和胃癌组织中差异有统计学意义(P<0.05)。FHIT基因甲基化与胃癌患者年龄、性别、Lauren分型、Borrmann分型、浸润程度、淋巴结转移以及TNM 分期无关(P>0.05),见表2。
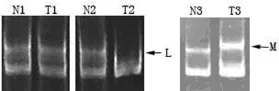
图1 D3S1300位点MSI和 LOH
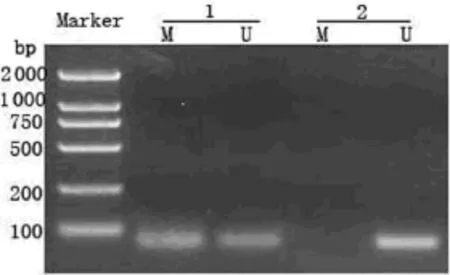
图2 胃癌组织FHIT基因的MSP分析
2.5 胃癌FHIT基因甲基化与MSI和LOH之间的关系 59例杂合子中共有27例发生甲基化,27例甲基化样品中8例MSI和9例 LOH,32例未甲基化样品中 6例 MSI和 7例LOH,甲基化与MSI和LOH均不存在明显相关性(P>0.05,r=0.12和0.13)。
3 讨 论
DNA错配修复系统(M MR)是指存在人类细胞中的一种修复DNA碱基错配的保障体系,其主要功能是修复DNA复制过程中产生的单碱基错配和2个以上的插入/缺失(IDLs)错配。当MM R出现不稳定性变化或功能缺陷时,与其连锁或相关的微卫星位点易发生MSI导致DNA序列的微妙变化和(或)LOH导致的染色体不稳定性,在胃癌组织中存在高频率的MSI和LOH,FHIT基因所在的染色体3p14.2区域的遗传改变频繁表达于胃癌和其他肿瘤[3]。有研究表明,FHIT基因启动子区CpG岛异常甲基化可导致表观遗传学沉默(epigenetic silencing),也是其主要失活方式之一,从而直接参与胃癌的发生[4]。
微卫星是具有高度多态性的短串联重复核苷酸序列,与同一个体正常组织相比,MSI是指在肿瘤组织基因组中微卫星简单重复序列的增加或丢失;LOH则是肿瘤组织的某个等位基因消失。有研究表明,抑癌基因MSI与LOH在肿瘤的多步骤发生过程中起着重要的作用[5]。作为FHIT基因的分子标志,微卫星标记D3S1300被认为是检测FHIT基因M SI和LOH的候选位点。Huiping等[6]的研究显示,FHIT基因该位点MSI发生率为27.1%(13/48);Lee等[7]报道FHIT基因该位点LOH发生率为21.2%(7/33);肖玉平等[8]检测了38例胃癌组织FHIT基因表达,结果在D3S1300位点MSI发生率为36.8%(14/38),LOH发生率为26.3%(10/38)。本研究显示,59例胃癌在 D3S1300位点的MSI发生率 23.7%(14/59),LOH发生率为28.8%(17/59),MSI发生率与肖玉平等的研究结果有一定差异,但其LOH发生率与及其他学者的研究结果较为接近。有学者对胃癌发生机制的研究时提出MSI和LOH是胃癌发生早期事件[9-10];Castagnaro等[11]对FHIT基因与肿瘤的关系研究中发现,FHII基因MSI多发生在预后较好的临床早期癌组织中,并认为MSI可作为早期分子诊断的标志。本文对FHIT基因的研究结果显示,MSI和LOH与胃癌患者年龄、性别、Lauren分型、Borrmann分型、淋巴结转移以及TNM分期无关,亦提示FHIT基因MSI可能用于胃癌的早期诊断;但随着胃癌逐渐向胃壁深部的浸润,FHIT基因LOH发生率增加,提示D3S1300位点 LOH多发生于胃癌晚期,并有促进浸润和远处转移的作用。因此,FHIT基因LOH检测可作为胃癌恶性程度、转移和预后判断的重要指标。
由FHIT基因启动子区高甲基化导致的表达静默被认为是引起胃癌发生的分子机制之一,并且已经在胃癌组织中得到了证实[4]。本研究的MSP结果显示,FHIT基因在正常胃黏膜组织均未出现甲基化阳性片段,但在74例胃癌组织中有38例发生甲基化,甲基化率为 51.4%,与 Leal等[12]的研究结果53.9%比较接近,但与文献[13-14]报道的FHIT基因62%和40%有一定差异,其原因可能与患者的遗传背景和实验方法的差异有关。甲基化与胃癌患者年龄、性别、Lauren分型、Borrmann分型、浸润程度、淋巴结转移以及TNM 分期无关,提示FHIT基因甲基化可能是胃癌发生的早期事件。本研究还对胃癌FHIT基因甲基化和MSI及LOH进行相关性分析,结果显示甲基化与后两者之间均无明显相关性,提示甲基化与后两者可能是通过不同的途径对胃癌的发生、发展起作用,而相互之间并无明显影响。
总之,FHIT基因失活机制除了以上三个方面,还可能涉及其他方面:染色体不稳定、基因转录异常致蛋白表达降低或缺失、纯合缺失、基因突变、表观遗传学的其他改变(如组蛋白乙酰化)等,FHIT基因结构或表达过程中的变化势必引起其功能的改变。因此进一步研究FHIT基因在胃癌组织中的其他变化,对确定FHIT基因与胃癌发生、发展的关系有着重要的意义。
[1]Pecherzewska R,Nawrot B.FHIT-tumor suppressor protein involved in induction of apoptosis and cell cycle regulation[J].Postepy Biochem,2009,55(1):66.
[2]Zöchbauer-Müller S,Fong KM,Maitra A,et al.5′CpG Island Methylation of the FHIT Gene Is Correlated with Loss of Gene Expression in Lung and Breast Cancer[J].Cancer Res,2001,61:3581.
[3]张生军,张才全.FHIT基因结构、功能及其应用研究进展[J].重庆医学,2004,33(9):1411.
[4]Leal MF,Lima EM,Silva PN,et al.Promoter hypermethylation of CDH1,FHIT,M TAP and PLAGL1 in gastric adenocarcinoma in individuals from Northern Brazil[J].World J Gastroenterol,2007,13(18):2568.
[5]Fukushima T,Takenoshita S.Colorectal carcinogenesis[J].Fukushima J Med Sci,2001,47(1):1.
[6]Huiping C,Kristjansdottir S,Bergthorsson JT,et al.High frequency ofLOH,MSI and abnormal expression of FHIT in gastric cancer[J].Eur J Cancer,2002,38(5):728.
[7]Lee SH,Kim WH,Kim HK,et al.Altered expression of the fragile histidine triad gene in primary gastric adenocarcinomas[J].Biochem Biophys Res Commun,2001,284(3):850.
[8]肖玉平,韩埩波,李锦毅,等.胃癌FHIT基因杂合性缺失及微卫星不稳定性的研究[J].中国医科大学学报,2006,35(2):122.
[9]Lee CL,Hsieh KS,Chen YL,et al.Identification of candidate genes for congenital ventricular septal defects with HSA22q11 loss of heterozygosity[J].Rev Esp Cardiol,2009,62(3):263.
[10]Perez RO,Jacob CE,D′Ottaviano FL,et al.Microsatellite instability in solitary and sporadic gastric cancer[J].Rev Hosp Clin Fac Med Sao Paulo,2004,59(5):279.
[11]Castagnaro A,Marangio E,Verduri A,et al.Microsatellite analysis of induced sputum DNA in patients with lung cancer in heavy smokers and in healthy subjects[J].Exp Lung Res,2007,33(6):289.
[12]Leal MF,Lima EM,Silva PN,et al.Promoter hypermethylation of CDH1,FHIT,M TAP and PLAGL1 in gastric adenocarcinoma in individuals from Northern Brazil[J].World J Gastroenterol,2007,13(18):2568.
[13]Roa JC,Anabaló n L,Roa I,et al.Promoter methylation profile in gastric cancer[J].Rev Med Chil,2005,133(8):874.
[14]戴观荣,景洪标,邓鉴文,等.FHIT基因在胃癌中的异常甲基化及其表达[J].第二军医大学学报,2005,26(11):1304.

