快速、准确鉴别产几丁质酶菌株的新方法
胡 晓, 张 敏, 刘彭强, 邓秋蕾, 舒 凯
(四川农业大学农学院植物病理系,雅安 625014)
使用几丁质平板法筛选具有几丁质酶活性的微生物时,因几丁质平板本身为乳白趋于透明色,而降解环也为透明色,不易观察到明显的抑菌圈,故不易筛选出几丁质降解菌,而且其准确性往往受到研究人员的影响,不同观察者可能得出不同的结论。
1977年,Hankin和Anagnostakis首次发现,生长在含有纤维素刚果红的琼脂培养基上的纤维素降解菌的菌落周围可产生降解环[1]。刚果红是一种染料,它可以与多糖物质形成红色复合物,但并不和降解后的纤维二糖和葡萄糖发生这种反应。根据此原理,当在含有纤维素的培养基中加入刚果红时,刚果红能与培养基中的纤维素形成红色复合物,当纤维素被纤维素酶分解后,刚果红-纤维素的复合物就无法形成,培养基中会出现以纤维素分解菌为中心的透明圈。纤维素刚果红培养基用于快速识别产纤维素酶菌株和初步判定酶活性高低,即产酶愈多,降解环愈大,产酶越快,降解环出现越早[2]。
几丁质可视为纤维素的类似物,它是通过β-1,4-糖苷键连接而成的不分支的2-乙酰氨基-2-脱氧-D-葡萄吡喃糖苷(N-乙酰氨基葡萄糖)的同聚物,相当于纤维素C-2位置上的羟基被乙酸氨基所置换。因此,作者推测它也能替代纤维素而与刚果红形成红色复合物,故可使用含刚果红的几丁质培养基来鉴别具有几丁质酶活性的菌株。该方法可能弥补通常采用的几丁质平板法鉴定含几丁质酶活微生物的缺点,有助于在微生物的分离中准确地检测到含有几丁质酶活性的菌株。
1 材料与方法
1.1 材料
菌株:由本实验室分离出具有几丁质酶活性的4株芽胞杆菌菌株,分别为Bacillus514、Bacillus132、Bacillus233、Bacillus515。
几丁质刚果红培养基(根据纤维素刚果红培养基改良):硫酸铵0.2%,硫酸镁0.05%,磷酸二氢钾0.1%,氯化钠0.05%,胶体几丁质3%,刚果红0.2%,琼脂1.5%~2%,p H7.0~7.2[3]。
几丁质培养基:硫酸铵0.2%,硫酸镁0.05%,磷酸二氢钾0.1%,氯化钠0.05%,胶体几丁质3%,琼脂1.5%~2%,p H7.0~7.2。
液体培养基:牛肉膏1%,蛋白胨1%,NaCl 0.5%,p H7.2。
牛肉膏蛋白胨培养基(NA):牛肉膏1%,蛋白胨1%,NaCl 0.5%,琼脂1.5%~2%,p H7.2。
产酶培养基:磷酸二氢钾0.1%,硫酸镁0.05%,胶体几丁质3%,氯化钠0.05%,磷酸钠0.2%,酵母膏1.0%。
刚果红0.1%染液:刚果红0.1%。(0.1 g刚果红溶于100 ML蒸馏水中)。
1.2 方法
1.2.1 菌株活化
将具有几丁质酶活性的菌株接种于NA斜面上活化。
1.2.2 菌株接种及降解环的观测
方法1:用接种环分别挑取4株少量菌体接种于几丁质培养基中央,32℃培养,每24 h取3皿用0.1%的刚果红染色,染色1 h后用蒸馏水冲洗干净,直到没有浮色为止,观测菌落周围的降解环,直至降解环不再扩大。
方法2:用接种环挑取少量菌体接种于含刚果红的几丁质培养基中央,32℃培养,每24 h取3皿观测1次,直至降解环不再扩大。
1.2.3 几丁质酶粗酶液的提取
在250 ML三角瓶内加入30 ML液体培养基,接一环菌种后于250 r/min、32℃摇床培养24 h,然后在250 ML三角瓶中加入25 ML产酶培养基,培养5 d后4 000 r/min离心20 min,上清液即为粗酶液,测定酶活性。
1.2.4 几丁质酶活力测定
按Joshi[4]方法进行。取0.6 ML粗酶液加到1.0 ML含1% 胶体几丁质的磷酸缓冲液(p H6.6)中,45℃保温30 min,加入1.5 ML 3,5-二硝基水杨酸试剂终止反应,并加热100℃,10 min,冰浴冷却,离心后取上清液在波长530 nm下测吸光度,计算产生的N-乙酰氨基葡萄糖(NAG)的量。
酶活单位定义:在上述条件下,每分钟产生相当于1μmol N-乙酰氨基葡萄糖的还原糖所需的酶量,定义为一个酶活力单位(U)。
1.2.5 统计方法
试验结果经过Excel 2003软件进行初步统计,几丁质平板中的降解环大小随时间的变化函数关系采用SPSS16.0中Nonlinear的对数曲线进行拟合。以p<0.05和p<0.01分别示差异的显著和极显著水平。
2 结果与分析
2.1 使用方法1对几丁质平板染色后观测到的降解环
如图1所示,图a、b、c分别是用方法1接种Bacillus515于几丁质平板,对其染色后形成的3个重复,形成的降解环直径大小差异不大,分别为3.6、3.7 cm和3.7 cm。图1d为未用0.1%的刚果红染液染色的几丁质平板,可以看出在菌落周围有一圈透明的降解环,但边界不清晰,极不易观察。图1e为用方法1染色的未接种平板,整个平板是均一的红色,未观察到有透明圈出现。
2.2 使用方法2在几丁质平板上观测到的降解环
如图2所示,图a、b、c分别是用方法2接种Bacillus515于几丁质平板,对其染色后形成的3个重复,形成的降解环直径大小差异不大,分别为3.6、3.8 cm和3.7 cm。图2e为用方法2染色的未接种的平板,整个平板是均一的红色,未观察到有透明圈出现。

图1 使用方法1染色形成的降解环

图2 使用方法2染色形成的降解环
2.3 降解环直径大小与培养时间的关系
由图3和图4可以看出,降解环的直径大小随着时间的增加符合微生物的对数生长规律,方法1的R2达到了0.952 2,方法2的R2达到了0.959 8,由此可以推测出,在对数生长期,营养充足,Bacillus515的生长速率快、代谢旺盛、酶系活跃、活细菌数和总细菌数大致接近、细胞的化学组成形态理化性质基本一致,随着细菌数量的增长,降解几丁质的物质的分泌也就越多,在42 h内细菌的增长速度较快,降解环迅速扩大,第3天后细菌分泌物的分泌变慢,降解环缓慢扩大,到了第7天,细菌分泌物达到了稳定状态,降解环的大小也就处于稳定状态。
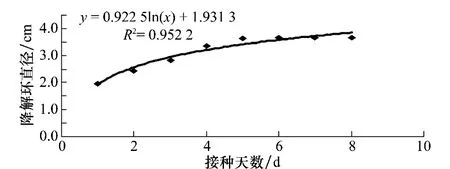
图3 使用方法1在不同时间形成的降解环直径
在方法1和方法2的比较中,方法1在第6天产生的降解环直径就达到了最大,而方法2在第7天产生的降解环直径达到最大,两者降解环达到最大直径的时间基本一致。

图4 使用方法2在不同时间形成的降解环直径
2.4 几丁质酶活性与降解环大小的关系
使用SPSS16.0软件对几丁质酶活性和降解环直径之间的关系进行相关性分析,其中,在p=0.010的条件下,其R=0.990,即相关性显著,故降解环的大小可反映酶活大小(表1)。
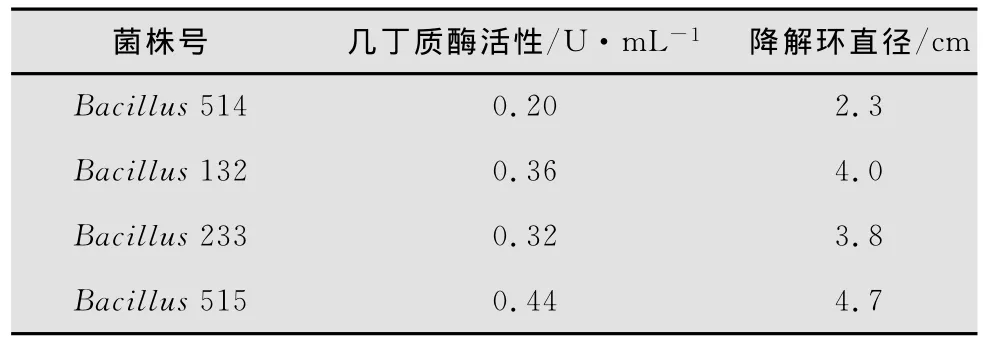
表1 菌株的几丁质酶活性及降解环大小
3 结论与讨论
直接利用微生物防治植物病害是传统生物防治的主要途径,其中几丁质酶的利用是生防的一个重要方向。对植物具有致病能力的真菌的细胞壁是由几丁质组成的,而具有几丁质酶活性的微生物通过降解真菌细胞壁从而起到防治真菌病害的作用。几丁质酶作为一种具有生物活性的物质,不仅可以用来抗真菌,同时对线虫、昆虫也具有一定的抗性[5]。因此,快速、有效地筛选具有几丁质酶活性的菌株具有重要的现实意义。
本文所开发的2种染色方法,具有可重复性,且2种方法形成的降解环的差异不大。在几丁质平板接种后第7天观测到菌株的分泌物形成降解环达到最大,与芽胞杆菌生长的对数曲线相一致,推测分泌出的分解几丁质的物质已不再增多,故第7天为最佳观测时期。2种方法对几丁质平板染色后观测到的降解环为浅红色,未降解部分为深红色,因此容易准确地观察;而未染色的几丁质平板整个平面呈乳白色,且降解环为透明色,因颜色相近而不易观测。因此,刚果红染色后的几丁质平板比未染色的平板能更好、更直观、更准确地观测到降解环。但在试验过程中,使用方法1也有不足,用蒸馏水冲去浮色时,易冲去菌苔而观察不全菌落形态,且不能继续培养菌株(因打开培养皿盖子而易受污染)来观察降解环的动态变化,而使用方法2不仅能清晰地观测到降解环,并能观察菌落的动态生长情况,因此使用方法2更为科学、准确。
根据 Wood的研究[6-8],推测形成浅红色的降解环的原因可能是:多糖类物质水解后形成大量含有β-1,4-D吡喃型葡萄糖、β-1,3-D葡聚糖及乳糖-葡甘露糖聚合糖等结构的物质,与刚果红染料结合形成大量的红色多聚糖-刚果红复合物,几丁质是2-氨基-2-脱氧-β-D-葡萄糖单元的共聚体,水解后与刚果红染料形成红色物质,而用具有几丁质酶活性的细菌降解几丁质后形成了葡萄糖,不能与刚果红染料形成红色物质,故在深红色的平板上形成了浅红色的降解环。
本试验证明被筛选菌的几丁质酶活性越强,几丁质刚果红平板的降解环也越大。因此,可以根据几丁质平板上降解环的大小来推测菌株的几丁质酶活性的大小,进而筛选出几丁质酶活性较强的菌株,这也为菌株的诱变改良提供了直观、准确的筛选方法,可通过此方法快速筛选出具有几丁质酶活性的细菌菌株。
这两种染色方法弥补了通常采用的几丁质平板法鉴定含几丁质酶活性芽胞杆菌的缺点,在芽胞杆菌的分离中能快速、有效地检测到几丁质酶活性菌株,为筛选具有几丁质酶活性的芽胞杆菌提供了新方法,但能否用于检测其他微生物几丁质酶活性还有待进一步证实。
[1]Hankin L,Anagnostakis S L.Solid mediuMcontaining carboxy methylcellulose to detect Cx cellulase activity of micro-organisms[J].Gen Microbiology,1977,98:109-105.
[2]刘起丽,张建新,徐瑞富.纤维素刚果红培养基筛选产纤维素酶菌株的影响因素研究[J].西北农业学报,2007,16(5):279-283.
[3]张宇昊,王颉,张伟,等.一种改进的纤维素分解菌鉴别培养基[J].纤维素科学与技术,2004,1(12):33-36.
[4]Joshi S,Kozlowshi M,Rishens S,et al.Chitinase and chitobiase production during fermentation of genetically improvedSerratialiquefaciens[J].Enzyme Microb Technol,1989,11(5):289-296.
[5]韩宝芹,余长缨,刘万顺,等.几丁质酶研究现状及展望[J].中国海洋药物杂志,2001(5):41-43.
[6]Wood P J,Fulcher R G.Interaction of some dyes with cereal β-glucans[J].Cereal Chem,1978,55:952-966.
[7]Wood P J.The interaction of direct dyes with water soluble substituted cellulose and cerealβ-glucans[J].Ind Eng CheMProd Res Dev,1980,19:19-23.
[8]Wood P J.Specificity in the interaction of direct dyes with polysaccharides[J].Carbohydr Res,1980,85:271-287.

