烯禾啶微囊粒剂的研制
葛艳蕊, 冯 薇, 吕均超, 崔海华, 孙淑巧
(1.河北科技大学化学与制药工程学院,石家庄 050018;2.河北医科大学西山校区临床部,石家庄 050200;3.河北正定县林业局,正定 050800)
烯禾啶(sethoxydim),商品名为拿捕净,化学名称:(±)2-[1-(乙氧亚氨基)丁基]-5-(2-乙硫基丙基)-3-羟基环己-2-烯酮,是一种具有内吸传导性的茎叶处理除草剂,广泛应用于大豆、花生、棉花、油菜等阔叶作物田防除禾本科杂草,具有安全、广谱、高效、低毒的优点[1]。烯禾啶传统剂型为20%乳油和12.5%的机油,含有大量有机溶剂如甲苯、二甲苯等,施用后导致每年千吨计有机溶剂排放到自然界中,造成资源的浪费和生态环境的污染。微胶囊(MC)是农药的一种新剂型,是利用微囊化技术把农药有效成分包覆在囊壁材料中形成的微小囊状制剂。目前已商品化的农药微胶囊有20多种,如国外Pennwalt公司生产的甲基对硫磷(penncap)、二嗪磷(knox-out 2FM)和Zoecon公司生产的烯虫酯(altosid SR-10)等[2]。国内已有对硫磷、辛硫磷、氯氰菊酯等农药的微囊化报道[3]。农药微囊化可减少有机溶剂的用量,降低环境污染,还可控制农药缓慢释放,延长持效期,提高制剂稳定性[4]。本文用原位聚合法以脲醛树脂为壁材制备烯禾啶微囊粒剂,采用差热-热重分析仪(DTA-TGA)测量微胶囊的缓释性能,利用高效液相色谱仪(HPLC)测定微胶囊的包封率,用扫描电子显微镜(SEM)测量微胶囊的结构及表面形态,用红外光谱仪(IR)对微胶囊的包覆情况进行表征,研究了单体量比、芯皮比、缩聚反应介质的pH等对微胶囊的缓释性、包封率和微胶囊结构的影响。
1 材料与方法
1.1 主要原料及仪器
烯禾啶原油(河北沧州科润化工有限公司提供);氢氧化钠、氯化铵、尿素、甲醛均为化学纯。LZJ-II高剪切混合乳化机(涟水电讯厂);OLYMPUS生物显微镜(日本);尼康—代福特倒置摄影显微镜(日本);JSM-35C扫描电子显微镜(日本);WATER 600高效液相色谱仪(美国);SDT-2960热分析仪(美国TA公司);FTS-130傅里叶红外光谱仪(美国)。
1.2 微胶囊的制备
称取适量烯禾啶原油溶于适量溶剂,加入蒸馏水和乳化剂,以8 000r/min的速度均质20min,形成O/W型乳状液;按照一定的质量比取尿素与37%的甲醛混合,调节pH 8,70℃下反应一定时间得黏稠透明尿素-甲醛预聚物,将其与乳状液混合,分批加入酸性催化剂,用显微镜观测到聚合物开始沉积到囊芯表面后,加热使之继续包覆并逐渐固化,当达到终点pH后保温1h,调节pH 7,冷却后离心、干燥,得到可自由流动的球型固体微胶囊。
1.3 烯禾啶微胶囊性能表征
微胶囊形态和粒径的测定 用生物显微镜监测微胶囊化全过程,随时观察微胶囊的形态;用扫描电子显微镜测量微胶囊的结构、表面形态和粒径大小。
微胶囊包封率的测定 用高效液相色谱仪测定烯禾啶微胶囊的包封率[5],准确称取烯禾啶微胶囊干燥样品0.05g(精确至0.000 2g),加到适量二氯甲烷中,超声波细胞破碎机破囊,再用二氯甲烷定容至100mL,高效液相色谱法测定烯禾啶的质量分数。色谱条件:内填4μm硅胶填料的色谱柱(150mm×3.9mm);流动相二氯甲烷+环己烷=70+30;流量0.8mL/min;柱温为室温;检测波长283nm;进样量5μL。微胶囊的包封率φ计算公式如下:

微胶囊缓释性能的表征 用SDT-2960热分析仪对试样进行热重分析,可测得试样的缓释性[6]。升温速率为10℃/min。试验的温度范围为室温~350℃,试样质量为(2.5±0.2)mg,流动氮气气氛40mL/min。通过对比微胶囊的热重曲线,说明微囊囊芯的缓释性能。
微胶囊的红外表征 通过对比烯禾啶原药和微胶囊的红外光谱图,表征烯禾啶的包覆情况。
2 结果与讨论
2.1 尿素-甲醛量比(U/F)对微胶囊结构和缓释性能的影响
尿素与甲醛的量比不同,对烯禾啶微胶囊的结构和缓释性均有影响。在其他条件不变的情况下,分别合成了3种不同U/F的烯禾啶微胶囊试样,进行热失重对比试验,结果见图1,从图1看出,U/F=1∶1时,在50~80℃范围,微胶囊热失重急剧,失重曲线斜率较大,说明囊芯在此温段受热挥发较快。这是由于在尿素、甲醛的预聚反应阶段,反应介质pH=7~8时,尿素与甲醛反应可得一羟甲基脲或二羟甲基脲,当U/F=1∶1时,产物多为一羟甲基脲,一羟甲基脲相互反应,只能得到直线状的聚亚甲基脲:

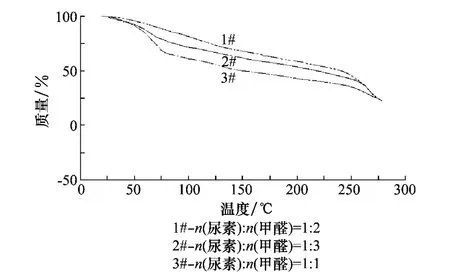
图1 不同U/F的MC热失重对比图
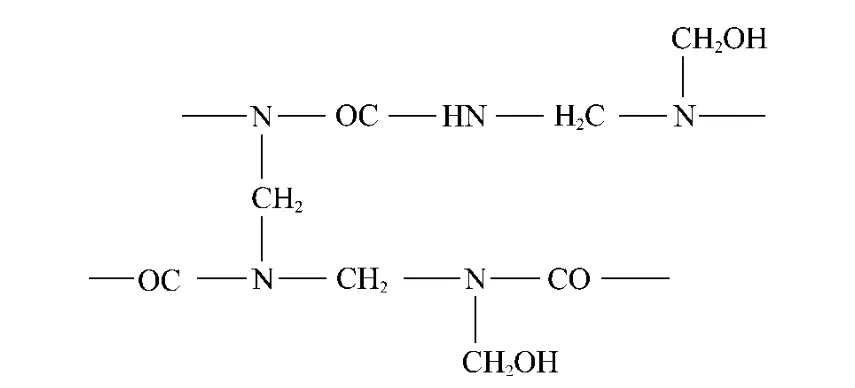
用此预聚物包覆囊芯,微胶囊产品量少,且结构松散,囊芯是通过高分子交联网眼向外扩散缓释的,结构较松散的微胶囊壁材对囊芯的扩散阻力较低,微胶囊的释放速率增大,缓释性较差;当U∶F=1∶2.0时,参与反应的甲醛量多,一部分一羟甲基脲可与多余的甲醛再反应,生成二羟甲基脲和少量的三羟甲基脲,其分子中存在较多的游离羟甲基、亚氨基等活性基团,分子间脱水可形成水溶性的线型或支链型相对低分子质量物,它们继续缩聚最后得到由羟甲基和亚氨基反应形成的亚甲基的体形网状结构:
参与反应的甲醛量多,生成的二羟甲基脲亦多,交联度亦高,固化后微胶囊结构紧密,图2为微胶囊的SEM图,可以发现微胶囊呈球形颗粒,表面光滑无孔,说明包埋较完全,囊芯物质的释放将主要依赖于高分子的网状结构和高分子链的柔性伸展,微胶囊热失重曲线斜率变化缓慢(图1),说明芯材释放缓慢,微胶囊的缓释性较强。当U∶F=1∶3时,产品中未反应的游离甲醛含量过大,微胶囊固化后收缩性大,致使微胶囊表面出现凹陷甚至开裂,导致其缓释性降低。因此,选择尿素甲醛量比 U∶F=1∶2较好。
2.2 芯皮比对MC包封率及缓释性能的影响
在烯禾啶微囊化过程中,芯皮比直接影响了微囊的包封率及缓释性。作者在相同的工艺条件下,分别合成了4种不同芯皮比的微囊粒剂,其包封率情况见图3。当m(烯禾啶)∶m(尿素+甲醛)=1∶0.5时,发现聚合结束后,反应体系表面浮有一层油滴,表明包埋不彻底,存在有未被包覆的芯材,壁材存在较大的孔隙,产品经测试,包封率为39.1%,烯禾啶受热后很快由孔隙挥发,故其热失重曲线前期失重急剧,缓释性较差(图4);当m(烯禾啶)∶m(尿素+甲醛)=1∶2时,微胶囊的包封率较低为23.8%,热失重缓慢,缓释性较好,从图3和图4可以看出芯皮比为1∶1.5的样品,包封率较高为30.6%,缓释性较好,所以,选定芯皮比为1∶1.5。

图2 表面结构紧密的烯禾啶微囊的SEM图
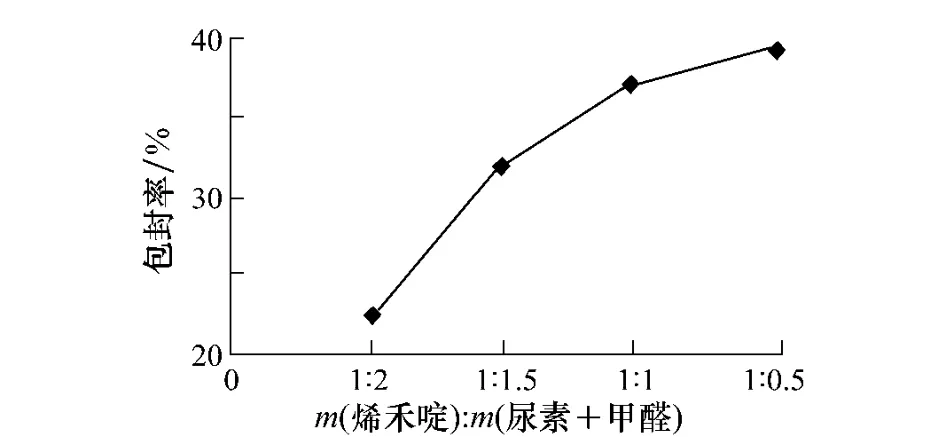
图3 不同芯皮比对MC包封率的影响
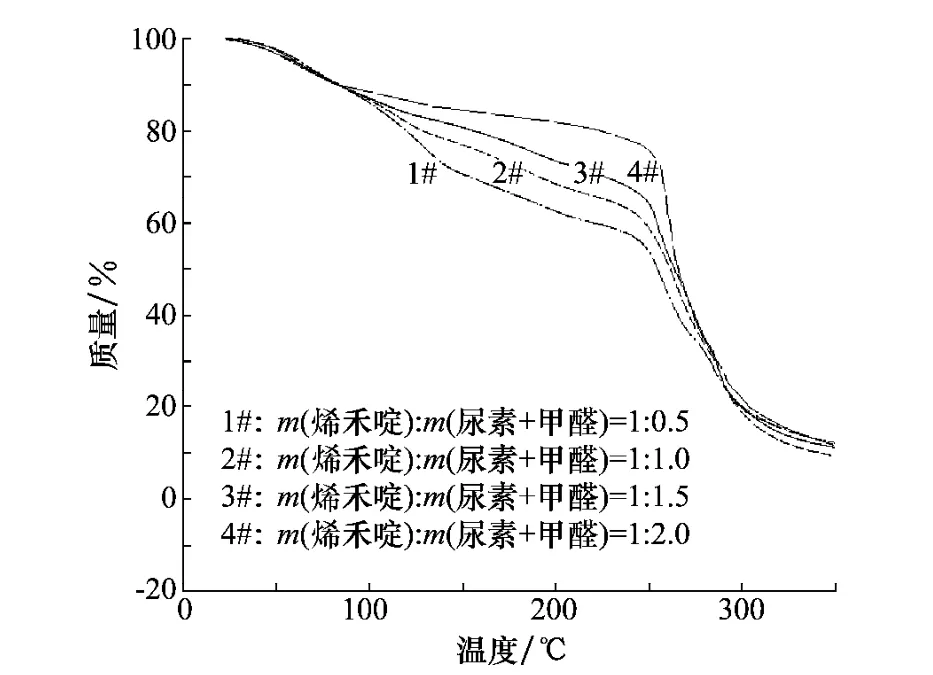
图4 不同芯皮比微胶囊的热失重曲线图
2.3 缩聚反应终点pH对MC结构的影响
由尿素和甲醛在一定pH下生成的一羟甲脲和二羟甲脲脱水而形成的水溶性线性低分子预聚体,由于分子中存在游离羟甲基、氨基、亚氨基等活性基团,在酸性条件下易于进行缩聚反应,有利于分子链的增长和交联网状结构的形成。若在碱性条件下反应,羟甲基之间不直接反应形成亚甲基键,而主要形成二亚甲基醚键,降低了活性基团的活性,致使反应速度相当慢。不同缩聚终点pH对微胶囊结构的影响见表1。试验表明,终点pH越低,三维网状结构越趋紧密,形成的微胶囊越坚固。若终点pH大于5,则形成的微胶囊结构较松散,见图5;控制终点pH在3.0以下,形成的微胶囊结构紧密,如图2所示。终点pH太低,烯禾啶在强酸环境中会部分酸解,影响药效,故选用终点pH为3.0。

图5 表面结构松散的SEM图

表1 缩聚反应终点pH对MC结构的影响
2.4 烯禾啶微胶囊的红外表征
图6为烯禾啶的红外光谱图。由图6看出烯禾啶具有的特征峰包括:C=O与C=C呈共轭形成的在1 640cm-1~1 590cm-1处强的吸收峰,C=N-在1 690cm-1~1 640cm-1处形成尖锐的吸收峰。图7为脲醛树脂烯禾啶微囊粒剂的红外光谱图。从图7看出,在2 969cm-1处是CH伸缩振动的吸收,1 644cm-1处是酰胺键中CO的伸缩振动的强吸收峰,1 552cm-1处是酰胺键中CN伸缩振动的吸收峰,3 332cm-1处是NH和OH伸缩振动的吸收峰,但在1 053cm-1处OH的特征峰较弱,说明树脂中OH较少,由此可知,3 332cm-1处主要是NH的吸收峰。由2 969、3 332、1 644、1 552cm-1处的4个峰可以确定微胶囊脲醛树脂囊壁已经形成,反应单体中甲醛略微过量,故第1步加成反应产物应主要是二羟甲基脲,所以羟甲基含量少,说明树脂有很大程度的交联。而在1 150~1 060cm-1处没有强吸收峰,说明交联链中没有醚键。从图7可以看到烯禾啶的特征峰减弱。综合以上分析可以说明脲醛树脂有较高的交联度,并已经包覆了烯禾啶。

图6 烯禾啶农药的红外光谱图
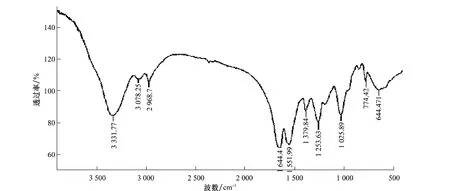
图7 脲醛树脂烯禾啶微囊的红外光谱图
3 结论
用原位聚合法制备脲醛树脂烯禾啶微囊粒剂,可有效减少有机溶剂的浪费和对环境的污染,还可以控制烯禾啶有效成分缓慢释放,延长持效期,提高有效成分稳定性。试验结果表明,当单体量比为n(尿素)∶n(甲醛)=1∶2.0,芯皮比为1∶1.5,缩聚反应终点pH 为3.0,可制得结构紧密、包封率为30.6%、粒径分布均匀且平均粒径在2μm左右的球形缓释性固体微胶囊。
[1]刘伊玲,惠玉虎,刘文芝,等.稀禾定土壤处理的除草效果及其活性降解物的研究[J].杂草学报,1989,3(3):1-9.
[2]李玉新,敖聪聪.微胶囊化技术及农药微胶囊剂[J].农药,1998,37(7):4-7.
[3]胡笑形.我国农药工业的现状与发展方向[J].农药,1998,37(6):7-10.
[4]台立民,刘东雪,沈永嘉.化学型农药缓释剂[J].农药,2000,39(6):5-13.
[5]王嫱,龚党生,侯春青.稀禾定原药的高效液相色谱分析[J].农药,2001,40(10):15-16.
[6]王奎涛,葛艳蕊,冯薇,等.玫瑰香精微胶囊缓释性的影响因素研究[J].日用化学工业,2005,35(6):368-370.

