蚯蚓中3~30 kD抗菌肽的分离及抗菌效果研究
王庄,李曾夏子,李文平,赵琴
(湖南农业大学 动物医学院,湖南 长沙 410128)
蚯蚓通常生活在充满大量致病微生物的环境,但却极少患病,因其具有经过长期进化而形成的抵抗外来微生物侵袭的机制.人们采用现代生物技术从蚯蚓中分离到了多种生物活性成分,如抗菌肽、纤溶酶、纤溶酶原激活剂、抗氧化酶系、免疫球蛋白和抗肿瘤成分等[1].其中抗菌肽是具有抗菌作用的多肽,它们是生物体的非特异天然防御屏障[2],大量研究表明,它对革兰氏阳性菌、革兰氏阴性菌、真菌、癌细胞、病毒、原虫具有广泛的杀伤活性和高效性[3-4],与传统的抗生素相比,具有分子量小、广谱抗菌、热稳定性好、抗菌机理独特等优点.但不同的抗菌肽对革兰氏阳性菌和阴性菌的作用有所不同[5-6].如Milochau从蚯蚓体液中分离到了两种分子量为40 kD和45 kD、具有抗菌、溶血和凝血功能的蛋白质,命名为Fetidins;Chao等从蚯蚓Lumbricus rubellus中分离到了抗菌肽LumbricusⅠ,体外试验表明其具有广谱的抗菌活性;Dhainaut等从蚯蚓体腔G1粒细胞内发现了一种能够抑制大肠杆菌和微球菌的金属抗菌蛋白(MPⅡ),表明免疫后的蚯蚓抗菌活性物质增加明显[7-9].但30 kD以下的抗菌肽的分离提取少见报道.笔者对3~30 kD蚯蚓抗菌肽进行分离纯化,并研究其抑菌效果.
1 材料与方法
1.1 材料
人工养殖的大平2号蚯蚓.
主要仪器:高速低温离心机、冷冻干燥机、凝胶过滤层析系统、电泳仪、酶标仪、组织匀浆机等.
试剂: SP-Sepharose Fast Flow、Sephadex G-50 Medium、Tris、过硫酸铵、TEMED、Tricine、SDS、丙烯酰胺、双丙烯酰胺、小分子Protein Marker等.
1.2 方法
1.2.1 蚯蚓抗菌肽的诱导及其蚯蚓初提物的制备
新鲜蚯蚓以pH6.8磷酸盐缓冲液 (PB)为缓冲体系,5V、30 s/1.5 min进行电击诱导[10],匀浆,将提取液用高速冷冻离心机4℃、10 000 r/min,离心30 min,取上清液-20℃保存.
1.2.2 3~30 kD蚯蚓抗菌肽的分离纯化
①超滤管截留3~30 kD的蚯蚓抗菌肽 (超滤有浓缩和脱盐作用)采用30 kDMillipore和3 kDMillipore超滤离心管分别对制备的初提液进行截留处理,在5 000g/min下离心30 min,-4℃冰箱保存,备用.
②阳离子交换分离.将SP-Sepharose Fast Flow纤维素以“酸-碱-酸”处理后,使最终转为-H-型交换剂,放入0.01mol/L pH5.45乙酸铵缓冲液中平衡后装柱.加入样品,用220 mL 0.05~1mL的乙酸铵缓冲液梯度洗脱分管收集,在280 nm处测其光密度,并测定各峰的抑菌活性.
③凝胶过滤层析[11].用Sephadex G-50 Medium进行凝胶过柱,按凝胶体柱长的1%~5%加入样品量,用0.01 mol/L pH5.45乙酸铵缓冲液洗脱,在280 nm波长下检测收集液的峰值并收集,样品浓缩后检测抑菌活性,并放入-20℃冰箱保存.
1.2.3 蛋白浓度和相对的质量的测定
①考马斯亮蓝测定蛋白浓度[12].将牛血清蛋白原液 (1 mg/mL)稀释成11个不同梯度浓度的溶液,分别测定其在280 nm的紫外吸收光值,制作出标准曲线.取适量的待测样品,在280 nm处测得其吸收光值,得出数值后在标准曲线上查出相对应的浓度.
②TricineSDS-PAGE电泳观察抗菌肽分子量[13].凝胶的灌制参照浓缩胶:3%C丙烯酰胺储存液配成4%的丙烯酰胺溶液聚合而成;夹层胶:3%C丙烯酰胺储存液配成10%的丙烯酰胺溶液聚合而成;致密胶:6%C丙烯酰胺储存液配成16.5%的丙烯酰胺溶液聚合而成.加入样品和mark后,30 V 1 h后调至100V至电泳结束,剥离胶固定,脱色、拍片.
1.2.4 蚯蚓抗菌肽抑菌的活性测定
用无菌的96孔微量板,将过滤除菌的抗菌肽H1、H2溶液10 μL依次加入各种接种好菌种的100 μL培养基中,再加入菌液10 μL,每一组做3个平行实验组,最终结果取平均值,以肉汤培养基为空白对照,测得各孔的OD值与37℃培养24 h后的孔OD值进行比较,算得平均值,观察抑菌活性.
2 结果与分析
2.1 分离纯化结果
2.1.1 阳离子交换分离情况
新鲜蚯蚓经电击诱导,充分释放肽类物质,超滤浓缩脱盐后,再经过SP-Sepharose Fast Flow纤维素阳离子交换的方法进一步纯化,去除较多杂蛋白.结果如图1所示,在3~4管有一个小的吸收峰,而在5~7管有一个很显著的吸收峰,经过进一步的抑菌活性检测后,发现第5~7管有抑菌活性,其他管无明显的抑菌活性.
2.1.2 Sephadex G~50 Medium柱层析结果
合并5~7管的蛋白物质经Sebhaadex G-100层析柱提纯后的,得到了两个明显的洗脱峰 (图2),分别为1-3管、5~7管,合并吸收峰值相同的管,编号为H1、H2.
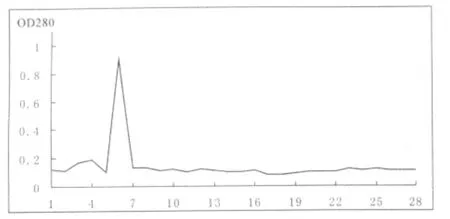
图1 蚯蚓粗提物在SP-SepharoseFastFlow上的分离结果Fig.1 Iorn exchange chromatograohy on SP-Sepharose Fast Flow of the earthworms ABPs extract
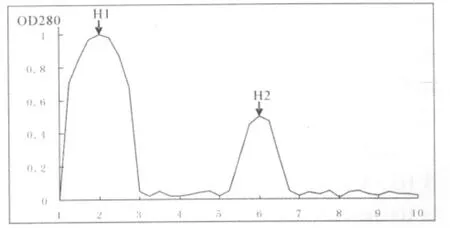
图2 蚯蚓抗菌肽在Sephadex G-50中的分离结果Fig.2 Gel chromatography on Sephadex G-50 of earthworms ABPs
2.2 蛋白浓度和分子量的测定结果
经考马斯亮蓝测定,并在标准曲线上比对,得出H1及H2抗菌肽的质量浓度分别为6.82 mg/μL、 7.46 mg/μL.
用H1和H2的Tricine SDS-聚丙烯酰胺凝胶电泳结果与小分子蛋白Marker进行比对,发现H1、H2两种抗菌肽的相对分子质量分别在5 856~7 823和2010左右(图3).
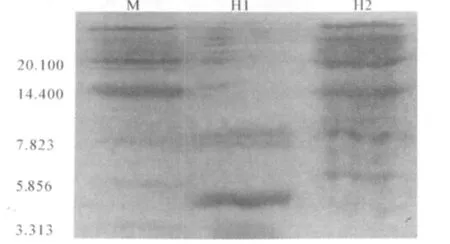
图3 蚯蚓抗菌肽Tricine SDS-Page电泳结果Fig.3 Earthworms ABPs Tricine SDS-Page electrophoresis
2.3 蚯蚓抗菌肽的抑菌活性
观察培养前后,酶标仪测定的OD变化平均值,确定其抑菌效果见表1.
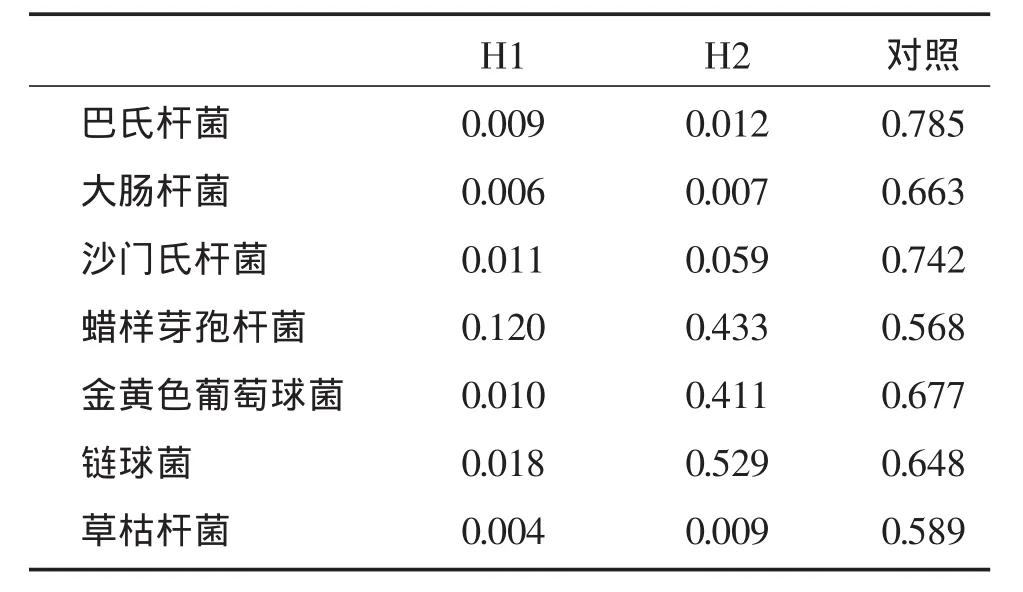
表1 各种细菌培养前后OD平均值变化Table 1 Before and after the change of OD value of culturing various kinds of bacterial
3 讨论
抗菌肽 (AMPs)作为生物体抵御外源微生物入侵的第一道防线,广泛存在于各类群的动物体内.天然的抗菌肽通常是由30多个氨基酸残基组成的碱性小分子,多肽分子量一般在50 kD以下,表现出较强的阳离子特性[14].人们发现不同抗菌肽具有不同的活性,如Ekengren等从果蝇中提取的名为ecropin的抗菌肽,对试验用真菌的致死浓度为0.4~4.0 μmol/L;Shallabuddin研究也发现昆虫抗菌肽对感染蚊子的疟原虫发育的不同时期有不同的作用.程碌侠等从家蝇蛹中分离到了抗弓形虫的抗菌肽;韩立军从蚯蚓中分离出的抗菌肽初提物体外对小鼠脾淋巴细胞有较强的免疫增强作用,并且对S-180肿瘤也有明显的抑制作用[15-17].
通过超滤、阳离子交换、层析过柱分离到了两个峰值的抗菌肽H1和H2,经考马斯亮蓝测得发现其蛋白质量浓度分别为6.82、7.46 mg/μL;经Tricine SDS-聚丙烯酰胺凝胶电泳测得其分子量在5 856~7 823和2010左右.这与夏先琳研究结果类似[18].并且可以看出过柱后抗菌肽H1的纯度较H2高,因为在电泳凝胶上抗菌肽H1仅有一个明显亮带而H2除了接近于20.1 kD的最明显亮带外,还有14.4的亮带,纯度较低.
抗菌肽的主要作用是抵抗外来微生物,对细菌,真菌,病毒都有广泛的杀伤活性.分子量的大小与其的抗菌活性有密切的关系,一般来说分子量越小其抑菌活性越高,如韩立军因9倍的丙酮体积提取出相对分子质量约为3 313~7 823的抗菌肽,对大肠杆菌的抑菌效果要明显高于对金黄色葡萄球菌和变形杆菌的抑菌效果.而分别用6倍和3倍体积丙酮所提取的分子量更大的多肽的抑菌效果较差[17].
本实验所提取的3~30 kD的抗菌肽分子通过抑菌试验显示H1对巴氏杆菌、大肠杆菌、草枯杆菌、金黄色葡萄球菌都有较好的抑菌效果,而H2对巴氏杆菌、大肠杆菌、草枯杆菌效果较好,对蜡样芽孢杆菌、金黄色葡萄球菌及链球菌效果~较弱.这与张希春等人在2002年的研究结果类似[19].对于同一种细菌来说,H1和H2的效果也有所不同,H1的抑菌效果比H2的明显.可见30kD以下的抗菌肽的抑菌效果因分子量的不同而变化.
[1]王宗伟,梁秀文.蚯蚓生物工程技术研究进展[J].中草药,2000(5):386-289.
[2]王可洲,李 浩,刘学玲,等.抗菌肽的分类及作用机理研究进展[J].科学技术与工程,2005,5(7):415-420.
[3]Zasloff M,Martin V,Chen H C.Antimicrobial activity of synthetic magainin peptides nd several analogues[J].Proc Natl Acad Sci USA,1988,85:910-913.
[4]Jacob L,Zasloff M.Potential therapeutic applications of magainis and other antimicrocal agents of animal origin[M].Goode JAntibacterialpeptides.Ciba Fundation Symposium 186.Chichester:Wiley,1994:197-223.
[5]Chen L C(陈留存),Wang J X(王金星).The antibacterial peptides frominsects[J].Devel Bioengi n(生物工程进展),1999,19(5):55-60.
[6]Zhao D H(赵东红),Dai Zh Y(戴祝英),Zhou K Y(周开亚).The func2ation,mechanism and molecularbiology of insect antibacterial peptide[J].Devel Bioengi n(生物工程进展),1999,19(5):14-17.
[7]Milochau A,Lassegues M.Purification,characterization andactivities of two hemolytic and antibacterial protein from coelomicfluid of the annelid Eisenia f eti da andrei[J].Biochim Biophys Acta,1997,(1):123-132.
[8]CHO J H,PARK CB,YOON YG.Lumbricin I,a novelprolinerich antimicirobial peptide from the earthworm:purification,cDNA cloning and molecular characterization[J].Biochim Biophys Acta,1998,(1):67-76.
[9]Dhainaut A,Raveiflon B,M Bdri M,et a1.Purifieation of an antibacterial protein in the coelonile fluid of Nereis diversicolor(Annelida Polychaeta):Similitude with a cadmiu binding protein.[J].Camp Biochem PhysiolC,1989,94:555-560.
[10]刘兵.抗菌肽提取纯化及其性质研究[D].贵阳:贵州大学,2008.
[11]崔东波,郑彦杰,王运吉,等.蚯蚓抗菌肽的分离[J].大连轻工业学院学报,2004,23(4):265-269.
[12]杨建雄.生物化学与分子生物学实验技术教程[M].北京:科学出版社,2002:35-36.
[13]Hermann Schagger.Tricine SDS-PAGE[J].Nature Protocols S,2006(1):20-22.
[14]王建纲,夏乐先,刘晓辉.生物抗菌肽研究进展[J].生物技术通报,2003(2):26-28.
[15]解树涛,宋晓妍,陈秀兰,等.P印面bois类抗菌肽结构与作用机制研究进展[J].国外医药:抗生素分册,2006,27(5):193-197.
[16]程碌侠,于娟.家蝇蛹抗弓形虫抗菌肽的分离纯化[J].中国媒介生物学鸡控制杂志,2008,19(4):309-311.
[17]韩立军.蚯蚓组织提取物的抗菌、抗肿瘤及免疫增强活性研究[D].保定:河北农业大学,2007.
[18]夏先琳.蚯蚓抗菌肽提取纯化及性质研究[D].贵阳:贵州大学,2008:16-30.
[19]张希春,孙振钧,禚如朋,等.蚯蚓两种抗菌肽的分离纯化部分性质[J].生物化学与生物物理进展,2002(6):955-957.

