木霉菌T38D对大豆根腐病菌的拮抗机制
赵永强,台莲梅,郭永霞,张亚玲,靳学慧
(黑龙江八一农垦大学农学院,大庆 163319)
大豆根腐病是一种分布广、危害重、病原菌种类多和防治困难的世界性病害,在我国以黑龙江省东北部地区发生较重。该病主要危害大豆根系,影响作物对水分和养分的吸收,从而造成大量的减产[1,2]。目前防治大豆根腐病主要依靠化学药剂,不仅会严重破坏农业生态系统,并对环境造成污染,而生物防治制剂可以克服上述问题,有利于现代化农业的可持续发展。木霉(Trichoderma spp.)是一种很好的生防微生物,它通过空间竞争、重寄生和抗生作用等一系列拮抗作用能有效抑制许多病原菌的活动,对多种真菌性土传病害有明显的生防效果,但针对于大豆根腐病菌拮抗机制的报道较少,而且木霉菌的不同菌株对同种病原菌的抑制效果也有所不同,为此,就木霉菌T38D对大豆根腐病菌的拮抗机制进行了初步的研究。
1 材料和方法
1.1 供试菌株
木霉菌(Trichoderma spp.)T38D;立枯丝核菌(Rhizoctonia solan)、 尖孢镰孢菌(Fusarium oxysporum)、燕麦镰孢菌(Fusarium avenaceum)、茄腐镰孢菌(Fusarium solani)、禾谷镰孢菌(Fusarium graminearum)和终极腐霉菌(Pythium ultimum)。
1.2 木霉菌T38D与大豆根腐病菌的对峙培养
对峙培养:将培养2 d,直径为5 mm的木霉菌饼和大豆根腐病菌菌饼接种在直径为90 mm的PDA平板培养基上,使2个菌饼直线距离为60 mm,每个处理3次重复,以只接大豆根腐病菌作对照,在25℃下对峙培养,每天定时观察、记录菌落生长情况。并采用拮抗指数评价竞争作用强度。
拮抗指数分级标准为[3]:
Ⅰ级,木霉菌丝占据平皿100%;
Ⅱ级,木霉菌丝占据平皿>2/3;
Ⅲ级,木霉菌丝占据平皿>1/3,<2/3;
Ⅳ级,木霉菌丝占据平皿<1/3;
Ⅴ级,病原菌占据平皿100%。
1.3 木霉菌T38D对大豆根腐病菌重寄生现象观察
取熔化的无菌PDA培养基用灭菌的毛刷蘸取后,刷在已灭菌载玻片上,制成1mm厚的PDA膜,再分别接种大小为2 mm×2 mm木霉菌和病原菌的菌丝块于载玻片两端,二者相距2 cm,25℃培养24~72 h,用OLYMPUS BX-51型系统显微镜观察、照相。
1.4 木霉菌T38D的难挥发性代谢产物对大豆根腐病菌的拮抗作用
采用圆盘滤膜法[4]:铺赛璐玢膜于PDA平板上,在其中央接种木霉菌T38D的菌饼,25℃恒温培养。待木霉菌T38D的菌丝长满赛璐玢膜前,将赛璐玢膜移去。在平板中央接种大豆根腐病菌菌饼,25℃下恒温培养。同时以不铺赛璐玢膜的PDA平板上接种大豆根腐病菌菌饼作对照。处理重复3次。接种后每隔24 h测定菌落直径,计算其菌丝生长抑制率。

1.5 木霉菌T38D的易挥发性代谢产物对大豆根腐病菌的拮抗作用
采用对扣培养法测定[5]:在PDA平板上接种木霉菌T38D的菌饼,25℃恒温培养2 d后,在其上方蒙上无菌的圆形赛璐玢膜(赛璐玢膜直径比培养皿直径大10 mm),再将刚接种过直径为5 mm大豆根腐病菌菌饼的PDA平板倒扣其上,封口膜密封后,25℃恒温培养。以空白PDA平板与接种大豆根腐病菌的PDA平板对扣培养作对照。处理重复3次。接种后每隔24 h测量大豆根腐病菌菌落直径,计算其菌丝生长抑制率。计算方法同上。
2 结果与分析
2.1 木霉菌T38D与大豆根腐病菌的对峙培养
在木霉菌T38D与立枯丝核菌对峙培养中,立枯丝核菌的菌丝生长速度比木霉菌T38D生长快,48 h两菌落接触,立枯丝核菌约占平板的2/3,木霉菌约占1/3,接触后,立枯丝核菌很快停止生长,木霉菌T38D则继续生长;从平板正面观察,可见木霉菌T38D的菌丝将立枯丝核菌的菌丝逐渐覆盖,7 d可将立枯丝核菌菌落全部覆盖。与对照中的立枯丝核菌相比,对峙培养中的立枯丝核菌无气生菌丝且菌丝大量消解,极少产生菌核或不产生菌核。
在木霉菌T38D与尖孢镰孢菌、燕麦镰孢菌、茄腐镰孢菌、禾谷镰孢菌和终极腐霉菌对峙培养中,木霉菌的菌丝生长速度比病原菌菌丝生长快,72 h时平板内两菌落均可接触,木霉菌菌落约占平板的2/3,病原菌约占1/3,接触后,病原菌很快停止生长,木霉菌T38D则继续生长,7 d可将终极腐霉菌菌落全部覆盖,木霉菌虽不能将尖孢镰孢菌、燕麦镰孢菌、茄腐镰孢菌和禾谷镰孢菌的菌落完全覆盖,但可在病原菌菌落内看到大量的木霉菌绿色孢子。

表1 木霉菌T38D对6种病原菌的拮抗指数Table1 Inhabiting of Trichoderma against pathogens of soybean root rot
2.2 木霉菌T38D对大豆根腐病菌重寄生作用
显微观察表明,木霉菌T38D对尖孢镰孢菌、立枯丝核菌、燕麦镰孢菌和终极腐霉菌都有重寄生作用(图1~4),对禾谷镰孢菌和茄腐镰孢菌未观察到重寄生现象。
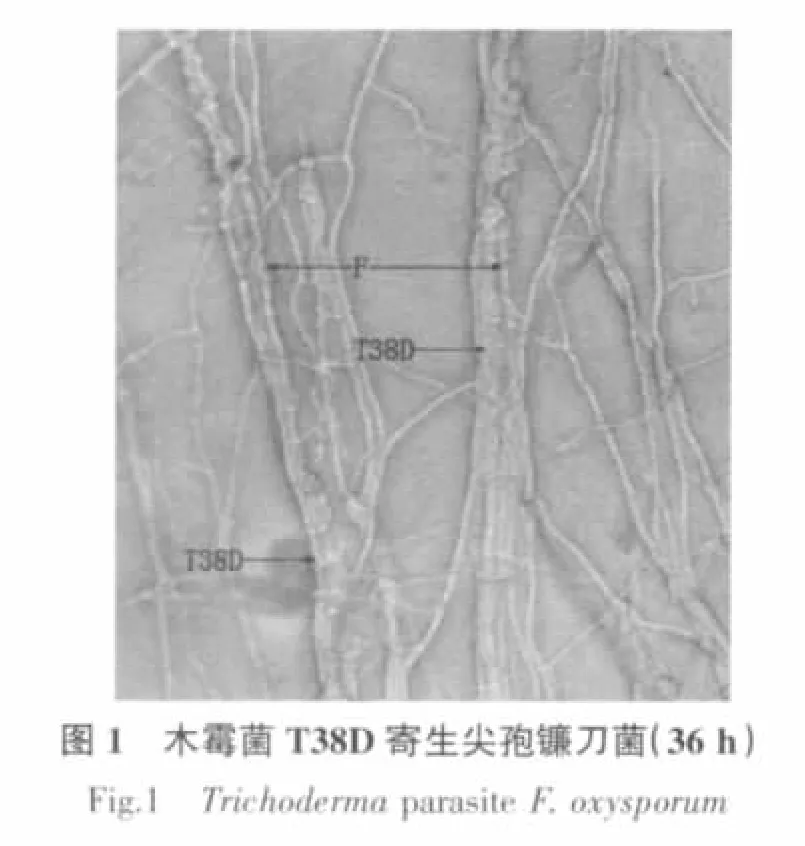


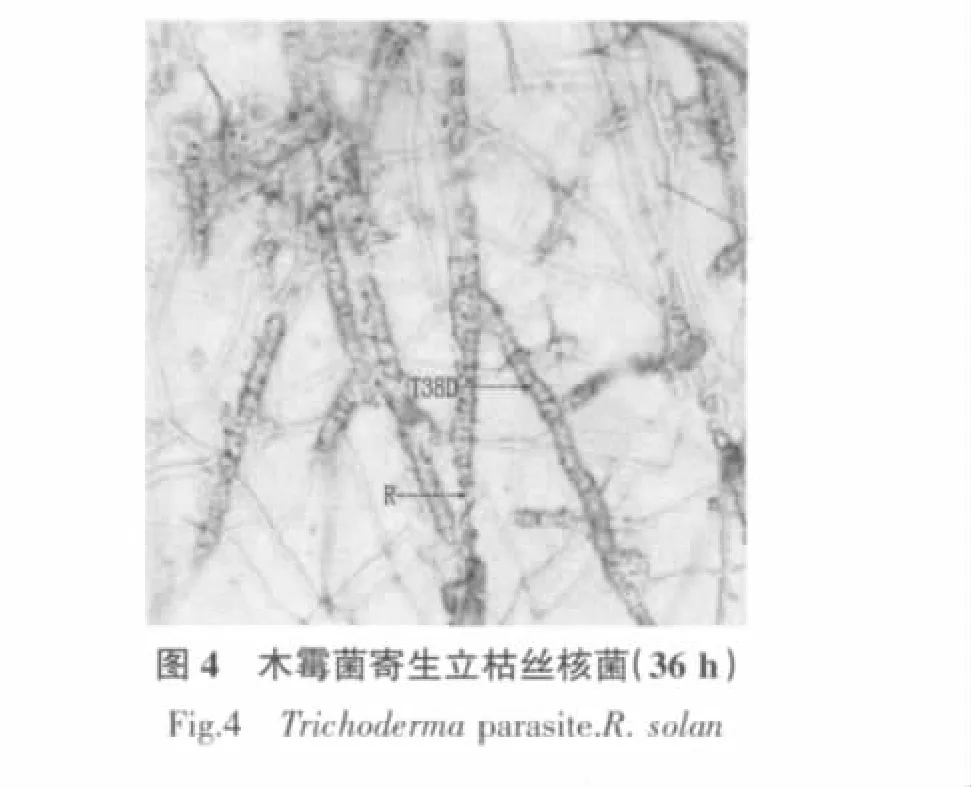
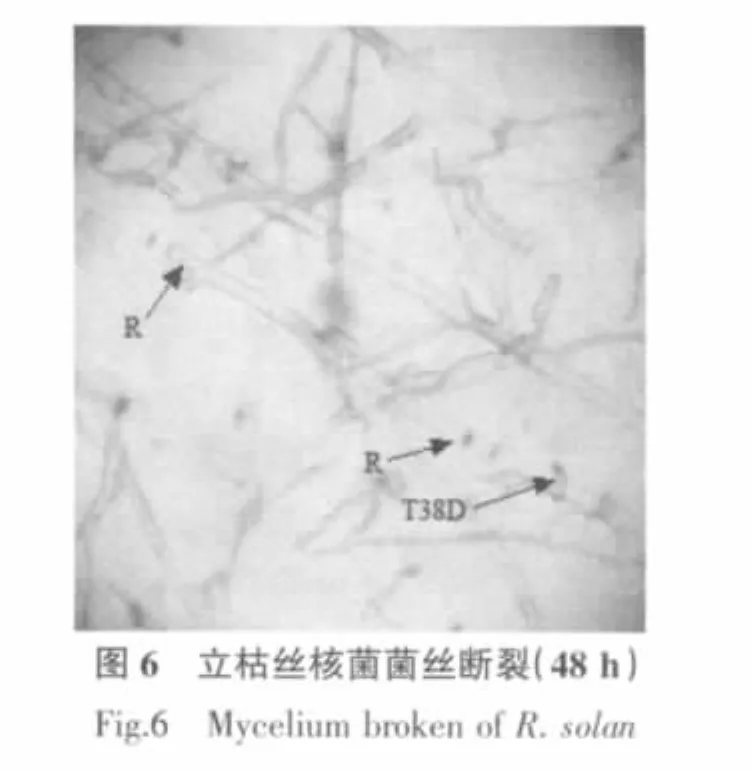
木霉菌的菌丝在与病原菌菌丝接触后(36 h),会产生出大量的细小分支,这些分支有些紧贴病原菌菌丝与病原菌菌丝平行生长,有些则缠绕于病原菌菌丝上,在木霉菌与病原菌菌丝交界处,可以看到大量的病原菌的菌丝被木霉菌的菌丝紧密缠绕的现象(图1~3);48 h后可以观察到被木霉菌缠绕的尖孢镰孢菌菌丝有分解的现象,立枯丝核菌菌丝有断裂的现象(图5,图 6)。

2.3 木霉菌T38D的难挥发性代谢产物对大豆根腐病菌的拮抗作用
待对照将要长满皿时,测量病原菌的菌落直径,从测量结果中可以看出,木霉菌T38D生长过程中产生的非挥发性代谢产物对大豆根腐病菌产生不同的抑制作用(见表2)。木霉菌T38D对立枯丝核菌和终极腐霉菌的抑制作用强,抑制率分别为100%和87.6%;对镰孢菌的抑制作用较弱,其中对燕麦镰孢菌的抑制率为75.2%,对其他镰孢菌的抑制率为40%~50%。

表2 木霉菌T38D难挥发性代谢产物对大豆根腐病菌的抑制作用Table 2 Inhibition rates of Trichoderma production of non-volatile antibiotics to pathogens of soybean root rot
2.4 木霉菌T38D易挥发性代谢产物对大豆根腐病菌的拮抗作用
试验结果表明,木霉菌T38D生长过程中产生的易挥发性代谢物质对立枯丝核菌和终极腐霉菌有一定的抑制作用,抑制率分别为35.1%和47.3%;对镰孢菌的抑制作用不明显(表3)。
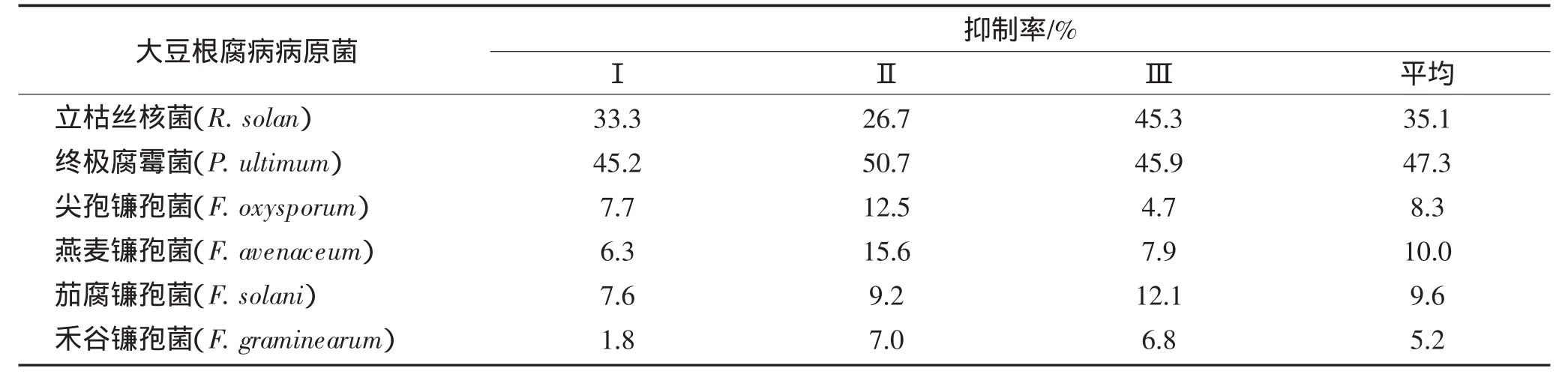
表3 木霉菌T38D易挥发性代谢产物对大豆根腐病菌的抑制作用Table 3 Inhibition rates of Trichoderma production of volatile antibiotics to pathogens of soybean root rot
3 结论与讨论
从对峙培养的结果可以看出,木霉菌T38D生长速度比镰孢菌生长速度快,能在平板中迅速占领生长空间,当木霉菌菌落与镰孢菌菌落接触后,镰孢菌的生长会很快受到抑制,而木霉菌T38D则继续生长并产生大量的分生孢子,逐渐将镰孢菌覆盖。立枯丝核菌和终极腐霉菌的生长速度虽然比木霉菌T38D生长的快,但是其菌落会很快被木霉菌菌丝覆盖,其菌丝会很快消解。结合光学显微镜观察的结果,可以看到木霉菌T38D的菌丝能够以缠绕等方式重寄生在尖孢镰孢菌、立枯丝核菌、燕麦镰孢菌、终极腐霉菌的菌丝上。通过圆盘滤膜法和对扣培养法可以看出,木霉菌T38D的代谢产物也是重要的抑菌物质,其中难挥发性的代谢物质对引起大豆根腐病的这几种病原菌都有较高的抑制率,挥发性的代谢物对立枯丝核菌和腐霉菌有一定的抑制作用,但对几种镰孢菌的抑制效果不明显;可见木霉菌的代谢产物中,难挥发性的代谢产物是主要的抑菌物质。
木霉菌对大豆根腐病菌拮抗机制的研究报道较少,孙冬梅和王伟分别报导了黄绿木霉和绿色木霉对镰孢菌的抑制作用[6,7],试验中的木霉菌T38D对镰孢菌重寄生作用,空间竞争能力,与孙冬梅报道的黄绿木霉对镰孢菌拮抗有相似的结果。试验还就木霉菌T38D对引起大豆根腐病的立枯丝核菌和终极腐霉菌的拮抗作用进行了研究,发现T38D对这两种根腐病菌的抑制效果比对镰孢菌的抑制效果更明显。
木霉菌对大豆根腐病菌的抑制是竞争、重寄生和抗生作用等几种拮抗机制的综合作用的结果,试验除了研究木霉菌对大豆根腐病菌的竞争作用和重寄生作用,还发现木霉菌的代谢产物对根腐病菌的抑制作用也很明显,但是代谢产物起抑菌作用的具体物质还有待于进一步的研究。
[1]李长松,赵玖华,杨崇凉,等.我国大豆根腐病研究概况及存在的问题[J].中国油料作物,1997,19(3):82-84.
[2]靳学慧,马汇泉.农业植物病理学—粮食作物和经济作物部分[M].内蒙古:内蒙科学技术出版社,1999.
[3]Bell D K,Wells H D,Markham C R.In vitro antagonism of Trichoderma species against fungal Pathogens[J].Phytopath,1982,72:379-382.
[4]Dennis C,Webster J.Antagonistic properties of speciesgroups of Trichoderma production of non-volatile antibiotics[J].Trans Br Mycelia Soc,1971,57:25-39.
[5]Whipps J M,Magan N.Effects of nutrient status and water potential of media on fumgal grouth and antagonistpathogen interactions[J].Bulletin OEPP/EPPO Bulletin,1987,17:581-591.
[6]孙冬梅,杨谦,宋金柱.黄绿木霉菌对大豆根腐病镰孢菌的拮抗作用[J].中国油料作物学报,2005,27(3):58-61.
[8]王伟,赵谦,杨微.木霉对土传病原尖孢镰孢菌的拮抗作用[J].中国生物防治,1997,(1):45-47.

