碱茅耐盐碱基因克隆研究进展
任伟,王志峰,徐安凯
(吉林省农业科学院畜牧科学分院,吉林 公主岭136100)
碱茅(Puccinellia)是生长在草甸草原、盐渍化土壤碱斑周围的冷季型多年生禾本科牧草。它的幼苗,在p H值大于10、表土含盐量5%以上的土壤中,仍能正常生长,被誉为盐碱地的先锋植物[1]。作为一种抗盐碱、耐低温、饲用价值好的优良牧草,引起了诸多学者的重视。以往的科技工作者对碱茅在盐碱胁迫下的生理生化反应[2-6]、种子萌发[7-9]、形态解剖[10-12]、耐盐机制[13-17]、遗传育种及盐碱地生态恢复与改良[18-20]等方面做了详细的研究。近年来,随着分子生物学的飞速发展,许多新的技术如分子克隆、分子标记、转基因、差异显示(DDRT)、拟制性消减杂交(SSH)、c DNA微阵列技术(c DNA microarray)、表达序列标签(EST)等广泛应用于碱茅耐盐机理的研究,取得许多重要的研究成果。获得了大量的盐碱诱导基因,主要集中在盐碱胁迫条件下,与其渗透调节物质合成、抗氧化保护酶、离子通道蛋白、信号转导蛋白作用有关的基因。对碱茅耐盐碱基因的挖掘,不仅有助于更好的研究碱茅自身的耐盐碱机制,而且可以加快牧草及其他农作物的品质改良,具有重要的理论意义和很高的实际应用价值。
1 渗透调节物质合成基因
当植物遭遇干旱、盐碱、低温等逆境时,就会在体内积累各种小分子物质,提高细胞液浓度,降低其渗透势,并保持一定的压力势,来维持细胞的正常膨压。参与渗透调节的物质有很多,大致可分为两大类。一类是由外界进入细胞的无机离子,一类是在细胞内合成的有机物质,如脯氨酸(proline)、甜菜碱(betaine)、芒柄醇(D-ononitol)、甘露醇(mannitol)、山梨醇(sorbitol)和海藻糖(trehalose)等。
目前,从植物中克隆的参与渗透调节物质合成的基因主要是BADH基因(甜菜碱醛脱氢酶基因,betaine aldehyde dehydragenase)、P5CS基因(Δ’-吡咯啉-5-羧酸合成酶基因,Δ’-pyrroline-5-carboxylate synthase)[21]和Imtl基因(肌醇甲基转移酶基因,inositol O-methyltrans ferase)[22]。其中BADH基因是目前耐盐、耐旱基因工程中研究得较深入的基因之一,是公认的截至目前为止,最具抗盐碱效果的基因。杨铮等[23]和钟鸣等[24]通过同源序列克隆结合cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE),在朝鲜碱茅中扩增出BADH基因,共1 502 bp。序列比对后发现,朝鲜碱茅与大麦(Hordeumbrevisubulatum)、羊草(Leymuschinensis)的同源性高达89%,含有醛脱氢酶特有的十肽保守序列(VSLELGGKSP),但是与多数植物中BADH的十肽保守序列(VTLELGGKSP)存在细微的差别,朝鲜碱茅第2位的T被S取代。其后29位点上含有与酶功能有关的半胱氨酸残基,可能包含NAD+结合位点及酶催化位点,这些微小的变化及内含的结合位点可能与增强碱茅的耐盐能力有关。C末端的SKL信号肽序列,说明甜菜碱醛脱氢酶定位于朝鲜碱茅体内的过氧化物酶体中,而甜菜碱的合成是在叶绿体中完成,朝鲜碱茅是如何完成这个运输过程的,会不会影响它的耐盐能力,以及这个BADH基因的耐盐生理特性如何,都值得做进一步的研究。
2 抗氧化胁迫基因
盐胁迫下,细胞内会产生氧自由基(O2-)、过氧化氢(H2O2)和羟基自由基(OH-)等活性氧物质(ROS),引起膜脂过氧化,蛋白质变性,核酸降解,进而导致氧化胁迫的产生。植物有2种防止活性氧危害的系统:酶促系统和非酶促系统。非酶促系统主要包括一些直接参与活性氧清除的抗氧化物,如抗坏血酸、谷胱甘肽、多元醇、α-生育酚、类胡萝卜素和黄酮等。酶促系统是指参与保护反应的酶类,主要有超氧化物歧化酶(super oxide dismutase,SOD),过氧化氢酶(catalase,CAT),抗坏血酸过氧化物酶(aseorbate peroxidase,APX),谷胱甘肽过氧化酶(glutathione peroxidase,GPX),谷胱甘肽硫转移酶(glutathione s-transferase,GST),单脱氧抗坏血酸还原酶(monodehydro aseorbate reduetase,MDHAR)及脱氧抗坏血酸还原酶(dehydroascorbic acid reductase,DHAR)等[25]。在碱茅中,目前研究比较多的是酶促系统中的一些关键酶类。
2.1 脱氢抗坏血酸还原酶(DHAR)基因和铁蛋白(Fer)基因
张晓磊[26]根据已有的碱茅EST片段设计基因特异性引物,克隆到了脱氢抗坏血酸还原酶(DHAR)和铁蛋白(ferritin,Fer)2个抗氧化基因,并研究了不同盐碱处理条件下这2个基因的表达变化情况。PtDHAR基因,开放阅读框(ORF)639 bp,编码213个氨基酸,以谷胱甘肽为底物,催化脱氢抗坏血酸还原为抗坏血酸,在保护细胞组分抵御氧化损伤及循环利用抗坏血酸中起重要作用[27]。铁蛋白(PtFer)基因开放阅读框为336 bp,编码111个氨基酸。在高氧环境下,氧与铁反应会产生氧自由基,对植物产生巨大的毒性而损害生物有机体[28]。而铁蛋白具有很强的贮铁功能,可以将铁以无毒的形式贮存起来,为依赖于铁的生理生化过程起着暂时性缓冲作用,减少植物体内各种氧化胁迫产生的伤害作用,增强植株对逆境胁迫的抗性,提高植物的生长速度[29]。Northem杂交的结果表明,盐碱胁迫后,这2个基因都有不同程度的表达,但是随着处理时间的延长,DHAR的表达量先增加后减少,而铁蛋白的表达量持续增加。随着处理浓度的递增,DHAR的表达量变化不大,而铁蛋白的表达量在200 mmol/L处理后达到最大,并且碱茅地上部与根部对胁迫响应也存在时空上的差异[26]。说明同一植物不同基因以及同一基因在碱茅不同部位对盐碱胁迫的响应机制是不同的,它们之间可能相辅相成,也可能相互制约。今后,应该注重不同耐盐碱基因之间互作效应的研究。
2.2 抗坏血酸过氧化物酶(APX)基因
作为抗氧化系统中清除盐碱胁迫产生的H2O2的主要酶类——抗坏血酸过氧化物酶(ascorbate peroxidase,APX)[30],它催化H2O2还原为H2O的反应,对抗坏血酸具有很高的特异亲和性[31]。它的基因在碱茅中也得到分离克隆[32]。序列分析表明,开放读码框(ORF)为876 bp,编码291个氨基酸。它是细胞质过氧化物体的分泌蛋白,在细胞质中合成,最后通过蛋白转运系统定位于过氧化物体。过量表达PutAPX基因的酵母在含H2O2的SD培养基上生长良好,对组织和细胞起到了保护作用,体现了抗坏血酸过氧化物酶在氧化胁迫下的作用。为进一步研究APX在碱茅体内的转运机制以及逆境诱导下氧化胁迫的作用机理奠定了基础。
2.3 超氧化物歧化酶(SOD)基因
超氧化物歧化酶(super oxide dismutase,SOD)是一种含金属的抗氧化酶。对于清除氧自由基,防止氧自由基破坏细胞的组成、结构和功能,保护细胞免受氧化损伤具有十分重要的作用[33],与植物的抗旱、抗盐碱、耐高温等多种逆境有密切关系[34],主要可分为3类:Cu/Zn-SOD、Mn-SOD和Fe-SOD[35]。吴建慧等[36]从碱茅根c DNA文库中分离得到Put-Cu/Zn-SOD基因,全长cDNA,开放读码框长615 bp,所编码的蛋白由204个氨基酸组成。对转Put-Cu/Zn-SOD酵母进行盐碱、氧化胁迫的实验结果表明,碱茅Put-Cu/Zn-SOD基因对Na2CO3、Na HCO3和H2O2有着良好的抗性,显著提高了酵母的抗盐碱和耐氧化能力。也有一些研究表明,单个抗氧化胁迫基因的能力往往是有限的,所以要从碱茅中克隆更多的抗氧化胁迫基因,研究多个基因在增强植物抗逆能力中的作用机理及应用。
3 离子胁迫相关基因
植物消除离子胁迫主要有3种机制,即降低离子吸收、离子外排和离子区隔化[37,38],这3种机制的关键在于一些离子通道蛋白和逆向转运蛋白对离子的选择性吸收或转运作用。目前,在碱茅中克隆到的编码此类蛋白的功能基因主要与 HKT(high-affinity K+transporter)转运蛋白、NHX(Na+/H+exchanger)逆向转运蛋白、CAX(Ca2+/H+exchanger)反向转运蛋白和质子泵蛋白的作用有关。
3.1 Na+/H+逆向转运蛋白基因(NHX)
植物Na+/H+逆向转运蛋白(Na+/H+exchanger,NHX)分为质膜型和液泡膜型2类,依靠H+-ATPase和H+-PPase产生的质子驱动力介导Na+/H+跨膜运输,分别负责细胞质内的Na+外排和Na+区隔化,可以调节植物的耐盐能力[39]。程玉祥[40]分离了碱茅质膜型Na+/H+逆向转运蛋白基因(PtSOS1),Southern分析表明PtSOS1是单拷贝基因。半定量RT-PCR结果显示,PtSOS1受盐胁迫上调表达。说明PtSOS1可能在星星草(Puccinelliatenuiflora)的抗盐碱能力中起作用。也有研究表明PtSOS1在拟南芥(Arabidopsisthaliana)中的过表达,提高了转基因植株的耐盐性[41]。但是碱茅质膜型Na+/H+逆向转运蛋白是否参与了体内K+的运输,与水稻(Oryzasativa)、拟南芥等植物的运转功能是否相同,还不清楚。可以采用过表达PtSOS1和反义RNA拟制表达的方法来研究它的结构与功能。
3.2 Ca2+/H+反向转运蛋白基因(CAX)
Ca2+/H+反向转运体(Ca2+/H+exchanger,CAX)与Ca2+-ATP酶同是Ca2+外向转运器,负责将胞质中的Ca2+运出细胞,或运入细胞内的液泡及其他细胞器[42]。CAX是 Ca2+/cation反向转运体(Ca2+/cation antiporter,CaCA)的家族之一,在植物、真菌、细菌和低等脊椎动物中均有存在。它是不直接需求三磷酸腺苷(adenosinetriphosphate,ATP)的次级转运器,利用质子驱动力(pmf)来驱动钙离子的运输[43],对植物体内的离子平衡有着极其重要的作用。Liu等[44]在碱茅中分离到的PutCAX基因,具有提高酵母对Ca2+或Ba2+抗性的功能,并且首次提出CAX基因具有逆向转运Ba2+的功能。通过GFP荧光蛋白标记和FM4-64(分子探针)染色,初步证明PutCAX定位于酿酒酵母的液泡膜上。通过观察PutCAX基因N、C端缺失酵母转化体的生长情况,发现N端和C端对PutCAX运输Ca2+或Ba2+具有一定的调控作用。但是,在转化试验中发现,一些转PutCAX拟南芥植株的生长反而受到拟制,是不是由于PutCAX的过表达,打破了拟南芥体内原有的离子平衡稳态,还是与其他重金属离子产生了离子拮抗作用,值得做进一步详细的研究。
3.3 Na+/K+转运蛋白基因(HKT)
植物HKT家族转运蛋白(high-affinity K+transporter)的主要功能是参与Na+/K+在植物体内的选择性转运,已有的研究结果表明K+/Na+在细胞内的选择性转运,是碱茅体内一个非常重要的耐盐机制[17],说明碱茅HKT基因在耐盐转基因工程中可能具有重大应用价值。植物HKT蛋白的一些跨膜区和螺旋区的氨基酸组成是非常保守的[45],这为利用同源克隆方法分离植物的HKT基因提供了方便。但是HKT基因在总体上的保守性比较差,即使单个氨基酸残基的变化也会显著改变选择性转运Na+的活性[46]。因此Ardie等[47]将从碱茅中分离的PutHKT2与水稻中克隆的OsHKT2同时转化酵母和拟南芥,来研究2个HKT基因的表达差异性。结果表明,转碱茅PutHKT2基因的酵母表现出高亲和性的K+-Na+共转运系统。转PutHKT2拟南芥可以抵抗外界Na+、K+和Li+多种离子的胁迫,而转OsHKT2拟南芥仅仅对外界Na+表现敏感。这也许是碱茅比水稻更耐盐碱的原因之一。此外,同一蛋白家族的基因,表达效果也不尽相同。Zhang等[48]对碱茅质膜家族蛋白3(plasma membrane protein 3)的2个基因PutPMP3-1、PutPMP3-2的研究发现,后者的抗逆能力更强。
4 参与胁迫信号转导途径的基因
干旱、盐碱、低温等外界逆境因子实质上是一种体外信号,当植物感知体外信号后,可以引发一系列的体内信号,进而诱导相关基因表达调控的改变。在长期进化过程中,植物拥有完整的信号网络用以调节各种环境胁迫引起的响应。随着研究的逐步深入,脱落酸(ABA)被普遍认为参与了在盐胁迫下的渗透胁迫信号转导。相应地,调控ABA信号响应基因的表达也被证实有助于提高植物的耐盐性[49]。ABA可以引起气孔的关闭,维持植物体内水分平衡,保护质膜结构和功能,提高植物的抗盐能力[50]。于雪飞和杨传平[51]在碱茅中分离到受ABA和高盐诱导的Put-R40g3基因,全长588 bp,编码195个氨基酸,与水稻,小麦和拟南芥的氨基酸序列有较高的同源性,绿色荧光蛋白(GFP)定位研究结果显示Put-R40g3蛋白存在于酵母细胞质中。显著提高了酵母对盐、干旱及氧化等逆境条件的适应能力。
除了ABA信号转导之外,植物还有很多响应盐胁迫的信号途径。已经证实盐过敏感(salt overly sensitive,SOS)信号途径在植物耐盐中起调控作用,在这条途径中,钙离子作为第2信使与钙离子结合蛋白结合并激活下游一系列蛋白,进而调控植物的耐盐性[52,53]。此外,蛋白质磷酸化和去磷酸化也是调控细胞响应各种外源信号的重要机制,MAP激酶(促分裂原活化蛋白激酶)级联途径在内源、外源信号传导过程中均发挥着重要的作用。MAP激酶级联途径包括3种蛋白激酶:MAPKK激酶(MAPKKK)、MAPK激酶(MAPKK)和 MAP激酶(MAPK),构成三级激酶模式[54-56]。
大量的证据表明,这些胁迫信号转导途径间存在联系和交叉作用。盐胁迫的早期信号转导事件以及早期诱导表达的基因是一个关键所在,分离碱茅体内此类胁迫响应基因是今后植物耐盐性研究的一个重点方向。在盐碱胁迫下,碱茅体内相应的细胞受体是什么?从碱茅感知胁迫信号到合成相关基因的表达蛋白,具体的信号转导过程是什么?这些问题的解决将有助于加深对碱茅耐盐碱机理的研究。
5 基因组学在碱茅耐盐碱机理研究中的应用
随着植物基因组学与生物信息学的飞速发展,为碱茅耐盐碱机理的研究及相关基因的克隆提供了许多新的技术,如:差异显示(DDRT)、拟制性消减杂交(SSH)、c DNA微阵列技术(c DNA microarray)和表达序列标签(EST)等。已有许多学者应用其中一种,或是几种技术相结合的方法,对不同浓度、不同时间盐碱胁迫处理下,碱茅相关基因的表达情况,作了详细的研究[57-60]。其中已知的同源EST序列,大多数是与活性氧清除、渗透调节、基因调控、离子转运过程有关的基因片段。DNA芯片(DNA chip)的研究结果显示,一些基因在盐胁迫下表达下调,另一些基因在盐胁迫下表达上调,这些基因的功能主要涉及了信号传导、转录调控、细胞防御、细胞代谢等方面,这些差异表达的基因可能在星星草抗盐碱过程中具有关键作用。植物的抗盐碱过程是一个复杂的多因子作用体系[61],通过新兴的基因组学研究手段,可以有效获取盐碱胁迫下碱茅基因表达的大量特征信息,从而为系统阐明碱茅抗盐碱分子机理奠定坚实的基础,也为寻找未知的抗逆基因提供了新途径。
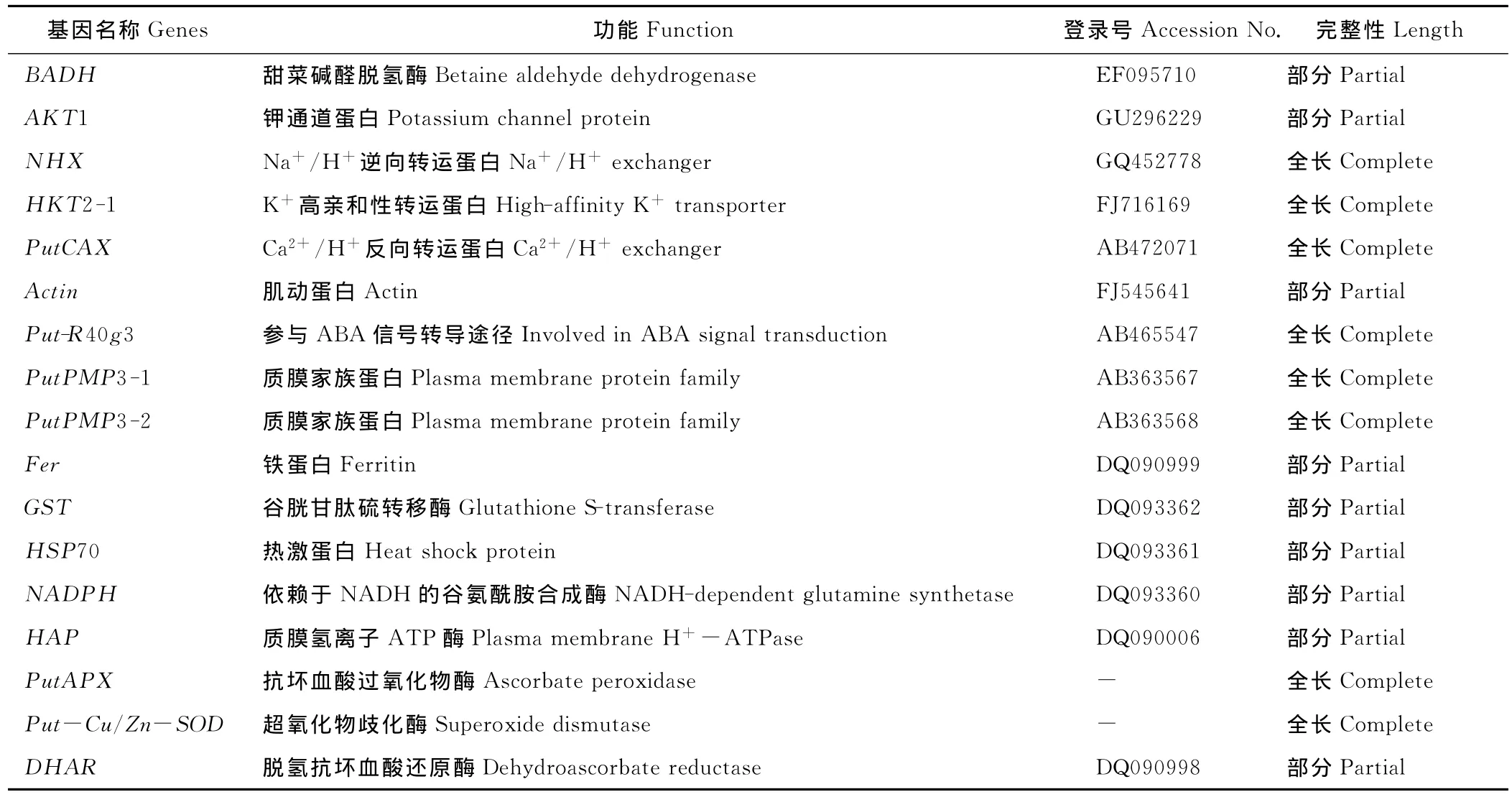
表1 NCBI基因库中已登录的碱茅盐碱诱导基因或片段Table 1 The salt and alkali inducible gene or cDNA segment registered in Gene bank
6 问题与展望
目前,在美国国立生物技术信息中心(NCBI)基因库中登录的与碱茅盐碱诱导相关的基因或片段总共有17种(表1)。不得不承认我国牧草分子生物学的研究要远远落后于水稻、小麦等农作物的研究[62-64]。但是,农业生产面临的首要逆境胁迫就是土壤盐渍化,而培育耐盐碱转基因农作物有望解决这一世界难题。分子选育抗盐碱植物新品种的关键,就是从盐生植物里分离抗盐碱功能基因,碱茅,作为一种宝贵的盐生种质资源、为相关研究提供了丰富的耐盐碱基因。加大对碱茅分子生物学的研究,不仅有助于培育耐盐碱转基因农作物、牧草和花卉,而且可以为我国盐碱草地的改良和治理提供理论基础,具有重大的经济价值和生态效应。
[1]中国饲用植物志编辑委员会.中国饲用植物志(第一卷)[M].北京:农业出版社,1978:21-22.
[2]王苹,李建东,欧勇玲.松嫩平原盐碱化草地星星草的适应性及耐盐生理特性的研究[J].草地学报,1997,5(2):80-84.
[3]石德成,殷丽娟.盐与碱对星星草胁迫作用的差异[J].植物学报,1993,35(2):144-149.
[4]王锁民,朱兴运,赵银.盐胁迫对拔节期碱茅游离氨基酸成分及脯氨酸等含量的影响[J].草业学报,1994,3(3):22-26.
[5]王锁民,朱兴运,王增荣.渗透调节在碱茅(Puccinelliatenuiflora)幼苗适应盐逆境中的作用初探[J].草业学报,1993,2(3):40-46.
[6]刘延吉,张蕾,田晓艳.盐胁迫对碱茅幼苗叶片内源激素、NAD激酶及Ca2+-ATPase的效应[J].草业科学,2008,25(4):51-54.
[7]徐安凯.碱茅发芽生理及恒温发芽选育效果研究[D].兰州:甘肃农业大学,1995.
[8]李艳波,陈月艳,孙国荣,等.盐碱胁迫下星星草种子萌发过程中氮代谢的初步研究[J].植物研究,1999,19(2):153-158.
[9]陈月艳,孙国荣,李景信.Na2CO3胁迫对星星草种子萌发过程中水分吸收及膜透性的影响[J].草业科学,1997,14(2):27-30.
[10]朱宇旌,张勇,胡自治,等.小花碱茅根适应盐胁迫的显微结构研究[J].中国草地,2001,23(1):37-40.
[11]韦存虚,王建军,王建波.Na2CO3胁迫对星星草叶肉细胞超微结构的影响[J].生态学报,2006,26(1):108-114.
[12]杨春雪,申家恒.星星草受精作用及其胚与胚乳早期发育的观察[J].武汉植物学研究,2004,22(2):91-97.
[13]阎顺国,朱兴运,郭树林.碱茅草对土壤盐分动态及盐量平衡的影响[J].水土保持学报,1990,4(1):44-48.
[14]朱兴运,王锁民,阎顺国.碱茅属植物抗盐性与抗盐机制的研究进展[J].草业学报,1994,3(3):9-15.
[15]Wang S M,Zhao G Q,Gao Y S.Puccinelliatenuifloraexhibits stronger selectivity for K+over Na+than wheat[J].Journal of Plant Nutrition,2004,27:1841-1857.
[16]Peng Y H,Zhu Y F,Mao Y Q.Alkali grass resists salt stress through high K+and an endodermis barrier to Na+[J].Journal of Experimental Botany,2004,55:939-949.
[17]Wang C M,Zhang J L,Liu X S.Puccinelliatenuifloramaintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+[J].Plant Cell and Environment,2009,32:486-496.
[18]吴青年,徐安凯.碱茅草改良碱斑草场综合技术[J].中国农业科学,1987,20(1):92.
[19]徐安凯.“吉农朝鲜碱茅”与“三北”地区盐碱地的改良[J].牧草与饲料,2007,1(2):3-5.
[20]齐宝林,高国臣,赵云鹏.耐盐抗寒优质牧草——碱茅[J].吉林林业科技,2005,(9):4-7.
[21]Hong Z.Removal of feedback inhibition ofΔ1-pyrroline-5-carboxylate synthase results in increased proline accumulation and protection of plants from osmotic stress[J].Plant Physiology,2000,122:1129-1136.
[22]Vernon D M,Bohnert H J.A novel methy transferase induced by osmotic stress in the facultative Mesembryanthemum crystallium[J].Embo Journal,1992,11:2077-2085.
[23]杨铮,钟鸣,郭志富.盐胁迫下朝鲜碱茅的甜菜碱醛脱氢酶活性变化及其基因保守区的克隆[J].植物生理学通讯,2007,4(3):430-434.
[24]钟鸣,张佳,郭志富.朝鲜碱茅BADH基因3′端及5′端部分序列的扩增[J].华北农学报,2009,24(3):46-50.
[25]方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002:30-31.
[26]张晓磊.星星草PtDHAR及PtFer基因的克隆与表达分析[D].黑龙江:东北林业大学,2008.
[27]Yabuta Y,Motoki T,Yoshimura K.Thylakoid membrane-bound ascorbate peroxidase is a limiting factor of antioxidative systems under photo-oxidative stress[J].The Plant Journal,2002,32:915-925.
[28]Guenriot M L,Yi Y.Iron:Nutritions,noxious and not readily avaliable[J].Plant Physiology,1994,104(33):815-820.
[29]Balla G,Jacob H S,Balla J.Ferritin:A cytoprotective antioxidant strategem of endothelium[J].Journal of Biology Chemistry,1992,267:18148-18153.
[30]Asada K.Ascorbate peroxidase:A hydrogen peroxide scavenging enzyme in plants,Physiologia[J].Plantarum,1992,85(2):235-241.
[31]Shigeoka S,Nakano Y,Kitaoka S.Purification and some properties of L-ascorbic acid peroxidase inEuglenagracilisZ[J].Archives of Biochemistry and Biophysics,1980,201(1):121-127.
[32]管清杰,李琳,高野哲夫.朝鲜碱茅抗坏血酸过氧化物酶的基因克隆和表达[J].基因组学与应用生物学,2009,28(4):631-639.
[33]Song F N,Yang C P,Liu X M.Effect of salt stress on activity of superoxide dismutase(SOD)inUlmuspumilaL[J].Journal of Forestry Research,2006,17(1):13-16.
[34]张海娜,李小娟,李存东.过量表达小麦超氧化物歧化酶(SOD)基因对烟草耐盐能力的影响[J].作物学报,2008,34(8):1403-1408.
[35]Alscher R G,Erturk N,Heath L S.Role of super oxide dismutases(SODs)in controlling oxidative stress in Plants[J].Journal of Experimental Botany,2002,53:1331-1341.
[36]吴建慧,高野哲夫,柳参奎.碱茅(Puccinelliatenuifolra)Put-Cu/Zn-SOD基因的克隆及在酵母中的表达[J].基因组学与应用生物学,2009,28(1):10-14.
[37]Ward J M,Hirsi K D.Plants pass the salt[J].Trends in Plant Science,2003,8(5):200-201.
[38]Teste R M,Daenport R.Na+tolerance and Na+transport in higher plants[J].Annals of Botany,2003,91(5):503-527.
[39]Blumwald E,Aharon G S,Apse M P.Sodium transport in plant cells[J].Biochimica et Biophysica Acta,2000,1465:145-151.
[40]程玉祥.星星草质膜型Na+/H+逆向转运蛋白基因的克隆和特性分析[J].植物生理学通讯,2008,44(1):59-64.
[41]程玉祥.过量表达星星草PtSOS1提高拟南芥的耐盐性[J].植物生理学通讯,2008,44(6):1125-1130.
[42]Kendal D,Hirschi,Victor D.Expression of Arabidopsis CAX2 in tobacco altered metal accumulation and increased manganese tolerance1[J].Plant Physiology,2000,124:125-134.
[43]Takehiro K,Masayoshi M.Residues in internal repeats of the rice cation/H+exchanger are involved in the transport and selection of cations[J].The Journal of Biological Chemistry,2004,279:812-819.
[44]Liu H,Zhang X X,Takan T.Characterization of aPutCAX1 gene fromPuccinelliatenuiflorathat confers Ca2+and Ba2+tolerance in yeast[J].Biochemieal and Biology Physieal Research Communieations,2009,383:392-396.
[45]Arciadeb G,Nme S,Uelosma B.Sodium transport and HKT transporters:The rice model[J].Plant Journal,2003,34(6):788-801.
[46]Aser P M,Sooy H O,Shimas G O.Glycine residues in potassium channel-likes electivity filters determine potassiums electivity in four-loopper-subunit HKT transporters from plants[J].Proceedings of the National Academy of Sciences of the united states of america,2002,99(9):6428-6433.
[47]Ardie S W,Xie L,Takahashi R.Cloning of a high-affinity K+transporter genePutHKT2;1 fromPuccinelliatenuifioraand its functional comparison withOsHKT2;1 from rice in yeast and Arabidopsis[J].Journal of Experimental Botany,2009,12:1-12.
[48]Zhang C Q,Nishiuchi S,Liu S K.Characterization of two plasma membrane protein 3 genes(PutPMP3)from the alkali grass,Puccinelliatenuiflora,and functional comparison of the rice homologues,OsLti6a/b from rice[J].Biochemistry and Molecular Biology reports,2008,41(6):448-454.
[49]Moons A,Gielen J,Vandekerckhove J.An abscisic-acid and salt stress responsive rice cDNA from a novel plant gene family[J].Planta,1997,202(4):443-454.
[50]Huang M D,Wu W L.Over expression of TMAC2,an ovel negative regulator of abscisic acid and salinity responses,haspleio tropic effects inArabidopsisthaliana[J].Plant Molecular Biology,2007,63(4):557-569.
[51]于雪飞,杨传平.碱茅(Puccinelliatenuiflora)Put-R40g3基因的分离及其与逆境的应答[J].分子植物育种,2009,7(2):251-256.
[52]Botella J R,Arteca J M,Somodevill A M.Calcium-dependent protein kinase gene expression in response to physical and chemical stimuli in Mungbean(Vignaradiata)[J].Plant Molecular Biology,1996,30:1129-1137.
[53]Zhu J K.Genetic analysis of plant salt tolerance using Arabidopsis[J].Plant Physion,2000,124:941-948.
[54]Jona K C,Okresz L,Bogre L.Complexity,cross talk and integration of plant MAP kinase signaling[J].Current Opinion in Plant Biology,2002,5:415-424.
[55]Zhang S Q,Daniel F.MAPKcascades in plant defense signaling[J].Trends in Plant Science,2001,6(11):520-527.
[56]Hackett R M,Oh S A,Morris P C.A tomato MAP kinase kinase gene differentially regulated during fruit development leaf senscence and wounding[J].Plant Physiology,1998,117:1526-1531.
[57]刘桂丰,褚延广,王玉成.cDNA微阵列技术研究Na HCO3胁迫下星星草基因表达谱[J].西北植物学报,2005,25(5):887-892.
[58]Wang Y C,Yang C P,Liu G F.Microarray and suppression subtractive hybridization analyses of gene expression inPuccinelliatenuifioraafter exposure to Na HCO3[J].Plant Science,2007,173:309-320.
[59]Wang Y C,Yang C P,Liu G F.Development of a cDNA microarray to identify gene expression ofPuccinelliatenuifioraunder salineealkali stress[J].Plant Physiology and Biochemistry,2007,45:567-576.
[60]Wang Y C,Yang C P,Liu G F.Identification of expressed sequence tags in an alkali grass(Puccinelliatenuifiora)cDNA library[J].Journal of Plant Physiology,2007,164:78-89.
[61]周学丽,周青平,颜红波,等.NaCl胁迫对同德小花碱茅苗期生理特性的影响[J].草业科学,2009,26(6):101-105.
[62]张一弓,张丽静,傅华.植物维生素E合成酶基因克隆及其逆境生理研究进展[J].草业学报,2009,18(5):235-242.
[63]梁哲,姜三杰,未丽,等.三叶草基因工程研究进展[J].草业学报,2009,18(2):205-211.
[64]郑轶琦,刘建秀.草坪草分子遗传图谱的构建与应用研究进展[J].草业学报,2009,18(1):155-162.

