兔视网膜挫伤后视网膜神经上皮水通道蛋白4的表达
付 群 师学伟 李 爽 王志玉 任芳芳
1 新乡医学院第三附属医院眼科(453000)
2 焦作市五官医院(454000)
3 新乡市中心医院(453000)
4 福建省宁德市闽东医院(355000)
视网膜挫伤是指眼部受到钝性外力击打所引起的视网膜损伤,其主要表现是急性视力损害和视网膜水肿、变性、出血、坏死,其发病机制尚未完全明了[1]。水通道蛋白4(aquaporin-4,AQP-4)在机体中介导各种类型细胞膜的水转运[2],在眼部也有广泛分布[3]。本文通过对实验性兔视网膜挫伤后不同时间段视网膜神经上皮AQP-4表达特点进行观察,以期进一步了解视网膜挫伤的发病机制。现报道研究结果如下。
1 材料与方法
1.1 仪器设备和试剂
Olympus光学显微镜;普通电冰箱(新飞电器集团);恒温培养箱(苏州医疗仪器厂);恒温电热烤箱(苏州医疗仪器厂);1/100000电子天平(上海光学仪器厂);图象分析系统(美国Media Cybernetics 公司);AQP-4试剂盒(北京博奥森公司);其他试剂均为国产分析纯级;生理盐水为医用无菌制剂。
1.2 动物分组及模型制作
1.2.1 动物与分组
健康无眼疾成年大白兔42只(二级,新乡医学院动物中心提供),体质量2~2.5kg,雄雌兼用;饲养条件:开放系统,温度18~29℃,日温差≤3℃,相对湿度为40%~70%,换气量12次/h,氨气浓度≤14mg/m3,噪声≤30dB,工作照度约200Ix,昼夜明暗交替时间12h/12h,普通饮水和全价饲料喂养。外眼及眼底检查正常,选取右眼为致伤眼;随机(随机数字表法)分为挫伤后1h组、3h组、1d组、3d组、7d组、14d组和正常对照组共7组,各组均为6只。
1.2.2 视网膜挫伤模型制作
王志玉等[4]改良重击法,致伤能量约为2.87 J(E=mgh)。所有造模由同一操作者序贯完成。
1.2.3 眼部伤情观察
实验家兔均在同一条件、不同时间点进行眼部伤情观察,检查眼球位置、结膜、角膜、前房、瞳孔、晶状体、玻璃体和视网膜;眼底检查是在用散瞳剂充分散瞳后用直接检眼镜对包括周边部在内的眼底结构进行细致的检查。眼部检查由同一名高年资眼科医师完成。
1.2.4 动物模型制作成功的判断
伤眼直接对光反应迟钝,瞳孔散大;检眼镜观察眼底可见视网膜乳白色混浊、水肿范围较大,同时伴有眼底出血,即认为模型制作成功,纳入实验。制模后结膜囊内涂红霉素眼膏。
1.3 标本制备和视网膜AQP-4表达检测
在规定时间点经由耳缘静脉空气栓塞处死各挫伤组兔子;于14d按上法处死正常对照组受试兔子;处死受试兔子后,迅速摘除受试眼球,置于冰台上,修剪眼球表面的多余组织,0~4℃生理盐水冲洗3次,沿角巩膜缘后3~5mm处环形剪开眼球,剪除眼前节(角膜、虹膜、晶状体等)和玻璃体,翻转眼球壁使视网膜暴露于表面,用吸耳球沿视网膜周边部吹打视网膜表面,这样视网膜神经上皮层将脱离起来,此时可轻松剥取视网膜。然后按照AQP-4试剂盒说明书要求由专人严格操作;AQP-4表达以细胞膜呈不同程度的棕黄色为阳性,阴性结果无棕黄色表达。结果用图象分析处理系统测量灰度值;每个标本任意选择15个视野来检测阳性表达细胞的灰度值:灰度值高表示AQP-4含量高,灰度值低表示AQP-4含量低。AQP-4灰度值以±s表示。
1.4 数据处理
采用SPSS13.0统计软件包进行数据统计学处理;致伤组与对照组间均值的两两比较用t检验,致伤组各组间的差异分析用单因素方差分析(F检验),为双侧检验;检验水准α=0.05。
2 结 果
AQP-4在各组家兔视网膜神经上皮均有表达,阳性表达主要见于面对视网膜血管的神经胶质细胞突起,见图1~图7。
与正常对照组相比较,AQP-4的表达在视网膜挫伤后1h组(t=9.407,P<0.01)、3h组(t=6.653,P<0.01)、24h组(t=7.249,P<0.01)、3d组(t=4.556,P<0.01)、7d组(t=3.724,P<0.01)和14d组(t=2.268,P<0.05)均明显升高;视网膜神经上皮AQP-4表达在视网膜挫伤后也呈现动态变化:伤后1h组即高于对照组(t=9.407,P<0.01),3h组明显升高,24h组AQP-4表达最强,3d组AQP-4表达已经明显下降,挫伤后7d组表达下降更为明显,14d组AQP-4表达仍高于正常对照组(t=2.268,P<0.05);各个挫伤组AQP-4表达也存在明显差异(F=12.692,P<0.05),见表1和图8。
图1 正常对照组 在神经节细胞层和内核层可见散在的阳性细胞(SABC,×200)

图2 伤后1h 在神经节细胞层和内核层的阳性细胞数增多(SABC,×200)
图3 伤后3h 在神经节细胞层和内核层的阳性细胞数进一步增多(SABC,×200)

图4 伤后24h 在神经节细胞层和内核层的阳性细胞数明显增多(SABC,×200)
3 讨 论

图5 伤后3d 在神经节细胞层和内核层的阳性细胞数减少(SABC,×200)

图6 伤后7d 在神经节细胞层和内核层的阳性细胞数明显减少(SABC,×200)

图7 伤后14d 在神经节细胞层和内核层的阳性细胞数明显减少,但是依然比正常组高(SABC,×200)

表1 视网膜神经上皮层AQP-4表达(灰度值)
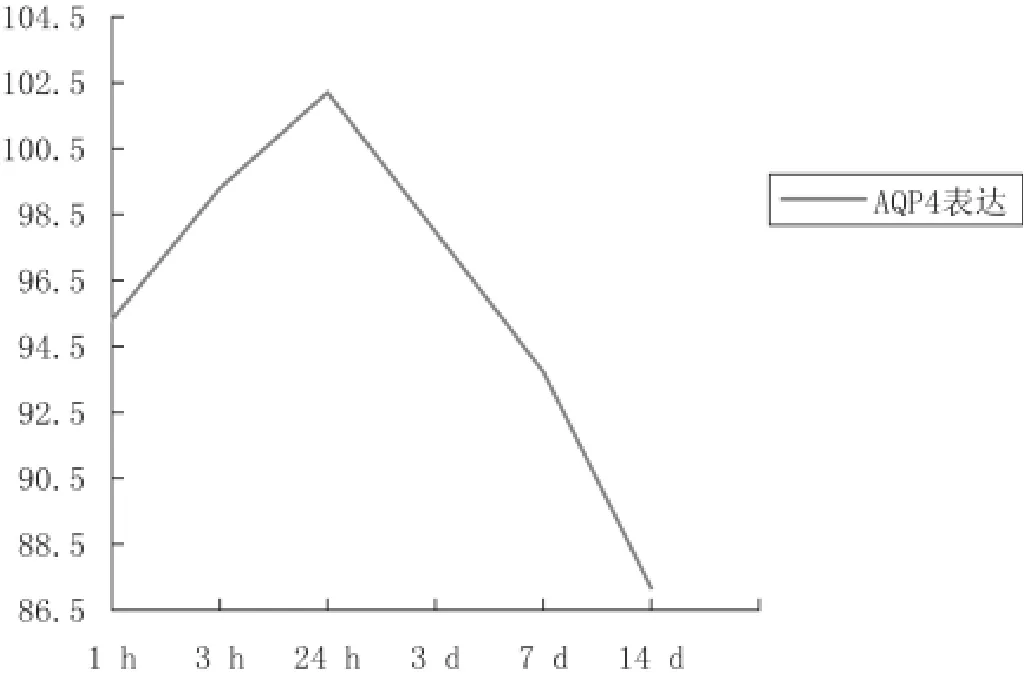
图8 视网膜挫伤后视网膜神经上皮层AQP-4表达动态变化
视网膜挫伤是导致眼外伤后视力丧失的主要原因之一,目前对视网膜挫伤后的临床表现已经有了较充分的认识,但其发病机制并未完全明了,研究表明视网膜挫伤后会发生水肿,并且视网膜水肿是动态变化的[1]。
AQP-4在眼部有广泛的分布,介导各种类型细胞膜的水转运;AQP-4在视网膜上的表达最强,整个视网膜均可见 AQP-4阳性表达,特别是在外丛状层、内核层、神经节细胞层AQP-4表达更明显[3,5,6]。Hamann等[7]用免疫印迹、免疫电镜证实 AQP-4主要表达于视网膜Müller细胞和星形胶质细胞,定量分析发现AQP-4在视网膜Müller细胞足突膜较非足突膜有高浓度的表达。眼组织AQP-4的调节机制尚不十分清楚,早先认为大多数AQP以固有的活性状态存在于所分布的组织中,无需门控和调节,但后来很多实验表明,在分子和基因水平还是存在着组织特异性调节,调节AQP的因素包括激素、神经递质及细胞因子等[2,3,8-10]。本研究观察到视网膜神经上皮层有AQP-4表达,并且AQP-4的表达在视网膜挫伤后呈现动态变化:在挫伤后1h AQP-4表达升高,挫伤后3h AQP-4表达升高明显,挫伤后24h AQP-4表达最强,挫伤后3d AQP-4表达较前明显下降,挫伤7d后AQP-4表达下降更为明显,但3d组和7d组AQP-4表达仍高于正常对照组;挫伤14d后AQP-4表达也未完全恢复正常;而先前的研究提示视网膜挫伤后视网膜会发生水肿,并且视网膜水肿也是动态变化的[1];因此,推测挫伤后视网膜神经上皮层AQP-4表达的动态变化和视网膜水肿的动态变化存在一定相关性。AQP-4在视网膜水肿中的变化是功能方面的作用,还是一种附带现象,暂不能下定论。因此,AQP-4抑制剂的研发应用非常有意义。AQP-4的作用可能是双方面的,它可能导致视网膜水肿的形成和发展,也可能起到保护作用。因此,这又为我们临床治疗提供了新的线索。AQP-4是水分子向细胞外转移的直接通路或载体[11],是胶质细胞和血管之间的水调节和运输的重要结构基础,以AQP-4作为治疗的靶向,可能在防止视网膜水肿的发生发展具有一定的指导价值。目前对AQP-4与挫伤性视网膜水肿的研究还非常少,而临床资料十分有限,这需要广大学者共同去研究。
本研究仅仅是一个开端。在进行图像分析时,由于是任意选择15个视野来估计阳性表达细胞的灰度值,这样也会造成很大的差别,对实验结果也会有影响。因此,本研究还将进一步探讨AQP-4在视网膜挫伤发病机制上的意义。
[1]付群,王志玉.实验性兔视网膜挫伤后不同时段的视网膜厚度研究[J].临床眼科杂志,2008,16(3):262-264.
[2]宁巧明,王祥瑞.水通道蛋白的研究进展[J].国外医学泌尿系统分册,2005,26(5):271-272.
[3]徐春玲,宋跃.眼与水通道蛋白的研究进展[J].眼科新进展,2001,21(2):130-133.
[4]王志玉,付群,史爱云.视网膜挫伤后神经感觉层细胞凋亡的实验研究[J].眼科新进展,2008,28(8):590-594.
[5]Sipperley JQ,Quigley HA,Hass JDM. Traumatic Retinopathy of Prematurity in Primates the explanation of commotio retinae[J].Arch Ophthalmol,1998,96(12):2267-2273.
[6]Hiroaki Y,Tani K,Kamegawa A,et al. Implications of the Aquaporin-4 Structure on Array Formation and Cell Adhesion[J]. J Mol Biol,2006,355(4): 628-639.
[7]Hamann S,Zeuthen T,La CM,et al. Aquaporins in complex tissue:distribution of aquaporins 1-5 in human and tar eye[J]. Am J Physiol,1998,272(Cell Physiology,43):C1332.
[8]Li J,Patil RV,Verkman AS. Mildly Abnormal Retinal Fuction in Transgenic Mice without Muller Cell Aquaporin-4 Water Channels[J].Invest Ophthalmol Vis Sci,2002,43(2): 573-578.
[9]Da T,Verkman AS. Aquaporin-4 Gene Disruption in Mice Protects against Impaired Retinal Function and Cell Death[J]. Invest Ophthalmol Vis Sci,2004,45(12):4477-4481.
[10]李莉,葛坚.水通道蛋白与眼病[J].国外医学眼科学分册,2001,25(2):69-73.
[11]崔向宁,伊岭.水通道蛋白4在大鼠创伤性脑水肿中的作用机制[J].中国康复理论与实践,2005,11(9):720-722.

