气相色谱法测定磁性脂质体中有机溶剂残留量
张 宏,卢婷利,赵 雯,陈 涛,2
(1.西北工业大学生命学院 空间生物实验模拟技术国防重点学科实验室,陕西 西安 710072; 2.陕西脂质体工程技术研究中心,陕西 西安 710075)
磁性脂质体(Magnetic liposome)是磁导向药物递送系统中的一种新型药物导向载体,是将磁性粒子结合在载药脂质体中,当其进入体内后,利用体外磁场的作用引导其在体内定向移动,集中到靶部位后释放药物,从而避免药物对正常组织的伤害,使其靶向性和专一性更强,达到快速、高效、低毒的效果[1,2]。目前磁性脂质体多用于肿瘤治疗,除可以实现低毒、靶向、缓释外,在外加交变磁场的作用下,利用磁性粒子发热进行热疗,使肿瘤组织细胞升温至42~47℃,进一步消灭肿瘤细胞[3~5]。
乙醇和氯仿是制备磁性脂质体中溶解脂质膜材经常使用的有机溶剂,若不除去会严重影响磁性脂质体的使用安全性,因此应保证乙醇和氯仿在磁性脂质体中的残留量低于规定的0.5%和0.006%[6]。磁性脂质体制备过程中一般采用旋转蒸发、真空干燥、抽真空等方法来除去有机溶剂[2,7,8]。脂质体中乙醇和氯仿残留量的气相色谱检测法已有报道[9,10],均采用外标法,虽然操作简单、方便,但是受仪器和操作的影响误差较大,且不能同时检测两种残留物。
作者在此采用内标法同时、定量测定磁性脂质体中乙醇和氯仿残留量,结果令人满意。
1 实验
1.1 试剂与仪器
磁性脂质体,自制;无水乙醇、二甲基甲酰胺(DMF)、三氯甲烷,色谱纯;二氯甲烷,分析纯。
Agilent 6890型气相色谱仪,美国Agilent公司;氢火焰离子化检测器(FID),高纯氢气(99.99%),高纯氮气(99.99%),钢瓶空气;磁分离架,吉林蓝罡生物科技有限公司。
1.2 溶液的配制
(1)内标储备液的配制
精密称取二氯甲烷0.1271 g,置于500 mL容量瓶中,加DMF定容至刻度,即为内标储备液。
(2)对照品溶液的配制
精密称取乙醇3.7371 g、氯仿0.2952 g,分别置于500 mL容量瓶中,加DMF定容至刻度,摇匀,即为对照品储备液。分别取上述对照品储备液1 mL和内标储备液1 mL,置于10 mL容量瓶中,加DMF定容至刻度,摇匀,即为对照品溶液。
(3)样品溶液的制备
量取磁性脂质体1 mL,加入2 mLDMF破乳,用磁分离架将磁性粒子分离,量取1 mL澄清液于10 mL容量瓶中,加入1 mL内标储备液,加DMF定容至刻度,摇匀,即得磁性脂质体样品溶液。
1.3 色谱条件
色谱柱:Agilent HP-5型毛细管柱(30 m×0.32 mm,0.5 μm);检测器为FID;载气为氮气;分流比为20∶1;柱流量为15 cm·s-1,恒流;进样量为1.0 μL;进样口温度为170℃;检测器温度为250℃。色谱柱程序升温方法为:35℃保持2 min;25℃· min-1升温到90℃,保持5 min;60℃· min-1升温到200℃,保持5 min。
2 结果与讨论
2.1 保留时间和检测限的确定
量取对照品溶液1 mL,按色谱条件进样检测,色谱图如图1所示。
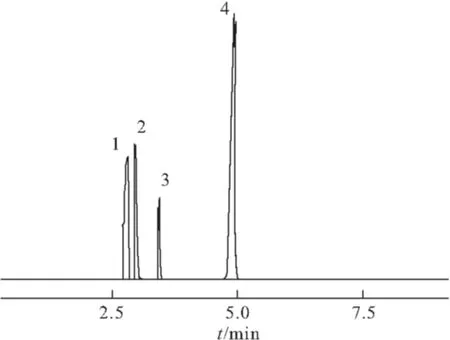
1.乙醇 2. 二氯甲烷 3.氯仿 4.DMF
由图1可以看出,乙醇、二氯甲烷、氯仿和DMF的分离度良好,保留时间分别为2.688 min、3.060 min、3.456 min和4.876 min。
通过逐级降低浓度,进样测定,确定检测限,信噪比为3∶1。结果表明,乙醇、二氯甲烷和氯仿的最低检测浓度分别为0.10 μg·mL-1、0.07 μg·mL-1和0.05 μg·mL-1。
2.2 线性关系考察
分别精密量取对照品储备液100 μL、200 μL、400 μL、600 μL、800 μL、1000 μL、1500 μL,置于10 mL容量瓶中,每个容量瓶中分别加入1 mL内标储备液,用DMF定容至刻度,分别进样1.0 μL,记录色谱图,并测定峰面积。结果表明,在所测浓度范围内,乙醇(7.47~112.11 μg·mL-1)和氯仿(0.59~8.85 μg·mL-1)的浓度与峰面积/内标峰面积具有良好的线性关系,回归方程如下:
乙醇:y=1.2162c-0.10513R=0.9996(n=7)
氯仿:y=0.6739c-0.1003R=0.9997(n=7)
2.3 精密度实验
取对照品溶液,重复进样5次,进样量为1.0 μL,测得乙醇与氯仿和二氯甲烷的峰面积比的RSD分别为0.96%、1.33%,表明方法精密度良好。
2.4 回收率实验
采用加样回收率测定方法,按高、中、低浓度分别精密量取一定量的对照品储备液加入到已知氯仿残留量的1 mL磁性脂质体中,按“样品溶液的制备”方法处理,分别进样3次,结果见表1。

表1 回收率实验结果(n=9)
由表1可知,乙醇和氯仿的平均回收率分别为98.2%和97.3%,RSD≤3.0%(n=9),表明方法准确可靠。
2.5 样品测定
精密吸取3个不同批次(100515,100521,100601)的磁性脂质体样品,得到3个脂质体样品溶液,每个样品测3次,进样量1.0 μL,测定峰面积,根据回归方程计算含量,结果见表2。
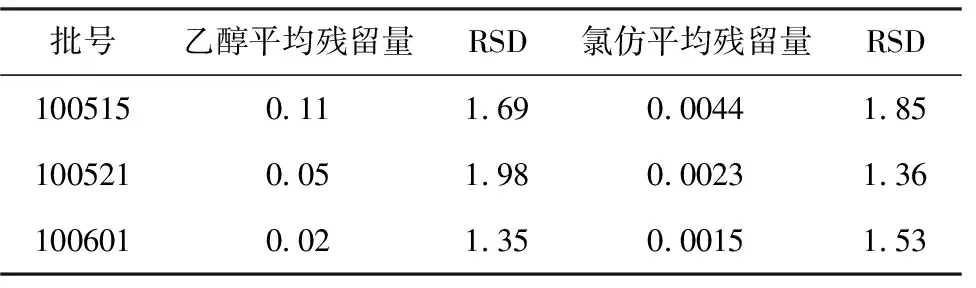
表2 样品含量测定结果/%
由表2可知,该方法可以准确测定磁性脂质体中乙醇和氯仿的残留量,并且所测样品的残留量符合相关规定要求。
2.6 讨论
2.6.1 溶剂选择
由于进样前需要将阿霉素磁性脂质体中的磁性粒子分离,所以选择有机试剂作为溶剂将脂质体破乳。实验发现,乙醚、甲苯等低沸点溶剂均不能很好地将样品破乳,而二甲基甲酰胺沸点较高,采用顶空进样法操作不便。因此,本实验采用直接进样法同时检测乙醇和氯仿的残留量。
2.6.2 色谱柱的选择
比较了乙醇、氯仿和二甲基甲酰胺在不同色谱柱(HP-5、HP-INNOWAX和DB-1701)下的分离度。结果表明,采用HP-5的分离度最高。
2.6.3 内标物的选择
由于磁性脂质体在制备过程中经过旋转蒸发和抽真空,乙醇和氯仿的残留量都较少,因此本实验采用内标法定量以减少仪器和操作带来的误差。经过对多种有机试剂进行筛选,其中二氯甲烷、乙醇、氯仿、二甲基甲酰胺的分离度均良好,最终选择二氯甲烷作为内标物。
3 结论
建立了气相色谱法(内标法)检测磁性脂质体中有机溶剂残留量的方法,乙醇和氯仿在所测范围内线性关系良好(R>0.9995,n=7),回收率高,重复性好。该法简单、快捷、精密可靠,适于磁性脂质体中乙醇和氯仿有机溶剂残留量的定量检测。
[1] Ito A,Akiyama H,Kawabe Y,et al. Magnetic force-based cell patterning using Arg-Gly-Asp (RGD) peptide-conjugated magnetite cationic liposomes[J]. Biosci Bioeng,2007,104(4):288-293.
[2] Martina M S,Fortin J P,Menager C,et al. Generation of superparamagnetic liposomes revealed as highly efficient MRI contrast agents forinvivoimaging[J]. J Am Chem Soc,2005,127(30): 10676-10685.
[3] Hamaguchi S,Tohnai I,Ito A,et a1. Selective hyperthermia using magnetoliposomes to target cervical lymph node metastasis in a rabbit tongue tumor model[J]. Cancer Sci,2003,94(9):834-837.
[4] Kawai N,Ito A,Nakahara Y,et al. Anticancer effect of hyperthermia on Prostate cancer medated by magnetite cationic liposomes and immune-response induction in transplanted syngeneic rats[J]. Prostate,2005,64(4):373-381.
[5] Matsuoka F,Shinkai M,Honda H,et al. Hyperthermia using magnetite cationic liposomes for hamster osteosarcoma[J]. Biomagnetic Res Techn,2004,2(1):3-8.
[6] 国家药典委员会.中国药典二部[M].北京:化学工业出版社,2005:附录Ⅷ54-57.
[7] 朱盛山.药物新制剂[M].北京:化学工业出版社,2005:2430-2437.
[8] Venkateswarlu V,Manjunath K. Preparation characterization andinvitrorelease kinetics of clozapine solid lipid nanoparticles[J]. Journal of Controlled Release,2004,95(5):627-638.
[9] 官东秀,冯祚臻,邓莲芬,等.气相色谱法测定冬虫夏草多糖脂质体口服液中氯仿残留量[J].中国医院药学杂志,2005,25(2):144-145.
[10] 傅经国,陈涛,穆国平,等.脂质体乙醇残留的气相色谱分析[J].药物分析杂志,2003,3(增刊):4-6.

