紫玉米花青素的提取方法对比研究
贾士芳,董洪霞,董树亭
(1.太原科技大学化学与生物工程学院,山西 太原 030021;2.山东农业大学作物生物学国家重点实验室,山东 泰安 271018;3.上饶师范学院化学化工学院,江西 上饶 334001)
色素是独特而又关键的食品组分之一[1],分为合成色素和天然色素两大类,其中天然色素以“天然、营养、多功能”等特点越来越受到科研领域的关注[2]。
在我国,黑糯玉米及紫玉米是各地区大量种植的一种作物,但利用程度较低。因此,利用黑糯玉米和紫玉米提取天然色素不仅可避免资源浪费、保护环境、满足市场需求,还可提升玉米的附加值及综合利用效率。
目前,玉米色素的提取多采用热水浸提法或直接酸解法,这两种方法色素得率低、操作费时、能耗大[3~6]。近年来,超声波、微波等辅助提取方法逐渐应用于玉米色素的提取[7,8],这两种方法操作简单、省时节能。作者在此以紫玉米穗轴为原料,对热水浸提法、直接酸解法、超声波辅助法、微波辅助法提取紫玉米花青素进行了比较,并对其工艺条件进行优化。
1 实验
1.1 材料、试剂与仪器
紫玉米穗轴烘干至恒重后放入粉碎机中破碎至40~80目,密封,备用。
盐酸、无水乙醇等均为分析纯;标准品均购自Sigma 公司。
微型植物试样粉碎机,上海市嘉定粮油检测仪器厂;202型电热恒温鼓风干燥箱,上海跃进医疗器械厂;722型可见分光光度计,上海精密科学仪器有限公司;FA2104S型电子分析天平,上海金鹏分析仪器有限公司;SB120D型超声波破碎器,昆山市超声仪器有限公司;RE-52A型旋转蒸发仪,上海青浦沪西仪器厂;PHS-3C型酸度计,金坛市科兴仪器厂; DZKW-S-6型电热恒温水浴锅,北京永光明医疗仪器厂;WD700ATL17-3 电脑型微波炉,格兰仕电器公司;GL-21B型离心机,上海安亭科学仪器总厂。
1.2 方法
紫玉米穗轴样品→热水浸提/直接酸解浸提/超声波辅助浸提/微波辅助浸提→离心(4500 r·min-1,30 min)→取上清液→旋转蒸发浓缩→干燥→色素粗提物→稀释→测定花青素质量。按下式计算花青素得率。
2 结果与讨论
2.1 热水浸提法提取紫玉米花青素
2.1.1 提取温度对紫玉米花青素得率的影响(表1)

表1 提取温度对紫玉米花青素得率的影响
由表1可知,花青素得率随提取温度的升高不断上升;当提取温度超过65℃后,花青素得率反而下降。这可能是因为,温度升高,溶液的扩散速率加快,细胞内的色素物质向外扩散加速,但温度过高会破坏花青素的结构、增加水溶性杂蛋白质和植物胶含量,从而导致干燥提纯成本增加。因此,提取温度以65℃为宜。
2.1.2 提取时间对紫玉米花青素得率的影响(表2)

表2 提取时间对紫玉米花青素得率的影响
由表2可知,紫玉米花青素得率随提取时间的延长不断上升;当提取时间为12 h时,得率最大;之后,继续延长提取时间,得率变化不大。因此,提取时间以12 h 为宜。
2.1.3 料液比对紫玉米花青素得率的影响(表3)

表3 料液比对紫玉米花青素得率的影响
由表3可知,花青素得率随溶剂量的增加逐渐上升,当料液比达到1∶15后,花青素得率趋于稳定。这是因为,溶剂量越大,穗轴粉末分散越均匀,浸提越充分,花青素得率越大;但溶剂量过大,会给后续干燥提纯带来不便。因此,料液比以1∶15 为宜。
2.2 直接酸解法提取紫玉米花青素
2.2.1 提取剂对紫玉米花青素得率的影响(表4)

表4 提取剂对紫玉米花青素得率的影响
由表4可知,复合提取剂的花青素得率均高于单一提取剂,且提取剂为0.1 mol·L-1HCl∶95%乙醇=1∶1(体积比)时得率最大。这可能是因为,花青素易溶于极性溶剂,且乙醇可以有效沉淀果胶、蛋白质等杂质。因此,确定适宜提取剂为0.1 mol·L-1HCl∶95%乙醇= 1∶1。
2.2.2 提取时间对紫玉米花青素得率的影响(表5)

表5 提取时间对紫玉米花青素得率的影响
由表5 可知,随着提取时间的延长,花青素得率迅速升高,5 h后得率升幅趋缓,至6 h时,达到最大值。但浸提时间过长时,会使花青素受到光热等因素的影响发生分解。因此,确定适宜提取时间为6 h。
2.2.3 提取温度对紫玉米花青素得率的影响(表6)
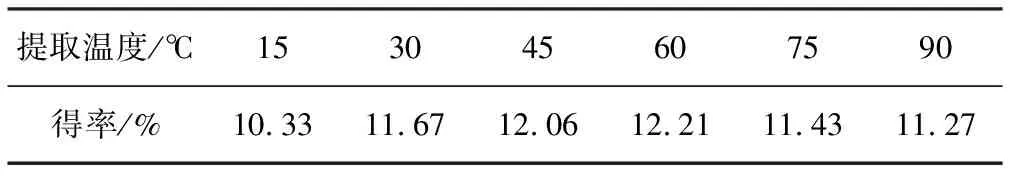
表6 提取温度对紫玉米花青素得率的影响
由表6可知,花青素得率随提取温度的升高迅速升高;提取温度达到30℃后,升幅趋缓,60℃时花青素得率达到最大;之后继续升高提取温度,得率反而降低。这可能是由于温度过高时,某些糖苷降解,致使花青素含量降低,得率下降。因此,确定适宜提取温度为60℃。
2.3 超声波辅助法提取紫玉米花青素
基于单因素实验结果(另文发表),选择超声波辅助提取温度为40℃,以超声波功率、超声波辐射时间以及液料比为考察因素,进行3因素3水平L9(33)正交实验,以优化超声波辅助法提取紫玉米花青素的工艺条件,其结果与分析见表7。
由表7可知,各因素对紫玉米花青素得率的影响大小依次为:超声波辐射时间>液料比>超声波功率,最佳工艺条件为A2B2C3,即超声波功率200 W、超声波辐射时间40 min、液料比25∶1。
2.4 微波辅助法提取紫玉米花青素
基于单因素实验结果(另文发表),选择微波辅助提取温度为60℃,以微波功率、微波辐射时间以及液料比为考察因素,进行3因素3水平L9(33)正交实验,以优化微波辅助法提取紫玉米花青素的工艺条件,其结果与分析见表8。

表7 超声波辅助法正交实验结果与分析

表8 微波辅助法正交实验结果与分析
由表8可知,各因素对紫玉米花青素得率影响大小依次为:微波功率>微波辐射时间>液料比,最佳工艺条件为A2B3C2,即微波功率700 W、微波辐射时间6 min、液料比20∶1。验证实验结果表明,按照工艺条件A2B3C2所得紫玉米花青素得率为16.78%,高于正交实验中最高的16.53%,表明最佳工艺条件确为A2B3C2。
2.5 提取方法的比较(表9)

表9 4 种提取方法的比较
由表9 可知,与传统的热水浸提法和直接酸解法相比,超声波辅助法和微波辅助法均能明显地缩短提取时间、降低提取温度,避免了高温对活性物质的破坏,提高了紫玉米花青素的得率,具有快速、节能、高效的特点,是提取紫玉米花青素的好方法。其中超声波辅助法效果最好,紫玉米花青素得率为18.42%。
3 结论
以紫玉米穗轴为原料,采用热水浸提法、直接酸解法、超声波辅助法和微波辅助法提取紫玉米花青素。结果表明,热水浸提法、直接酸解法、超声波辅助法和微波辅助法提取紫玉米花青素的得率分别为7.85%、12.17%、18.42%、16.78%。与传统方法相比,超声波辅助法和微波辅助法提取紫玉米花青素具有快速、节能、高效等优点。
[1] 王桃云,王飞,万承永.我国天然植物色素研究与开发初探[J].浙江林业科技,2001,21(2):71-73,77.
[2] 乔华,张生万,李美萍,等.天然色素稳定性研究及其新的类型划分[J].食品科学,2006,27(9):69-73.
[3] 徐燕,徐茜,余鸿燕,等.紫色玉米穗轴色素的提取及其稳定性研究[J].玉米科学,2006,14(5):166-169.
[4] 崔丽娜,董树亭,高荣岐,等.玉米籽粒花色苷色素提取方法研究[J].山东农业科学,2008,(7):84-86,96.
[5] 王霞,高云.黑甜玉米中黑色素提取及纯化工艺研究[J].食品科学,2004,25(11):198-199.
[6] 盛玮,薛建平,谢笔钧.超级黑糯玉米色素提取及稳定性研究[J].食品科学,2009,30(4):103-106.
[7] 张钟,刘扬,李凤霞.微波辅助法提取黑糯玉米芯色素的工艺条件优化[J].中国粮油学报,2006,21(6):47-50.
[8] 张吉祥,赵文静,白晓杰,等.正交试验法优化黑米黑色素的超声辅助提取工艺[J].食品科学,2010,31(4):39-41.

