Hemin对全脑缺血大鼠海马迟发型神经元死亡的影响
郭新庆,郭力,郭新明,孙思习,薛爱琴,刘胜,王海蓉,梁邦领,吴穹,
(菏泽医学专科学校,山东 菏泽 274000;1河北医科大学;2附属菏泽市立医院;3青海大学医学院)
Hemin对全脑缺血大鼠海马迟发型神经元死亡的影响
郭新庆,郭力1,郭新明2,孙思习,薛爱琴,刘胜,王海蓉,梁邦领,吴穹3,
(菏泽医学专科学校,山东 菏泽 274000;1河北医科大学;2附属菏泽市立医院;3青海大学医学院)
目的观察Hemin对全脑缺血大鼠海马迟发型神经元死亡的影响。方法24只雄性Wistar大鼠采用4血管闭塞法制造大鼠全脑缺血或再灌注模型,低、高剂量的Hemin于脑缺血后给药,硫堇染色下对海马CA1区锥体神经元的迟发型死亡(DND)进行评估。结果全脑缺血再灌组CA1区发生明显DND。低高剂量Hemin治疗组海马CA1区神经元DND与全脑缺血或再灌组相比未见明显改善(P>0.05)。结论治疗性给予Hemin不能有效发挥对全脑缺血或再灌注大鼠海马的神经保护作用。
神经保护;Hemin;全脑缺血;大鼠;迟发型神经元死亡
脑缺血将会导致神经系统功能障碍,临床上处理的原则是尽早恢复血流再灌注,使缺血的脑组织重新得到氧的供应,以期恢复脑功能。然而血流灌注在一定条件下不仅不能改善脑功能,反而进一步加重了组织损伤和神经功能障碍的程度,称为缺血/再灌注损伤(ischemia reperfusion injury,I/R)。Hemin(C34H32ClFeN4O4)是一种用于治疗贫血的药物,近年研究表明,Hemin在脑缺血缺氧损伤中具有保护作用[1-3]。但Hemin对全脑缺血或再灌注后海马迟发型神经元死亡有何影响,国内未见报道。因此,本实验利用大鼠四血管闭塞全脑缺血再灌模型[4],观察Hemin对大鼠海马CA1区神经元迟发型神经元死亡的影响,从而对治疗性给予Hemin能否对抗全脑缺血或再灌注后海马的损伤作出评价。
1 材料与方法
1.1 实验动物分组与程序 健康雄性Wistar大鼠24只,体重270~320g,由河北医科大学实验动物中心提供。实验前3d将实验动物置于垫料覆盖笼底的鼠笼内,给予充足的水和饲料,待动物适应实验室环境后开始实验。所有动物均首先凝闭双侧椎动脉,2d后选用恢复良好的动物用于实验。将凝闭双侧椎动脉的动物随机分为3组:1)假手术组(sham)(n=6):行全脑缺血的sham手术,即只暴露双侧颈总动脉,不阻断血流。2)全脑缺血或再灌注组(I/R)(n=6):全脑缺血8min后恢复血液再灌流,其它同sham组。3)Hemin干预组(hemin therapy)(n=12):全脑缺血8min恢复血液再灌流后即刻和24h分别腹腔注射Hemin,共2次。根据Hemin的剂量进一步分为30μ mol/kg 、60μ mol/kg 2个亚组 。 其它同 I/R 组 。
每组动物于sham手术或脑缺血后7d取材,采用光镜观察海马组织学分级(histological grade,HG)及神经元密度(neuronal density,ND)。
1.2 试剂 Hemin购于美国 Sigma公司,先用NaOH溶解Hemin,再用磷酸盐缓冲液调节PH值至7.4溶液,浓度为20μ mol/ml。硫堇(分析纯)购于美国Sigma公司。
1.3 大鼠全脑缺血模型的建立 采用四血管闭塞法制造大鼠全脑缺血模型[4]。所有动物均首先进行双侧椎动脉凝闭,方法如下:10%水合氯醛350mg/kg腹腔注射麻醉下,自双耳前缘连线中点向尾侧切口约1.5cm,分离颈旁肌暴露第一颈椎横突,在体视显微镜下寻找翼状孔,将预热的尖端直径约0.5mm的电烙针插入,凝闭双侧椎动脉。术后供以水、食,2d后选用恢复良好的动物制作全脑缺血模型。首先在乙醚吸入麻醉下,游离双侧颈总动脉,待动物清醒后夹闭双侧颈总动脉进行全脑缺血。夹闭颈总动脉期间,大鼠瞳孔散大,翻正反射消失,表明大鼠产生了全脑缺血。Sham手术包括以上所有步骤,但不夹闭颈总动脉。手术及全脑缺血过程中,创口局部施与局麻药(1%普鲁卡因)防止疼痛;室温保持在20℃以上;用白炽灯照射动物以维持其肛温在37℃左右,直到恢复活动。全脑缺血后缝合创口,局部施与庆大霉素预防感染。
1.4 脑组织病理学评价 在预定时间点将动物迅速断头取脑,冠状切取视交叉后1mm至4mm脑组织,将所取标本置于4%多聚甲醛固定液中固定48h,然后0.1mol/L PB洗涤3次,共120min;梯度酒精(70%~100%)脱水共 20~30h;二甲苯透明20~40min,60℃石蜡浸润 4~4.5h,石蜡包埋。将所取脑组织标本常规脑组织切片(5μ m厚),捞于APES玻片上,60℃干燥箱干燥24h,硫堇染色观察海马组织学改变。参照Kitagawa和Kato方法[5],于光学显微镜下,根据 DND的程度,确定组织学分级(Histological grade,HG)和神经元密度(neuronal density,ND),对海马CA1区组织学改变进行评价。1)HG:0级,无神经元死亡;1级,散在神经元死亡;2级,成片神经元死亡;3级,几乎全部的神经元死亡。取双侧平均等级作为统计值。2)ND:计数海马CA1区每1mm区段内细胞膜完整、胞核饱满、核仁清晰的锥体细胞数目,每张切片双侧海马各计数3个区段取平均值作为统计值。
1.5 统计学处理 数据用均数±标准差表示。数据的处理应用SPSS软件进行统计分析。采用单因素方差分析(one way ANOVA)及t检验进行组间比较;组织学分级采用多样本等级资料的秩和检验进行组间比较。
2 结果
2.1 各组大鼠海马CA1区组织学分级结果 sham组大鼠海马CA1区锥体细胞排列整齐,无细胞缺失,细胞形态完整,胞核大而圆,位于细胞中央,核仁清晰,尼氏体丰富,组织学分级(HG)为0~1级。I/R组中,可见明显的组织损伤,表现为海马CA1区锥体细胞稀疏,排列紊乱;残存的锥体细胞体积缩小,呈三角形或不规则形;核膜不完整,染色质碎裂,核仁消失;其周围可见大量细胞碎片;与sham组比较,HG(2~3级)显著升高(P<0.05)。Hemin治疗组中,无论是 30umol/kg、还是60μ mol/kg剂量组,海马CA1区均出现明显的迟发型神经元死亡,HG(2~3级)与I/R组比较无统计学差异(P>0.05),见表 1。
2.2 各组大鼠海马CA1区神经元密度结果 sham组大鼠海马CA1区存活神经元密度(ND)为179.17±6.07(cells/mm)。I/R组中,可见明显的组织损伤,ND为30.99±6.64(cells/mm)。Hemin治疗组中,海马CA1区 ND分别为33.22±5.58(30μ mol/kg 组)、39.23±5.30(60μ mol/kg 组),与 I/R 组比较无统计学差异(P>0.05)。
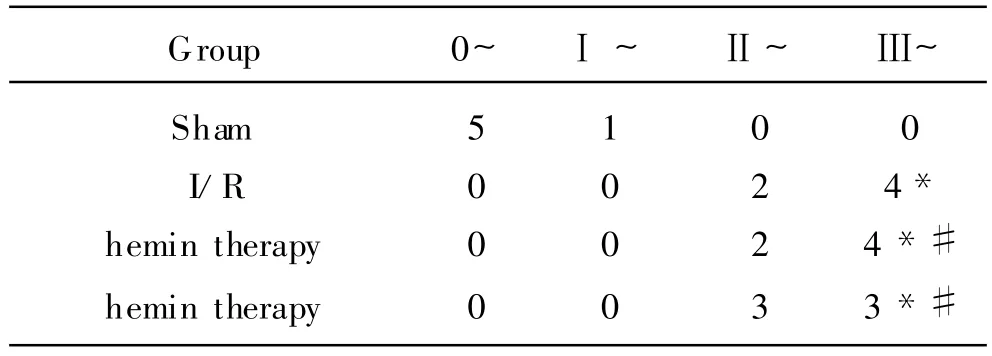
表1 各组大鼠海马 CA1区组织学分级结果(μ mol/kg)
3 讨论
海马组织对缺血性损伤十分敏感,尤其是CA1区锥体神经元[6]并且脑缺血或再灌注时海马CA1区锥体神经元会发生细胞死亡,而其他神经元却不易受到破坏。这种现象在缺血或再灌注后3~4d出现,7d左右逐渐完全,故称为迟发型神经元死亡[7],因此,本实验选择观察脑缺血或再灌注后7d海马CA1区损伤变化。本实验显示:大鼠全脑缺血8min导致海马CA1区神经元密度下降,发生明显的锥体神经元DND,结果与Sun等[8]研究一致。实验发现 30μ mol/kgHemin治疗性给药没有发挥对大鼠海马CA1区神经元的神经保护作用,结果与 Takizawa等[9]研究结果相似,而大剂量60μ mol/kg Hemin治疗性给药也不能减轻全脑缺血打击引起的海马CA1区锥体神经元DND,这表明全脑缺血后应用Hemin不能有效发挥对大鼠全脑缺血模型海马的神经保护作用。
总之,我们的实验结果证实,Hemin治疗性给药不能有效发挥对全脑缺血大鼠海马CA1区神经元的保护作用,而预防性给予Hemin能否对海马CA1区锥体神经元产生有效保护作用,还有待于进一步研究。
[1]刘娟,姚国恩,蒋晓江,等.氯化血红素对大鼠局灶性脑缺血的作用探讨[J].第三军医大学学报,2006,28(10):1035-1037.
[2]Zhang B,Wei X,Cui X,et al.Effects of heme oxygenase 1on brain edema and neurologic outcome after cardionpulmonary resuscitation in rats[J].Anesthesiology,2008,109(2):260-268.
[3]王莉,余刚,向德兵,等.血晶素对缺氧缺糖海马脑片的保护作用及其分子机制[J].西部医学,2009,21(3):357-36.
[4]Pulsinelli W A,Brierley J B.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272.
[5]Kato H,Liu Y,Araki T,et al.Temporal profile of the effects of pretreatment with brief cerebral ischemic on the neuronal damage following secondary ischemic insult in the gerbil:cumulative damage and protective effects[J].Brain Res,1991,553(2):238-242.
[6]Kihara S,Shiraishi T,Nakagawa S,et al.Visualization of DNA double strand breaks in the gebil hipocampus CA1following transient ischemia[J].Neurosci Let,1994,175(1-2):133-136.
[7]Nitatori T,Sato N,Waguri S,et al.Delayed neuronal death in the CA1pyramidal cell layer of the gebil hippocampus following tran-sient ischemis is apoptosic[J].Neurosci,1995,15(2):1001-1003.
[8]Sun X C,Li W B,Li Q J,et al.Limb ischemic pre conditioning induces brain ischemic tolerance via p38MAPK[J].Brain Res,2006,1084:165-174.
[9]Takizawa S,Hirabayashi H,Matsushima K,et al.Induction of heme oxygenase protein protects neurons in cortex and striatum,but not in hippocampus,against transient forebrain ischemia[J].Cereb Blood Flow Metab,1998,18(5):559-69.
The effect of hemin on the CA1neurons in the hippocampus of rats with global cerebral ischemia
GUO Xin-qing,etal
(Heze medical school,Shan Dong Heze,27400,China)
ObjectiveThe study was undertaken to investigate the effect of heminon the CA1neuronsin the hippocampusof rats with global cerebral ischemia.Methods24male Wistar rats were randomly divided into 3groups.Globalbrain ischemia was produced by the fourvesselsocclusion method.The death of neurons was examined with neuropathological evaluation under thionin staining.ResultsThere was obvious DND in the CA1area of the global brainischemia group.Compared with the global brain ischemia group,Hemin therapy group was not any better(P>0.05).ConclusionThe results suggested that therapeutic administration of Hemin in any dosesused had no protective effect on hippocampus of rats with global cerebral ischemia.
Neuronal protective effect;Hemin;Global brain ischemia;Rats;Delayed neuron death
R338.1;R743.31
A
1008-4118(2010)02-0001-03
10.3969/j.issn.1008-4118.2010.02.01
2010-03-02

