复方苦参注射液对肺癌患者化疗后细胞免疫功能的影响
张世强 陈冬波 王保庆 张兰胜 王自全
徐州医学院第二附属医院肿瘤内科,江苏徐州 221006
恶性肿瘤患者机体免疫功能通常发生紊乱,而化疗在杀伤肿瘤细胞的同时对机体免疫功能也造成一定程度的影响[1]。本研究应用流式细胞术对83例肺癌化疗患者外周血中T淋巴细胞亚群及NK细胞活性进行测定,观察静脉滴注复方苦参注射液对肺癌化疗患者外周血细胞免疫功能的影响。
1 资料与方法
1.1 一般资料
选择2009年 8月—2010年 5月本科收治的Ⅲb~Ⅳ期肺癌患者83例,所有病例均经细胞学和组织学病理证实为原发性肺癌,且Karnofsky评分>60分,无其他肿瘤病史以及无严重的可能影响治疗计划按期完成的内科疾病。将患者随机分为观察组和化疗组。观察组39例,其中男27例,女12例,平均年龄42~74岁;鳞癌 15例,腺癌 21例,腺鳞癌 2例,大细胞癌1例,采用化疗联合静脉滴注复方苦参注射液治疗;化疗组44例,其中男29例,女 15例,平均年龄45~69岁;鳞癌17例,腺癌23例,腺鳞癌2例,大细胞癌2例,仅采用常规化疗。两组病例年龄、性别及病理类型经比较,差异无统计学意义(P>0.05),具有可比性。另外选择31例健康人作为对照组,所有研究对象均于清晨抽取空腹静脉血8 ml待检。
1.2 方法
1.2.1 治疗方法 观察组患者于化疗前2~3 d开始用复方苦参注射液20 ml加入0.9%氯化钠250 ml中静脉滴注,每日1次,14 d为1个周期,共治疗3~4个周期。两组患者均采用NP化疗方案。具体如下:长春瑞滨25 mg/m2,第 1天、第8天,静脉滴注;顺铂25 mg/m2,第1天~第3天,静脉滴注。两组化疗期间均辅助相同的止吐及保护胃黏膜药,未使用任何生物反应调节剂或其他对免疫功能有影响的药。
1.2.2 试验方法
1.2.2.1 观察指标 分别抽取肺癌患者和健康人的外周血,观察自然杀伤细胞(NK细胞)活性、T淋巴细胞亚群 CD3+、CD4+、CD4+/CD8+在化疗前后的变化。
1.2.2.2 检测方法 荧光抗体标记所测物,抗体组合为 :CD3-CY5、CD8-PE 和 CD3-FITC 、CD56-PE,避光反应15~20 min,制成单细胞悬液。全血样本先用甲酸溶血,离子强度调节剂调节离子浓度,1.0%多聚甲醛固定,3 000 r/min离心,5 min×2,加生理盐水溶解稀释后上流式细胞仪检测。
1.3 统计学处理
应用SPSS 11.0统计学软件对数据进行统计分析,数据以±s表示,组间比较采用 t检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 化疗前外周血T淋巴细胞亚群及NK细胞活性比较
83例肺癌患者化疗前 CD3+、CD4+、CD4+/CD8+及NK细胞水平均低于健康对照组(P<0.01),差异均具有统计学意义。见表1。
表1 化疗前肺癌组与对照组外周血T淋巴细胞亚群及NK细胞活性比较(%,±s)
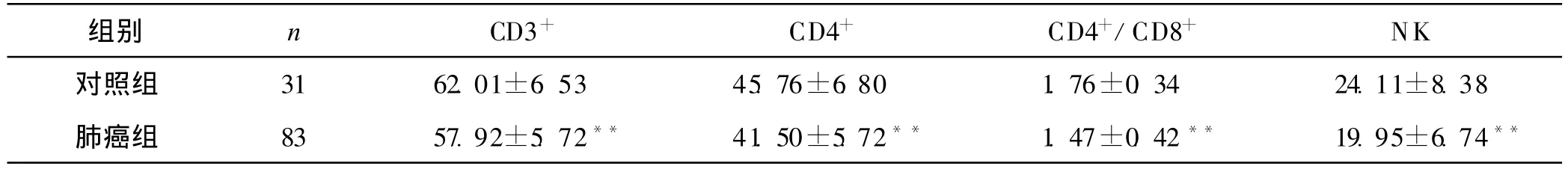
表1 化疗前肺癌组与对照组外周血T淋巴细胞亚群及NK细胞活性比较(%,±s)
与对照组比较**P<0.01
组别 n CD3+ CD4+ CD4+/CD8+ NK对照组 31 62.01±6.53 45.76±6.80 1.76±0.34 24.11±8.38肺癌组 83 57.92±5.72** 41.50±5.72** 1.47±0.42** 19.95±6.74**
2.2 化疗前后外周血T淋巴细胞亚群及NK细胞活性比较
化疗组和观察组患者化疗后外周血CD3+、CD4+、CD4+/CD8+NK细胞水平较化疗前降低,差异均有统计学意义(P<0.05),但观察组各项指标均显著高于化疗组,差异有统计学意义(P<0.05)。见表2。
表2 两组化疗前后T淋巴细胞亚群及NK细胞活性比较(%,±s)

表2 两组化疗前后T淋巴细胞亚群及NK细胞活性比较(%,±s)
与化疗前比较*P<0.05;与化疗组比较△P<0.05
组别 n CD3+化疗前 化疗后CD4+化疗前 化疗后CD4+/CD8+化疗前 化疗后NK化疗前 化疗后化疗组 4457.74±5.133.09±4.65* 40.37±6.0934.82±5.76* 1.49±0.37 1.21±0.27* 20.17±6.9315.44±5.37*观察组 3958.26±4.87 56.07±5.14*△ 42.09±6.13 37.81±6.02*△ 1.52±0.41 1.34±0.31*△ 19.82±6.79 17.95±5.72*△
3 讨论
我国肺癌的发病率逐年升高,大部分患者就诊时已处于肿瘤晚期,需要行肿瘤内科化疗。有研究[2-4]发现,化疗在杀灭肿瘤细胞的同时也伴随因化疗引起的负面效应,免疫功能降低是主要并发症之一,而在肿瘤的治疗过程中,保护机体免疫状态与杀伤肿瘤细胞具有同等重要的地位。传统中医药理论认为扶正培本、活血化瘀、清热解毒的中药能保护或提高机体的免疫功能,调动机体自身的抗癌能力,从而达到延长患者生存期、改善生活质量的作用。近年来,已有许多研究[5-7]证实,对化疗患者采用中医药辅助治疗能减轻药物毒性和各种治疗的不良反应,可以有效保护人体的免疫功能。
复方苦参注射液为纯中药抗癌药,其主要成分为苦参碱、氧化苦参碱等多种生物碱。近年研究[8-10]表明,苦参类生物碱具有较强的抗肿瘤活性,可诱导肿瘤细胞向正常细胞分化,具有促凋亡作用,可显著提高细胞免疫功能,是良好的免疫调节剂。本研究结果显示,肺癌患者化疗前 CD3+、CD4+、CD4+/CD8+及NK细胞数均低于健康对照组,提示肺癌患者的机体免疫功能明显低于正常人,而且进一步分析表明单纯化疗组和观察组患者化疗后外周血CD3+、CD4+、NK细胞含量以及CD4+/CD8+水平较化疗前继续降低,说明化疗损伤了肺癌患者免疫机能,从而导致其免疫功能进一步下降。而化疗后观察组肺癌患者外周血CD3+、CD4+、CD4+/CD8+及NK细胞数均显著高于单纯化疗组,说明化疗的同时应用复方苦参可改善化疗对肺癌患者的免疫抑制状态,使机体的免疫功能特别是细胞免疫功能增强,间接发挥了对肿瘤细胞的抑制与杀伤作用。
复方苦参减轻化疗对肺癌患者免疫抑制的机制尚不清楚,中医学对于肿瘤的致病因素有“正气不足,而后邪气踞之”的认识,其“正气”一定程度包括了现代医学的免疫防御功能。崔澂等[11]研究发现,氧化苦参碱可通过降低Colon26肿瘤细胞分泌TGF-β1和IL-10,从而下调Colon26对T细胞增殖、活化及对T、NK细胞ζ链表达的抑制,在一定程度上逆转肿瘤细胞的免疫抑制。
因此,复方苦参对改善肺癌化疗患者的细胞免疫功能有重要意义,对肺癌化疗患者有一定的临床应用价值,建议在临床中进一步推广和应用。
[1] 王桂芝,秦文华.化疗对肿瘤患者淋巴细胞亚群的影响[J].中华全科医学,2009,7(12):1307-1308.
[2] 展富琴,冯萍.恶性肿瘤患者化疗前后免疫功能的变化[J].中国血液流变学杂志,2007,17(1):137-138.
[3] 高碧燕,金从国,卢玉波,等.宫颈癌患者新辅助化疗与放疗前后外周血T细胞亚群变化的研究[J].实用癌症杂志,2009,24(3):248-250.
[4] SHEBZUKHOV YV,KOROLEVA EP,KHLGATIAN SV,et al.Humoral immune response to thymidylate synthase in colon cancer patients after 5-FU chemotherapy[J].Immunol Lett,2005,100(1):88-93.
[5] 柏茂树,伍治平,王熙才.肿瘤化疗辅助中药研究进展[J].现代肿瘤医学,2010,18(3):597-601.
[6] 杜建.中药抗肿瘤机制研究进展[J].福建中医学院学报,2009,19(4):1-5.
[7] 袁太宁.中药抗肿瘤作用机理研究进展[J].江苏中医药,2009,41(3):79-80.
[8] 朱晓伟,宝金荣,布仁.苦参碱和氧化苦参碱抗肿瘤作用机制研究进展[J].化学试剂,2010,32(1):32-36.
[9] 马玲娣,张彦,文世宏,等.苦参碱抗肿瘤作用及其机制的初步研究[J].中国免疫学杂志,2007,23(5):434-437.
[10] 王锐,姜小军,郑婕,等.氧化苦参碱增强环磷酰胺对小鼠肺癌Lewis生长的抑制作用[J].第二军医大学学报,2008,29(4):399-403.
[11] 崔澂,王润田,佟慧,等.氧化苦参碱下调小鼠Colon26肿瘤细胞免疫抑制作用的体外实验[J].第四军医大学学报,2006,27(21):1969-1972.

