胆红素与牛血清白蛋白低亲合力相互作用的研究
人们在配体-蛋白相互作用方面的研究取得了很大的进展,可采用多种方法测定配体-蛋白相互作用的动力学参数。
核磁共振波谱(NMR)方法可用于分子间相互作用的动力学研究,包括蛋白质或蛋白质-配体络合物的溶液结构测定、同位素编辑/滤波或核Overhauser效应(NOE)技术迅速测定蛋白-配体络合物中配体的结构[1]。在配体与受体发生作用时,许多NMR参数将发生变化。NMR方法可以通过几种途径测定药物和蛋白的相互作用,如化学位移、线宽变化、转移NOE及脉冲梯度场实验等[2~5]。
Langmuir吸附等温方程[6]是物理化学中用以描述气体分子在固体表面吸附和脱附动力学平衡的方程,可用于研究气体和固体的相互作用及液体和固体的相互作用[7]。
作者在此研究了水溶液中胆红素(BR)与牛血清白蛋白(BSA)的低亲合力相互作用,结合NMR动力学测量、Langmuir吸附等温方程测定牛血清白蛋白对胆红素的最大结合中心数目(n),并推断配体-生物大分子络合物的络合常数(K),为该领域的研究开辟了一条新途径。
1 实验
1.1 试剂与仪器
牛血清白蛋白,中国华美生物工程公司;胆红素,瑞士Fluka Chemika;所用试剂均为分析纯;实验用水为二次蒸馏水。
Unity Inova 600型核磁共振谱仪,美国瓦里安公司。
1.2 原理
Langmuir吸附等温方程采用了两个基本假定:第一,固体具有吸附能力是因为吸附剂表面的原子力场没有饱和,有剩余价力。当气体分子碰撞到固体表面时,其中一部分就被吸附并放出吸附热,但是气体分子只有碰撞到尚未被吸附的空白表面才能够发生吸附作用;当固体表面已覆盖满一层吸附分子,这种力场得到了饱和,因此吸附是单分子层的。第二,已吸附在吸附剂表面上的分子,当其热运动的动能足以克服吸附剂引力场的位垒时,又重新回到气相。再回到气相的机会不受邻近其它吸附分子的影响,也不受吸附位置的影响。换言之,被吸附的分子之间不互相影响,并且表面是均匀的。
与胆红素相比,分子量高达66 000 Da的BSA分子能够提供足够大的表面吸附或者结合胆红素分子。由于胆红素与蛋白间的低亲合力,其相互作用很弱,结合态和游离态胆红素分子处于快速交换中,因此可以合理地假设Langmuir吸附等温方程的两个基本假定适用于BR与BSA的低亲合力相互作用。结合过程可用式(1)描述:
BR+BSA=Complex
(1)
假设每一个BSA分子最多有n个结合中心可用于接受BR分子,则:
ncP=[LB]+[P]
(2)
cL=[LF]+ [LB]
(3)
式中:cP、cL分别为溶液中BSA和BR的总浓度;[P]为BSA分子中游离态结合中心的浓度;[LF]、[LB]分别为游离态和结合态BR的浓度。
由Langmuir吸附等温方程的两个基本假定,可以得到:
吸附速率=k1[LF](ncP-[LB])
(4)
脱附速率=k-1[LB]
(5)
当吸附过程和脱附过程达到平衡,则吸附速率等于脱附速率,式(4)和式(5)右边也相等。这样,就得到与Langmuir吸附等温方程类似的方程:
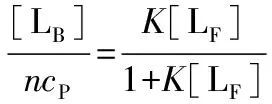
(6)
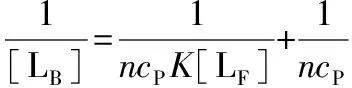
(7)
式中:K=k1/k-1= [LB]/{[LF](ncP-[LB])},是BR-BSA络合物的络合平衡常数。
一旦得到了[LB]和[LF]的具体数据,将1/[LB]对1/[LF]作图并用式(7)拟合所得直线,就可以同时得到两个参数:n和K。
[LB]和[LF]的具体数据可通过NMR测量获得。某些NMR参数,如驰豫速率和自扩散系数的观测值(Yobs),应该是游离态和结合态分子相应参数的权重平均值,即:
Yobs=XBYB+XFYF=XB(YB-YF)+YF
(8)
式中:Yobs为驰豫速率或自扩散系数的观测值;YB、YF分别为结合态和游离态BR分子的驰豫速率观测值;XB、XF分别为结合态和游离态BR分子的摩尔分数,XB=[LB]/cL,XF=[LF]/cL。
通过改变BSA与BR的浓度比cP/cL测量一系列Yobs数据,将此数据对cP/cL作图,分别外推cP/cL到0和无穷大,就可以得到YF和YB。根据式(6)~(8)就可计算出[LB]和[LF]。
1.3 方法
定量溶解BR于溶液中,得到9个NMR样品,其中BSA浓度均为4.00×10-5mol·L-1,BR浓度(×10-3mol·L-1)则分别为6.33、5.50、5.13、4.95、4.40、4.00、3.42、3.30、2.80,对应BSA与BR浓度比(cP/cL)分别为:1∶158、1∶138、1∶128、1∶124、1∶110、1∶100、1∶85.5、1∶82.5、1∶70.0,含有10%(体积分数)的重水(D2O)。在310 K下测定样品的自旋晶格驰豫时间。
2 结果与讨论
2.1 核磁图谱
BR溶液的1HNMR图谱如图1所示。
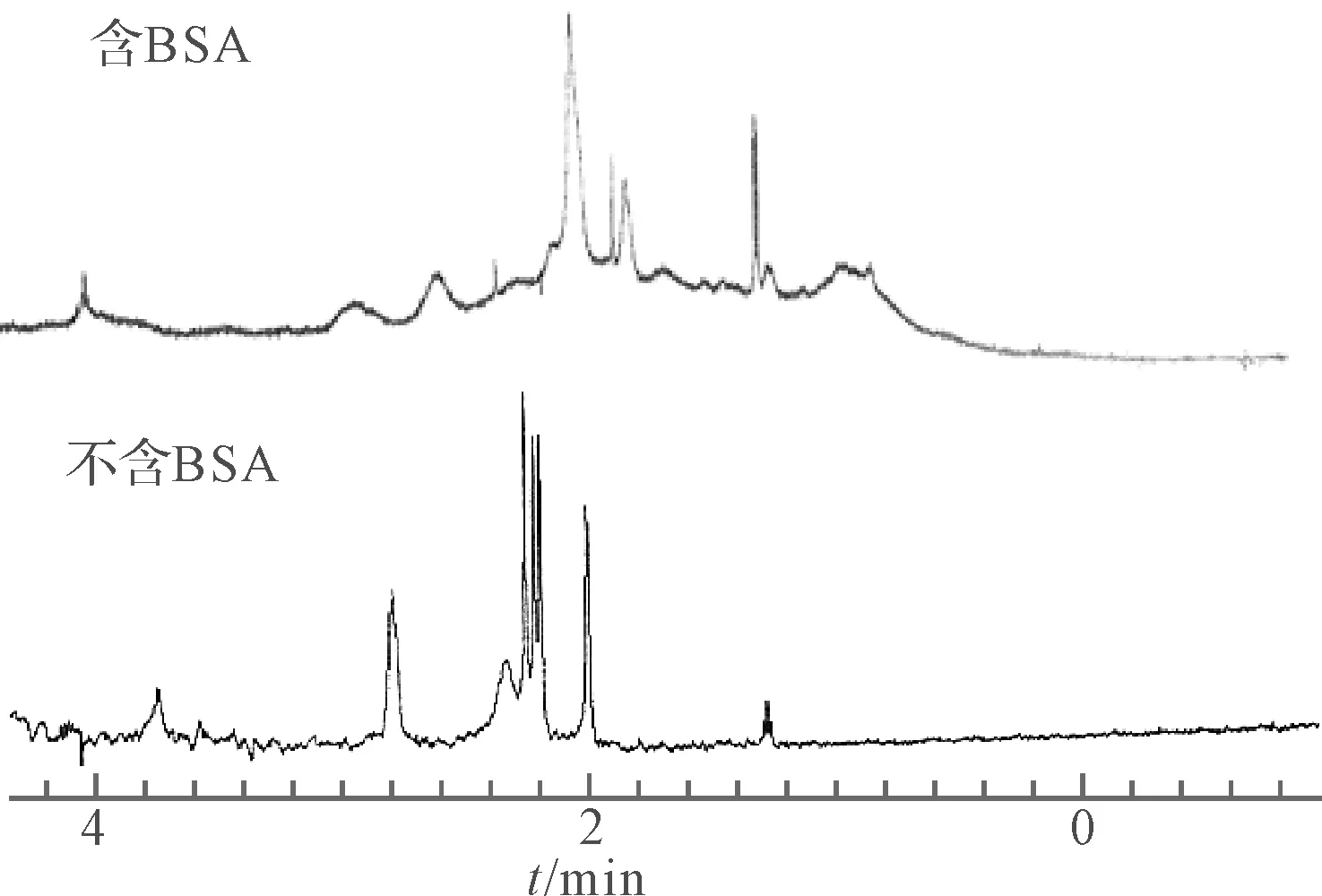
cBR:5.50×10-3 mol·L-1 cBSA:4.00×10-5 mol·L-1
由图1可看出,由于BSA浓度很小,加之存在快速驰豫而引起谱线加宽现象,所以在含BSA的样品溶液中BSA信号都很弱。同时,由于溶液的高粘度及结合态和游离态分子间交换所造成的影响,含BSA的样品溶液中所有来自BR的信号也都变宽了,由于微环境的改变,化学位移值均发生了一定改变。
2.2 驰豫时间
测定BR分子中2-CH3中H的纵向驰豫时间,驰豫速率的观测值Yobs随BSA与BR浓度比(cP/cL)的变化如图2所示。
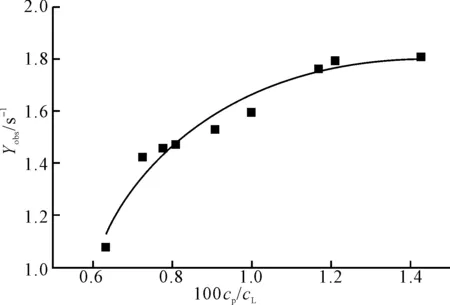
图2 BR分子的2-CH3中H的驰豫速率观测值随浓度比(100cP/cL)的变化曲线
从图2可以看出,随着浓度比cP/cL的增大,驰豫速率的观测值Yobs不断增大。
外推cP/cL为无穷大,可得YB=1.85 s-1;外推cP/cL为0,得YF=0 s-1。由式(8)所描述的快速交换模型及XB和XF的定义,可计算出一系列[LF]和[LB]值,结果见表1。
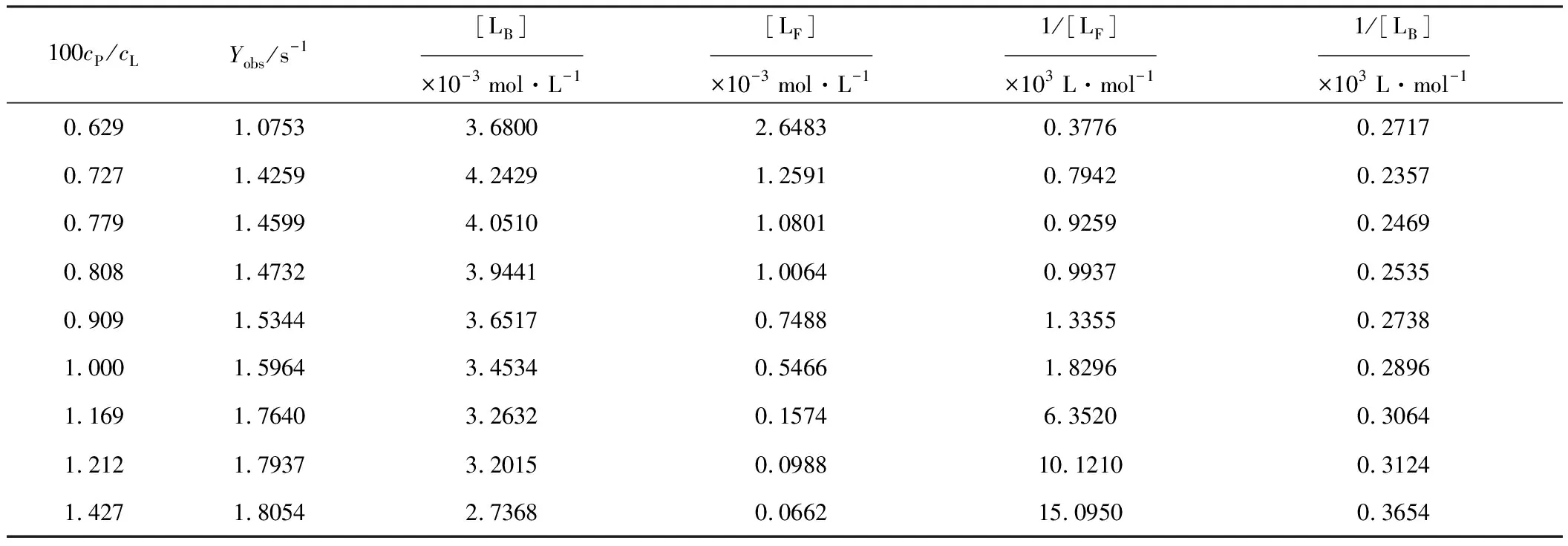
表1 含4.00×10-5 mol·L-1 BSA的BR溶液的驰豫速率观测值
将1/[LB]对1/[LF]作图(图3),用式(7)拟合所得直线,得到BR-BSA络合物的表观络合常数K=36.0 L·mol-1,BSA分子上的最大结合中心数目n=98。
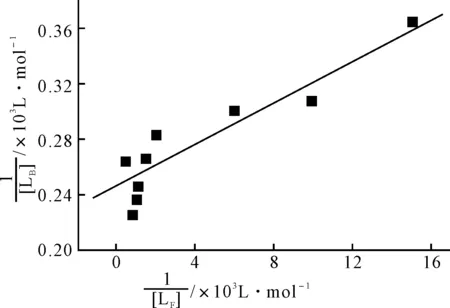
图中直线为Langmuir吸附等温方程(式7)的拟合结果
2.3 讨论
本实验所用的模型适用于游离态和结合态配体快速交换的体系。对于慢交换体系,式(8)不再有效,因为此时NMR信号非常宽,无法测得YB,因而也就无法计算Yobs。血清白蛋白的X-射线研究和很多光谱研究结果表明,在BSA分子上与配体结合的高亲合力结合中心数目一般为1或2[8,9]。由于洞穴可以很紧密地结合配体小分子,因此很容易理解这类BSA-配体络合物的络合常数K非常大[10~12]。这类络合物的络合常数K通常在1×105~1×106L·mol-1范围,可以肯定属于慢交换类型。然而,正与作者前面所提到的那样,本实验观测不到这种类型的相互作用。本实验中采用很高的配体-蛋白浓度比,从而确保了BSA分子上的高亲合力结合中心完全饱和。虽然实验体系中高亲合力相互作用和低亲合力相互作用同时存在,但本实验仅能获得低亲合力相互作用的信息。
作为生物大分子,不仅牛血清白蛋白可以和小分子配体发生作用,DNA、RNA或者酶都可以发生这种作用。可以预料,Langmuir吸附等温方程在配体-生物大分子研究中的应用有着非常广阔的前景。
3 结论
采用核磁共振驰豫测量研究了胆红素和牛血清白蛋白间的低亲合力相互作用。得到BR-BSA络合物的表观络合常数K=36.0 L·mol-1,BSA分子上的最大结合中心数目n=98。显然,研究配体-蛋白络合物的结合等温线是理解该类络合物形成过程的关键。作为描述小分子在固体表面吸附和脱附动力学平衡的一种手段,Langmuir吸附等温方程能够很好地解释生物大分子对小分子配体的低亲合性结合能力。
参考文献:
[1] Roberts G C K.NMR Spectroscopy in structure-based drug design[J].Curr Opin Biotechnol,1999,10(1):42-47.
[2] Campbell I D,Dwek R A.Biological Spectroscopy[M].Canada,Menlo Park:Benjamin/ Cummings Publishing Co,1984:97-98.
[3] Dwek R A.Nuclear Magnetic Resonance in Biochemistry[M].Oxford:Clarendon Press,1973:37-47.
[4] James T L.Nuclear Magnetic Resonance in Biochemistry[M].New York:Academic Press,1975:48-50.
[5] Ni F.Recent developments in transferred NOE methods[J].Progress in NMR Spectroscopy,1994,26:517-606.
[6] Atkins P W.Physical Chemistry(3rd ed)[M].Oxford:Oxford University Press,1986:762-789.
[7] Adamson A W,Gast A P.Physical Chemistry of Surfaces(6th ed)[M].New York:John Wiley & Sons,1997:368-369.
[8] Noctor T A G,Wainer I W.The use of displacement chromatography to alter retention and enantioselectivity on a human serum albumin-based HPLC chiral stationary phase:A mini-review[J].Journal of Liquid Chromatography and Related Technologies,1993,16(4):783-800.
[9] Kohita H,Matsushita Y,Moriguchi I.Binding of carprofen to human and bovine serum albumins[J].Chem Pharm Bull,1994,42(4):937-940.
[10] Rahman M H,Maruyama T,Okada T,et al.Study of interaction of carprofen and its enantiomers with human serum albumin.Ⅱ.Stereoselective site-to-site displacement of carprofen by ibuprofen[J].Biochem Pharmacol,1993,46(10):1733-1740.
[11] Hage D S,Noctor T A G,Wainer I W.Characterization of the protein binding of chiral drugs by high-performance affinity chromatography.Interactions ofR-andS-ibuprofen with human serum albumin[J].J Chromatogr A,1995,693(1):23-32.
[12] Epps D E,Raub T J,Kézdy F J.A general,wide-rage spectrofluorometric method for measuring the site-specific affinities of drugs toward human serum albumin[J].Anal Biochem,1995,227(2):342-350.

