胎鼠神经干细胞的原代培养及体外诱导分化研究
刘晓薇 孙敬武
胎鼠神经干细胞的原代培养及体外诱导分化研究
刘晓薇1孙敬武1
目的 探讨神经干细胞的原代培养以及体外诱导分化为毛细胞样细胞的方法,为神经干细胞移植治疗感音神经性聋奠定基础。方法 取胎龄为14.5天的SPF级昆明小鼠脑组织,采用机械吹打的方法在无血清培养基中原代培养,传代培养,诱导分化为毛细胞样细胞,采用免疫细胞化学方法鉴定神经干细胞以及毛细胞的免疫表型。结果 ①在含成纤维细胞生长因子-2(FGF-2)和表皮生长因子(EGF)的无血清培养液中,神经干细胞在体外培养6~8代后,其细胞呈指数级增加,增殖的细胞表达神经上皮干细胞蛋白(nestin);②在诱导分化培养基中培养3周后它们能被诱导分化为神经胶质细胞、毛细胞样细胞,4周后表达支持细胞表型。结论 神经干细胞在体外可以诱导分化为毛细胞样细胞。
神经干细胞; 毛细胞; 免疫细胞化学; 免疫表型; 诱导分化
研究表明,神经干细胞具有多向分化潜能[1],这使细胞疗法成为可能,为神经干细胞移植治疗感音神经性聋奠定了基础。
内耳是与听觉位置觉有关的感觉器官,有报道moysinⅦa和Brn-3c是毛细胞特异性免疫表型[2~5]。哺乳动物耳被囊的形态发生依靠膜迷路上皮始基细胞与相连的耳周围间充质细胞之间的相互作用,转化生长因子(transforminggrowth factor, TGF)作为一种信号多肽可调节许多细胞的类型和分化,包括间充质细胞。1991年Frenz等[6]利用免疫组化的方法对小鼠胚胎第10、12和14天发育的听泡中上皮与间充质内TGF分布的时间-空间模式进行研究,证实了TGF参与耳囊形成期间软骨形态发生的调控,提示TGF在上皮-间充质相互作用和耳形态发生的调控中起媒介作用。1992年该学者[7]又报道了在胎龄10~16天的小鼠中耳上皮和耳周间充质中TGF的表达情况,通过在培养基中加人TGF后培养物又重新出现胚胎期才出现的软骨形成过程,证实了TGF与耳被囊之间有因果关系。TGF可能是耳蜗基底膜正常发育过程中的重要因子。本文介绍了胚胎小鼠脑神经干细胞(neural stem cells,NSCs)的分离和体外培养方法,并通过NSCs的增殖曲线、NSCs的分化诱导以及免疫细胞化学染色等方面的实验结果,证实分离和培养的NSCs在体外有很强的增殖能力,并且在自然分化的条件下具有多向分化潜能,现报告如下。
1 材料与方法
1.1 实验动物与试剂 SPF级成年昆明小鼠,由安徽医科大学实验动物中心提供,以雌:雄=2:1于7:00 Pm配对合笼,次日8:00 Am检查,查到黄白色米粒样阴栓存在,记为孕0.5天,未查到阴栓的次日再观察,合笼的时间不超过72小时。
细胞培养液采用DMEM/F12无血清培养液。另添加B27(Gibco),20 ng/ml成纤维生长因子-a(FGF-a,Peretech)、20 ng/ml表皮生长因子(EGF,Peretech)为NSCs生长液,加入10 ng/ml转化生长因子(TGF,Peretech)、10%胎牛血清(Hyclone)(目的是使神经干细胞贴壁从而诱导其分化)为诱导分化培养基。其他试剂有神经胶质酸性蛋白(GFAP,sigma),肌浆球蛋白a(myosina,Santa Cruz),全广角蛋白(pan-Cytokeratin,Santa Cruz),Brn-3c(Santa Cruz),cy3荧光二抗(中杉),FITC荧光二抗(中杉),Hoechst33342(Sigma)。
1.2 细胞分离和培养 将孕鼠解剖后,取出胚胎置于含有D-Hanks液的平皿中取出脑组织,反复洗涤,剪成1 mm×1mm×1 mm的组织块后移至离心管中,用抛光的直头细滴管轻轻吹打后使之成为细胞悬液,并通过尼龙网过滤,以除去粘连的纤维组织,将收集的细胞悬液离心后,重悬于生长液中,用滴管再次吹打,经计数和活力观察,将密度调至1× 106个/毫升,并以1×105个/毫升的密度接种于培养瓶中。于5%CO2、37℃环境中培养,直到NSCs分裂、增殖形成较大的神经细胞球后再作传代处理。
1.3 细胞传代 当神经球增大到每球50~100个细胞时即可传代,传代时将神经细胞球移至离心管,低速离心,再加入生长液中,用200μl的枪头吹打,使之成为单细胞悬液,进行细胞记数和活力观察,按2:1接种于新的培养瓶中。
1.4 神经干细胞的分化和鉴定 取第二代的神经细胞球吹打成单细胞后,以1×104个/片细胞密度种于预先用左旋多聚赖氨酸包被的玻片上,在诱导培养基中培养两小时后做免疫细胞化学染色。用nestin标记神经干细胞。诱导分化3周后,用moysina标记毛细胞样细胞,用pan-Cytokeratin标记支持细胞样细胞,免疫细胞化学及免疫荧光染色观察。
1.5 免疫细胞化学及免疫荧光方法 细胞爬片后,用4%多聚甲醛固定30分钟,0.01 mmol/LPBS冲洗5 min,3次;3%过氧化氢室温下作用5分钟,0.01 mmol/LPBS冲洗5 min×3次,滴加10%正常山羊血清室温封闭30分钟,吸去多余液体,加一抗Nestin 1:200(sigma);glial fibrillary acid protein(GFAP)1:200(sigma);moysina1:200(Santa cruse);pan-Cytokeratin 1:200(Santa cruse)放入湿盒中4℃过夜,0.01 mmol/LPBS冲洗5 min,3次,加入二抗37℃孵育20分钟,0.01 mmol/LPBS冲洗5 min,3次,滴加SABC,37℃孵育20分钟,0.01 mmol/LPBS冲洗5 min,3次;滴加DAB显色,镜下观察显色情况,并用蒸馏水及时终止显色;梯度酒精脱水,二甲苯透明后中性树胶封片,显微镜下观察并拍照。
玻片细胞用4%多聚甲醛固定30分钟,室温凉干,PBS漂洗2 min,3次;3%过氧化氢室温孵育10 min;PBS漂洗5 min,3次;10%正常羊血清封闭液室温封闭20 min;弃封闭液;滴加一抗4℃孵育过夜;PBS漂洗5 min,3次;用适当比例稀释的二抗(FITC标记的Ig G 1:200,cy3标记的Ig G 1:500,用加有BSA的TBS-T配制)室温孵育30 min(避光黑暗条件下进行);PBS漂洗5 min,3次;H33342孵育15分钟,PBS漂洗5 min,3次;甘油/PBS封片剂(PBS:甘油=1:9,p H 8.0~8.5)封片;荧光显微镜观察拍照。
2 结果
在原代细胞中有不少细胞碎片和灰暗的死细胞,活细胞透亮并且胞体完整,沉于瓶底,部分细胞早期有贴壁现象。2~3天后已经有部分细胞聚集,以后在生长因子的作用下,约6~7天形成明显细胞球,呈悬浮生长,并逐渐长大。取第二代细胞做免疫细胞化学染色及免疫荧光,发现其表达神经干细胞的特有标志nestin(图1、2)。
对原代培养形成的神经球通过机械吹打的方法进行传代培养,每一次传代后细胞均通过相差显微镜观察活力并计数(图3),发现其可以被成功传6代,每代保持和原代基本相同的形态,并表达nestin。
将传代后的神经干细胞培养于诱导培养基中,观察它们分化的能力,结果发现,在接种的几个小时内细胞开始贴壁分化,7天后形成多角形胞体的星形胶质细胞样细胞,表达GFAP(图4)。3周后,行免疫细胞化学染色和免疫荧光染色发现,细胞表达毛细胞表型moysina和Brn-3c,却几乎不表达支持细胞的免疫表型pan-Cytokeratin(图5),诱导分化4周后有pan-Cytokeration的阳性表达(图6)。

图2 培养细胞免疫化学染色及免疫荧光结果

图1 原代培养的神经干细胞 a 24小时后(×10);b原代培养7天
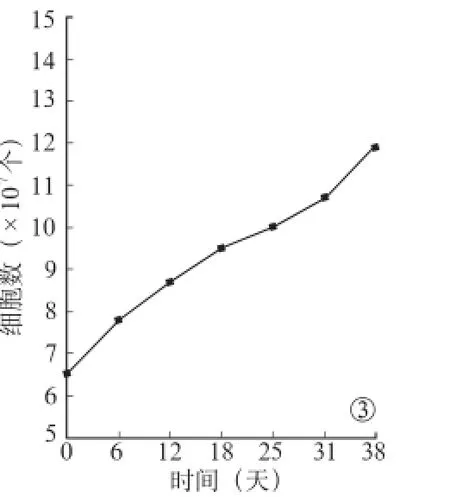
图3 不同时间培养细胞数
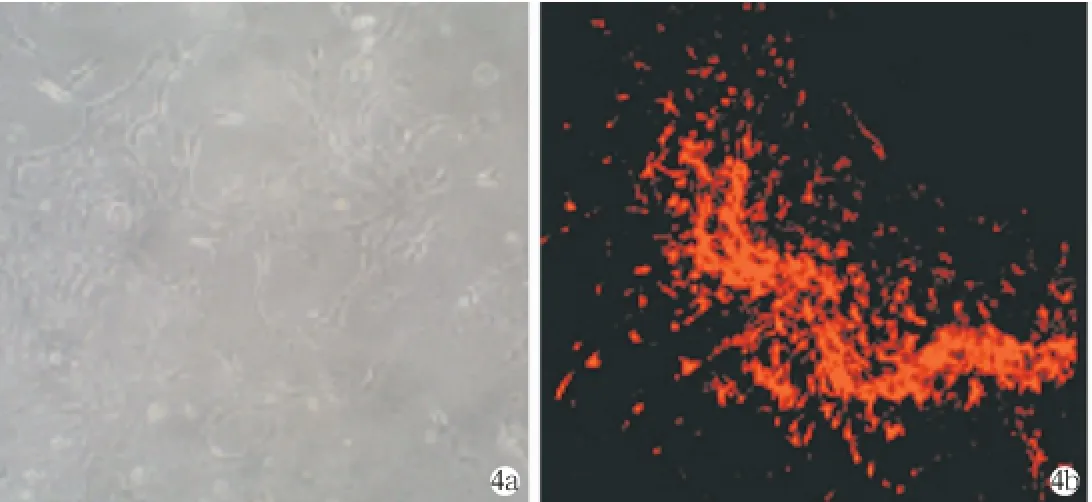
图4 传代培养7天后 a贴壁培养7天后(×10);b贴壁7天GFAP免疫荧光(cy3荧光染色)

图5 培养细胞3周后免疫化学染及免疫荧光结果 a诱导分化3周后MoysinⅦa免疫组化(×40);

图6 4周后免疫化学染色及免疫荧光结果 诱导分化4周后Pan-cytokeration阳性表达(红色),H33342(蓝色)核染(×20)
3 讨论
干细胞应具有以下属性:①自我维持和自我更新的能力;②具有多种分化潜能,具有分化为本系大部分类型细胞的能力;③增殖分裂能力;④这种自我更新和多分化潜能可以维持相当长的时间,甚至终生;⑤对损伤和疾病具有反应能力[8,9]。近年来,关于神经干细胞的分离培养方法已有很多报道,多采取酶消化的方法[10~14]。因为小鼠的脑组织较软,用酶不容易掌握消化时间,因此,本文采用吸管吹打和筛网过滤的方法来进行原代培养。
实际上,从组织中分离的原代细胞中有较多的杂质和其他细胞,但是由于生长液中不含有血清,其他细胞渐渐死亡,而神经干细胞在生长因子的作用下逐渐生长,形成细胞球。随着培养的继续,神经干细胞不断纯化,而且越长越好,这一点从本研究结果中的细胞生长曲线可以看出。另外,在细胞换液时采取只加液不弃液的方法,这样可能更利于神经干细胞的生长,因为神经干细胞在生长的同时可能分泌其他的生长因子,这些生长因子会促进神经干细胞的生长,而且由于神经干细胞是悬浮生长,弃液可能会丢失部分细胞。
研究表明,在内耳的感觉器官中,由于肌球蛋白Ⅶa和POU家族转录因子Brn-3c在毛细胞上的特异性表达,并在耳蜗和前庭毛细胞的残存和功能恢复中发挥的重要作用,它们可以作为标记蛋白来鉴别毛细胞的免疫表型,而pan-Cytokeratin则被认为是鉴别耳蜗支持细胞表型的一种蛋白[15,16]。Kojima等[17]将从胎鼠中枢神经系统获得的神经干细胞进行体外培养,并运用双免疫标记技术,获得同时带有Brn-3c和肌球蛋白Ⅶa这两种毛细胞标记蛋白的毛细胞免疫表型。另一方面,nestin可作为干细胞的标记[18]。在胎鼠及成年鼠的中枢神经系统均可见nestin的表达,而且nesitn的表达与细胞增殖周期有着密切的联系[19,20]。本实验采用第一代细胞(P1)nesitn鉴定神经干细胞,体外诱导3周后,免疫细胞化学检测moysina有阳性表达,而pan-Cytokeratin几乎无阳性表达,说明是毛细胞样细胞,这与Kojima[17]报道的相同。分析可能与下列因素有关:①小鼠的胎龄;②体外诱导培养基中的细胞因子;③诱导分化的时间;④支持细胞生长的环境要求。因此本研究延长诱导分化的时间至4周时,发现pan-Cytokeratin阳性表达。
毛细胞损失是造成非遗传性聋的主要因素,由于毛细胞的再生能力是非常有限的,由毛细胞缺失造成的耳聋通常认为是不可逆的[21]。能否诱导分化其他器官的细胞产生毛细胞或者类毛细胞,进而通过细胞移植的方法在所需部位定向产生毛细胞,从而治疗耳聋,是目前研究的热点。Li等[22]采用无血清神经球培养方法从成年小鼠的椭圆囊斑分离培养出nestin阳性、具有神经干细胞特性的细胞,这些细胞具有自我复制能力,EGF和IGF-1诱导成为潜在的内耳毛细胞前体细胞。赵玉林等[23]对TGF蛋白产物在昆明小鼠内耳发育中的表达进行研究,指出该细胞因子参与内耳的发育过程,并且对内耳上皮的发育主要起着促进分化的作用。本实验运用TGF诱导分化神经干细胞向毛细胞样细胞转化,发现pan-Cytokeratin和moysina均有阳性表达。
本研究采用孕14.5天胎鼠的神经干细胞,进行体外传代培养及诱导分化,发现神经干细胞具有分化为毛细胞表型及支持细胞表型的潜能,TGF在分化过程中有着非常重要的作用,为进一步移植神经干细胞治疗感音神经性聋奠定了基础。
1 Bjornson CR,Rietze RL,Reynolds BA,et al.Turning brain into blood:A hematopoietic fate adopted by adult neural stem cells in vivo[see comments][J].Science,1999,283:534.
2 Weir J,Rivolta M,Holley M.Identification of differentiating cochlear hair cells in vitro[J].Am J Otol,2000,21:130.
3 Lawlor P,Marcotti W,Rivolta MN,et al.Differentiation of mammalian vestibular hair cells from conditionally immortal,postnatal supporting cells[J].J Neurosci,1999,19:9 445.
4 Malgrange B,Belachew S,Thiry M,et al.Prolifrative generation of mammalian auditory hair cells in culture[J].Mech Dev,2002,112:79.
5 Zhao HB.Long-term natural culture of cochlear sensory epithelia of guinea pigs[J].Neurosci Lett,2001,315:73.
6 Frenz DA,Vandewater TR.Transforminggro wthfactor-beta:Does it direct otic capsule formation[J].Ann Otol Rhinol Laryngol,1991,100:301.
7 Frenz DA,Galinovic-Schwartz V,Liu W,et al.Transforming growth factor B1 is an epithelial-deried signal peptide that influences otic capsule formations[J].Dev Biol,1992,153:324.
8 Weiss S,Reynolds BA,Vescovi AL,et al.Is there a neural stem cell in the mammalian forebrain[J]?TINS,1996,19:387.
9 Reynolds BW,Weiss S.Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell[J].Dev Biol,1996,175:1.
10 Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255:1 707.
11 Carpenter MK,Cui X,Hu ZY,et al.In vitro expansion of a multipotent population of human neural progenitor cells[J].Exp Neurol,1999,158:265.
12 Shihabuddin LS,Ray J,Gage FH.FGF-2 is sufficient to isolate progenitors found in the adult mammalian spinal cord[J].Exp Neurol,1997,148:577.
13 Johe KK,Hazel TG,Muller T,et al.Single factors direct the differentiation of stem cells from the fetal and adult central nervous system[J].Gene Dev,1996,10:3 129.
14 Whittemore SR,Morassutti DJ,Walters WM,et al.Mitogen and substrate differentially affect the lineage restriction of adult rat subventricular zone neural precursor cell populations[J].Exp Cell Res,1999,252:75.
15 Lawlor P,Marcotti W,Rivolta MN,et al.Differentiation of mammalian vestibular hair cells from conditionally immortal,postnatal supporting cells[J].J Neurosci,1999,19:9 445.
16 Malgrange B,Belachew S,Thiry M,et al.Proliferative generation of mammalian auditory hair cells in culture[J].Mech Dev,2002,112:79.
17 Kojima K,Tamura S,Nishida AT,et al.Generation of inner ear hair cell immunophenotypes from neurospheres obtained from fetal rat central nervous system in vitro[J].Acta Otolaryngol,2004(Suppl),551:26.
18 Johansson CB,Lothian C,Molin M,et al.Nestin enhancer requirements for expression in normal and injured adult CNS[J].J Neurosci Res,2002,69:784.
19 Mignone JL,Kukekov V,Chiang AS,et al.Neural stem and progenitor cells in nestin-GFP transgenic mice[J].J Comp Neurol,2004,469:311.
20 Yamaguchi M,Saito H,Suzuki M,et al.Visualization of neurogenesis in the central nervous system using nestin promoter-GFP transgenic mice[J].Neuroreport,2000,11:1 991.
21 Walshe P,Walsh M,McConn Wash R.Hair cell regeneration in the inner ear:A review[J].Clin Otolaryngol,2003,28:5.22 Li H,Liu H,Heller S.Pluripotent stem cells from the adult mouse inner ear[J].Nat Med,2003,9:1 293.
23 赵玉林,李晓萍,董明敏,等.转化生长因子-β1在小鼠内耳发育中作用的研究[J].中国民政医学杂志,2002,14:72.
(2008-05-07收稿)
(本文编辑 周涛)
Primary CuIture of Neurospheres Obtained from FetaI Mouse CentraI Nervous System and Differentiation of Inner Ear Hair CeIIImmunophenotypes in Vitro
Liu Xiaowei,Sun Jingwu
(Department of OtorhionoIaryngoIogy Head and Neck Surgery,HospitaI of Anhui Province,Hefei,230001,China)
Objective To examine whether hair cell immunophenotypes could be derived from the central nervous system(CNS).Methods We established cell cultures from embryonic day 14.5 fetal mouse brain tissues,and analyzed changes in immunohistochemical features of the CNS cell cultures by induction of differentiation.with FGF-2 and EGF.ResuIts The results of this study showed that neural progenitors obtained from fetal rat CNS generated hair cell immunophenotypes with expression of epitopes of hair cell marker proteins myosin VIIa in vitro.ConcIusion These findings indicate that immature neural progenitors possess the potential to differentiate into hair cell phenotypes.Immature neural progenitors may be useful as materials for cell transplantation therapy for replacement of damaged inner ear hair cells.Key words:central nervous system,hair cell,immunohistochemical,immunophenotype,transdifferentiation.
Neural stem cell; Hair cell; Immuocytochemistry; Immunophenotype; Induced differentiation
10.3969/j.issn.1006-7299.2010.04.017
R339.16
A
1006-7299(2010)04-0372-04
1 安徽省立医院耳鼻咽喉科(合肥 230001)
刘晓薇,女,安徽人,住院医师,主要研究方向为耳科学。
孙敬武(Email:sjingwu@yahoo.com.cn)

