PEG-(NH4)2SO4双水相萃取法提取壳聚糖酶的研究
,,,,
(武汉生物工程学院生物工程系,湖北 武汉 430415)
壳聚糖酶(Chitosanase,EC3.2.2.99)又称壳聚糖-N-乙酰-氨基葡糖苷水解酶,是一种分解壳聚糖的专一性酶,广泛分布在细菌、真菌、病毒以及植物等生物群中[1]。酶降解法制备壳寡聚糖具有反应条件温和、寡糖得率高、不污染环境、产物安全性高等优点,是目前的发展方向。因此,对壳聚糖酶进行深入研究并实现工业化生产十分必要。
双水相萃取(ATPS)是近年来发展起来的技术,在蛋白质、酶、核酸等生物活性物质的分离纯化方面受到广泛重视。与传统的分离方法相比,ATPS具有条件温和、产品活性损失小、处理量大、分离步骤少、无有机溶剂残留、设备投资小、操作简单、易于工程放大和连续操作等优点,非常适合大规模应用[2,3]。
目前国内对双水相萃取法提取壳聚糖酶的研究和报道较少。作者利用PEG-(NH4)2SO4双水相体系从Bacillussp.LS发酵液上清液中萃取分离壳聚糖酶,考察了影响萃取效果的各种因素,对双水相萃取技术提取壳聚糖酶进行了初步研究。
1 实验
1.1 菌种、试剂与仪器
菌种Bacillussp.LS,自行筛选得到。
壳聚糖,成都科龙化工试剂厂;聚乙二醇(PEG,分子量为400、600、1000、4000、6000)、硫酸铵、3,5-二硝基水杨酸(DNS)、考马斯亮蓝G250、D-(+)-氨基葡萄糖盐酸盐等均为分析纯。
BS110S型电子天平,赛多利斯科学仪器有限公司;GL-16G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;722S型分光光度计,上海棱光技术有限公司;PHS-3C型精密pH计,上海宇隆仪器有限公司;WH-90A型漩涡混合器,上海青浦沪西仪器厂。
1.2 方法
1.2.1 粗酶液制备
低温保藏的菌种经过活化后,接种于液体发酵培养基中摇床培养,发酵液经冷冻离心后,收集上清液,4℃贮存备用。
1.2.2 PEG-(NH4)2SO4双水相体系的建立
称取一定量PEG和(NH4)2SO4配制双水相体系。体系总质量为10.0 g,其中酶液量为2.0 g,不足部分用去离子水补足。混合均匀后,3000 r·min-1离心5 min,分相。分别测定上、下相体积,上、下相酶活和总蛋白浓度。计算相比(上、下相体积之比,R)、分配系数(上、下相酶比活力之比,K)、萃取率(上相总酶活与两相总酶活之比,S)。
1.2.3 双水相体系相图的绘制
准确量取一定量的PEG原液加入试管中,然后计量加入(NH4)2SO4溶液,混合,直至试管出现混浊。计量,算出PEG和(NH4)2SO4在系统中的质量分数。再计量加入适量水,使体系变澄清,并继续加入(NH4)2SO4溶液,使系统再次变混浊。如此反复操作,计算达到混浊时PEG和(NH4)2SO4在系统中的质量分数,绘制PEG-(NH4)2SO4体系的相图。
1.3 分析与测试
1.3.1 酶活的测定
在1 mL1%胶体壳聚糖(用0.2 mol·L-1pH值5.0的醋酸缓冲溶液配制)中加入1 mL适当稀释的酶液,于50℃保温反应15 min,沸水浴10 min灭活,加入DNS 1.5 mL,沸水浴10 min,取出冷却,3500 r·min-1离心15 min,取上清液在520 nm处测光吸收值。酶活单位定义为每分钟催化生成相当于1 μmol氨基葡萄糖的还原糖所需的酶量。
1.3.2 蛋白质含量测定
蛋白质含量用考马斯亮蓝法测定[4]。
2 结果与讨论
2.1 双水相体系相图(图1)
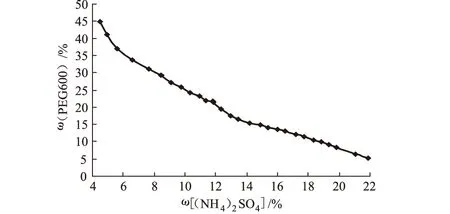
图1 PEG600-(NH4)2SO4双水相体系相图
由图1可见,在节线的上方区域可以形成双水相。
2.2 PEG相对分子量对壳聚糖酶萃取效应的影响[5]
固定PEG的质量分数为20%、(NH4)2SO4的质量分数为15%,考察PEG相对分子量对壳聚糖酶萃取效应的影响,结果见图2。
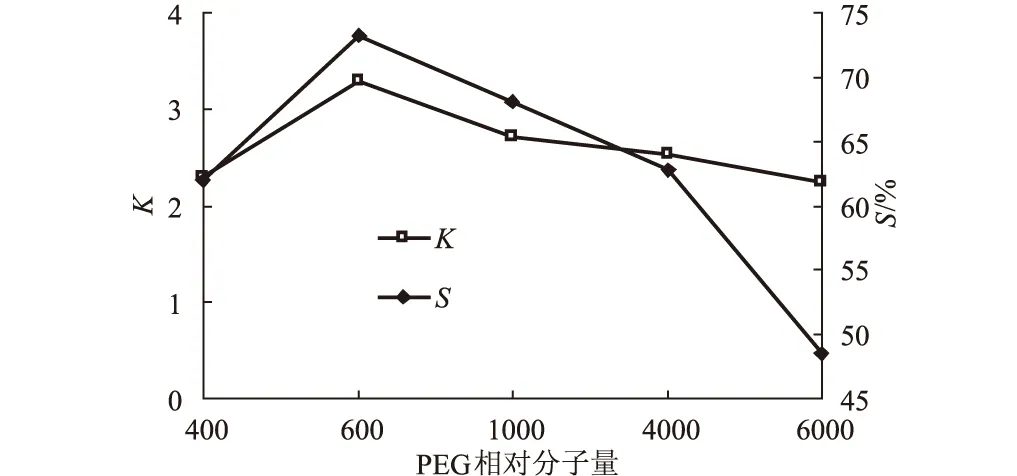
图2 PEG相对分子量对壳聚糖酶萃取效应的影响
由图2可知,随着PEG相对分子量的增加,壳聚糖酶的分配系数和萃取率均先增大后减小,当PEG相对分子量为600时分配系数和萃取率均达到最大。因此,选择PEG600进行后续实验。
2.3 PEG质量分数对壳聚糖酶萃取效应的影响
固定(NH4)2SO4的质量分数为15%,考察PEG600质量分数对壳聚糖酶萃取效应的影响,结果见图3。

图3 PEG600质量分数对壳聚糖酶萃取效应的影响
由图3可知,(NH4)2SO4质量分数一定时,随着PEG600质量分数的增加,分配系数和萃取率均先增大后减小。这是因为随着PEG600质量分数的增加,上相和下相相对组成的差别增大,壳聚糖酶在两相中的表面张力差别也增大,有利于壳聚糖酶富集于上相中。但PEG600质量分数增加到一定程度时,成相物质间的作用增大,相界面张力亦增大,系统粘度也会增大,溶质在相间的传递和在相内的扩散阻力大大增加[6],反而不利于壳聚糖酶进入PEG相。综合考虑,确定最佳的PEG600质量分数为20%。
2.4 (NH4)2SO4质量分数对壳聚糖酶萃取效应的影响
固定PEG600的质量分数为20%,考察(NH4)2SO4质量分数对壳聚糖酶萃取效应的影响,结果见图4。
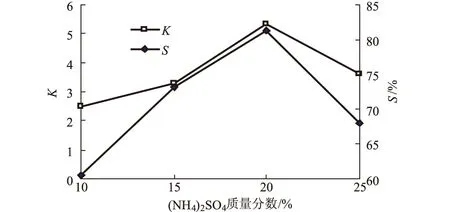
图4 (NH4)2SO4质量分数对壳聚糖酶萃取效应的影响
由图4可知,PEG600质量分数一定时,随着(NH4)2SO4质量分数的增加,分配系数和萃取率均先增大后减小。(NH4)2SO4质量分数为20%时,分配系数和萃取率均达到最大值。随着(NH4)2SO4质量分数继续增加,影响到蛋白质表面的疏水性,进而影响到蛋白质的分配系数。因此,确定最佳(NH4)2SO4质量分数为20%。
2.5 离子强度对壳聚糖酶萃取效应的影响(图5)

图5 NaCl质量分数对壳聚糖酶萃取效应的影响
由图5可知,随着NaCl质量分数的增大,分配系数和萃取率先增大后减小,NaCl质量分数为0.1%时,均达到最大值。这是因为,NaCl粒子可能在两相中有不同的分配系数,随着NaCl质量分数的增加,两相间电位差发生变化,从而使壳聚糖酶的分配系数增加,但增加到一定的程度(超过0.1%)后,萃取相极性增强,壳聚糖酶的溶解度下降而发生盐析现象,蛋白质倾向于分配到下相,分配系数和萃取率明显下降。因此,确定最佳NaCl质量分数为0.1%。
2.6 pH值对壳聚糖酶萃取效应的影响(图6)
由图6可知,随着pH值的增加,分配系数和萃取率均先增大后减小,pH值为6.0时,均出现最大值。体系pH值对壳聚糖酶的分配有很大影响,这是由于体系pH值的变化能明显改变两相的电位差[7], 最终影响到壳聚糖酶的分配系数和萃取率。因此, 确定萃取分离壳聚糖酶的双水相体系的最佳pH值为6.0。
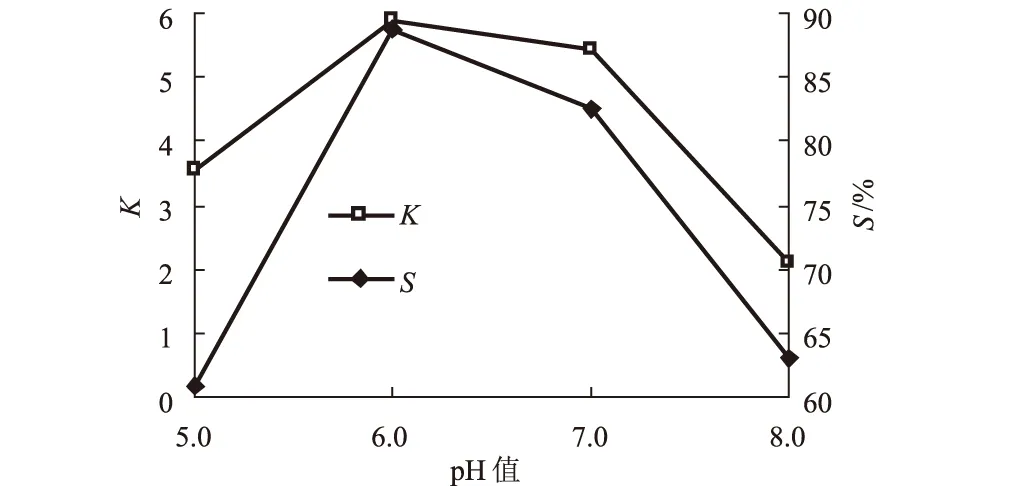
图6 pH值对壳聚糖酶萃取效应的影响
3 结论
室温下用PEG-(NH4)2SO4双水相体系从Bacillussp.LS发酵液上清液中萃取壳聚糖酶,最佳提取条件为:PEG600质量分数20%、(NH4)2SO4质量分数20%、NaCl 质量分数0.1%、pH值6.0,在此条件下壳聚糖酶分配系数达5.91、萃取率达88.7%。
参考文献:
[1] 吴晓宗,王岁楼,郝莉花.壳聚糖酶的分类及其功能应用现状[J].食品工业科技,2005,26(8):189-192.
[2] Diamond A D,Hsu J T.Aqueous two-phase systems for biomolecule separation[J].Advances in Biochemical Engineering Biotechnology,1992,47:89-135.
[3] Schmid A S,Ventom A M,Asenjo J A,et al.Partitioning and purification ofα-amylase in aqueous two-phase systems[J].Enzyme and Microbial Technology,1994,16(2):131-142.
[4] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:95-96.
[5] 邓静,吴华昌,赵树进.双水相技术在酶分离纯化中的运用[J].氨基酸和生物资源,2004,26(1):72-75.
[6] 冯箐,夏杰,陆兵,等.人溶菌酶的双水相萃取法分离[J].华东理工大学学报,2006,32(12):1409-1411.
[7] 杨善升,陆文聪,包伯荣.水相萃取技术及其应用[J].化学工程师,2004,18(4):37-40.

