猪细小病毒核衣壳VP2蛋白单克隆抗体的制备及部分特性鉴定
刘秀芬,李一经
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
猪细小病毒(PPV)是引起母猪繁殖障碍的重要病原之一。怀孕母猪,特别是初产母猪感染后以流产、死胎、木乃伊胎及新生仔猪死亡为临床特征。因该病流行面广、危害严重,给养猪业带来重大经济损失。
PPV属无囊膜病毒,衣壳蛋白即是病毒表面的结构蛋白。其中VP2蛋白在病毒感染发生,病毒致病性发挥以及诱导机体产生免疫保护反应等方面起着关键作用[1]。Tullis G E等研究表明,缺失VP2蛋白的突变体也丧失了对宿主细胞的再感染性[2]。因此猪细小病毒VP2蛋白无论在免疫防治、疾病检测,还是探讨疾病发生机理均是重要的结构蛋白。
基于猪细小病毒VP2蛋白功能特性的重要性,本研究以重组VP2蛋白为免疫原,通过细胞融合技术,制备抗VP2特异性单克隆抗体,并对单抗和分泌抗体的杂交瘤细胞株进行鉴定,为该病及其病原的基础性或应用性研究提供重要的研究工具。
1 材料与方法
1.1 实验动物 清洁级8~10周龄BALB/c小鼠,购自黑龙江省医科大学第二临床医院实验动物中心。
1.2 免疫原 表达猪细小病毒VP2蛋白重组干酪乳杆菌pPG-1-VP2-E290/L.casei393,由本实验室构建[3]表达的VP2蛋白经SDS-PAGE电泳,切胶纯化,PBS稀释成所需浓度。
1.3 细胞系 SP2/0骨髓瘤细胞、ST传代细胞,购自武汉大学保藏中心。
1.4 病毒 猪细小病毒(PPV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TEGV)、猪轮状病毒(PRV)细胞培养毒,由本实验室分离,-20℃冻存。
1.5 主要试剂 完全与不完全弗氏佐剂、PEG3350、IgG抗体亚类试剂盒均购自Sigma公司;辣根过氧化物酶(HRP)标记羊抗鼠IgG、异硫氰酸荧光素(FITC)标记羊抗鼠IgG均购自北京中杉金桥生物技术有限公司。
1.6 动物免疫 8~10周龄BALB/c小鼠进行3次腹腔免疫,每次间隔2周,在最后一次免疫3天后取脾脏用于细胞融合。首免抗原为50 μ g重组PPV VP2蛋白PBS与等量弗氏完全佐剂,第2次加强免疫为相同抗原加弗氏不完全佐剂,第3次加强免疫为相同抗原不加佐剂。
1.7 细胞融合 以50%PEG3350为融合剂,脾细胞与SP2/0按8∶1进行融合[6]。每孔脾细胞数不少于1×105个。
1.8 单抗筛选 以PPV细胞培养物作为检测抗原,对融合细胞培养上清进行检测,鼠抗PPV VP2血清为阳性对照,SP2/0细胞培养上清为阴性对照,P/N值大于2判为阳性。阳性孔细胞通过3~4次克隆筛选后,扩大培养,冻存。
1.9 腹水单抗制备 将BALB/c小鼠腹腔注入液体石蜡,剂量为0.5 mL/只,7~10 d后腹腔注入杂交瘤细胞约1×105个/只,7~15 d后待腹围明显增大后用注射器多次收集腹水,低速离心后,收集上清,所得细胞适当稀释注入另一只小鼠体内继续生产腹水抗体。间接ELISA测定腹水抗体效价。
1.10 染色体数测定 将各株杂交瘤细胞和SP2/0细胞分别制备细胞染色体[5],每个细胞取10个形态完整、单在,染色体分散良好、无重叠、无散失的制片样本进行观察,计数,求出平均染色体数。
1.11 单克隆抗体亚类鉴定 按抗体亚类试剂盒说明书测定。
1.12 Western blot分析 表达细小病毒VP2 pPG-1-VP2-E290/L.casei393诱导后,进行 SDSPAGE,半干转印后,各杂交瘤细胞上清液分别进行Western blot抗体检测。
1.13 间接免疫荧光法鉴定 接种病毒的ST细胞,待出现CPE后,倒去培养上清液,刮取细胞培养物涂片,干燥,冷丙酮固定10 min,0.01 mol/L pH 7.2 PBS洗涤3次,每次3 min,以后分别加杂交瘤细胞上清液和0.01%伊文思蓝稀释的FITC标记的羊抗鼠IgG,37℃60 min,相同方法洗涤,干燥后,镜检观察[6]。
1.14 单克隆抗体与相关病毒的反应性 PPV、PEDV、TEGV和PRV细胞培养物为包被抗原,间接ELISA检测各株杂交瘤细胞培养上清反应。
2 结果
2.1 杂交瘤细胞株建立 经过多次克隆和筛选获得了5株分泌抗体的杂交瘤细胞株,分别是2D5、1F11、2B4、3C8和1H3。这5株单抗细胞上清效价分别为1∶5 000、1∶2 000、1∶1 000、1∶800、1∶800,腹水抗体效价分别为1∶106、1∶105、1∶104、1∶104、1∶104,结果表明,腹水效价明显高于上清效价,体外连续传代培养3个月及冻存后复苏均不影响抗体的分泌。说明建立的杂交瘤细胞具有稳定分泌抗体能力。
2.2 染色体数测定结果 染色体计数结果表明,分泌抗体细胞平均染色体数目为87~102条,SP2/0骨髓瘤细胞是56~57条,两者染色体数目相差明显,说明筛选的细胞是属于杂交瘤细胞。
2.3 单克隆抗体亚类鉴定结果 抗体亚类鉴定结果显示,2D5分泌抗体为IgG2a型,其余4株1F11、2B4、3C8、1H3均为 IgM 型。
2.4 单克隆抗体特异性鉴定结果
2.4.1 Western blot分析 以杂交瘤细胞株Western blot检测,表达猪细小病毒VP2蛋白的重组干酪乳杆菌pPG-1-VP2-E290/L.casei393经诱导表达后,进行的Western blot分析表明,5株单抗反应后均可在约70 kDa出现反应带,大小与预期结果相符[7],说明所制备的单抗是针对猪细小病毒VP2蛋白(见图1)。

图1 Western blot检测单克隆抗体
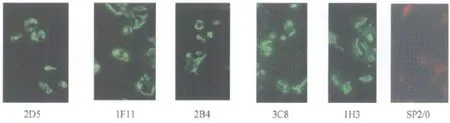
图2 5株杂交瘤细胞培养上清液对感染PPV的ST细胞进行间接免疫荧光染色结果
2.4.2 间接免疫荧光鉴定结果 以PPV感染的细胞培养物对制备的5株单抗进行的间接免疫荧光反应结果表明,2D5、1F11、2B4、3C8 、1H3,感染病毒的细胞出现明显的亮绿色荧光反应,而SP2/0细胞培养上清液染色未出现荧光,(见中插彩版图2),说明所制备的单抗能与PPV发生反应。
2.4.3 单克隆抗体与其他相关病毒的交叉反应性间接ELISA结果表明,5株单抗与PPV反应的OD值明显高于PEDV、TGEV和PRV。从接种病毒和未接种病毒的P/N值结果看,5株单抗与PPV反应的 P/N值均大于 2,而与 PEDV、TGEV和PRV反应的P/N值大约在1左右(见表1)。上述结果说明,制备获得的5株单抗与PEDV、TGEV和PRV不发生交叉反应,对PPV具有较强的特异性。

表1 单抗特异性鉴定结果
3 讨论
单克隆抗体以其均质性高、特异性强、易于标准化生产等特点,已成为生物领域基础性或应用性研究的一种重要的工具。本试验通过细胞融合技术,经过多次克隆筛选获得了抗体效价高、分泌功能稳定的5株杂交瘤细胞株,通过Western blot检测表明,5株单抗均识别猪细小病毒VP2蛋白;间接免疫荧光鉴定和与其他相关病毒的交叉反应性也表明,制备的5株单抗具有与猪细小病毒高度反应的特异性,从而为开发利用这些单抗,进行猪细小病毒及其疾病的基础性或应用性研究提供了重要的工具。5株单抗是否识别猪细小病毒VP2的不同表位以及制备的单抗是否具有中和病毒作用,值得深入探讨。
不同抗体亚类出现的时间与免疫发生的不同时期有一定关系,在免疫发生的早期,出现的循环抗体以IgM类为主,随后出现IgG类。两类抗体在纯化手段,与相应抗原的亲和力方面存在差别,目前对IgG类抗体的纯化方法相对成熟,而对IgM的纯化方法、抗体纯化效率均不是令人满意。本次融合筛选获得的抗体亚类多以IgM 类为主,只有其中1株为IgG类,是否与最后一次加强免疫较早取脾细胞融合有一定关系,适当推迟融合时间可能对提高IgG类的筛选获得具有帮助。
利用全病毒为免疫原是制备单克隆抗体的常规方法。本试验采用纯化的重组PPV蛋白为免疫原,因刺激抗原成分单一,提高了针对目的抗原阳性杂交瘤细胞株筛选的频率;避免了以PPV全病毒抗原为免疫原制备单克隆抗体筛选过程中的大量繁琐工作和筛选结果的不确定性,也减少了大量培养和纯化病毒的繁琐过程和排散病毒的危险。
[1]Molitor T W,Joo H S,Coliett M S.Porcine parvovirus parvovirus:virus purification and structural and antigenic properties of virion polypeptides[J].J Virol,1983,45(2):842-854.
[2]Tullis G E,Burger L R,Pintel D J,et al.The mino r capsid VP1 of the autonomous parvovirus minute of mice is dispensable for encapsidation of progeny single-stranded DNA but is required for infectivity[J].Virology,1993,67:131-141.
[3]徐义刚,马广鹏,李一经,等.猪细小病毒 VP2蛋白在干酪乳杆菌表面的表达[J].生物工程学报,2007,23(2):315-318.
[4]朱立平,陈清学.免疫学常用实验方法[M].北京:人民军医出版社,2000:441-442.
[5]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001:948.
[6]郑福英,刁有祥.应用间接免疫荧光法检测新型鸭瘟病毒[J].中国兽医科技,2003,33(10):47-50.
[7]徐义刚,唐丽杰,李一经,等.分泌型和非分泌型表达猪细小病毒VP2蛋白的重组乳酸菌经口免疫小鼠的效果分析[J].畜牧兽医学报,2007,38(12):1405-1409.

