新疆石河子地区犬细小病毒的分离鉴定与基因型分析
刘志强,张小莺,黄 新,王光雷,努 尔,赵军明,薄新文,王新华,钟发刚
(1.新疆建设兵团绵羊繁育基因工程重点实验室,新疆石河子832000;2.新疆畜牧科学院兽医研究所,新疆乌鲁木齐830000;3.德国柏林洪堡大学夏洛特医学院药理所,德国柏林10117)
犬细小病毒(canine parvovirus,CPV)是一种引起犬出血性肠炎或心肌炎的病毒[1]。欧洲首先在1976年和 1977年,在美国1978年都鉴定出存在CPV阳性血清.至1979年病例已蔓及世界各地[2-3]。1982年10月,我国报道在暴发传染性出血性腹泻的病犬粪便提取物中,发现细小病毒颗粒,其大小和形态结构具有典型的细小病毒特征,从而首次证实该病在我国的存在[4-5]。随后,在我国各地陆续有本病发生的报道。近年来随着城市宠物热的兴起,该病广泛的传播蔓延。据石河子市兽医防疫站初步统计,在犬的各种传染病中,犬细小病毒性肠炎发病率、死亡率均为最高,为当前犬的主要传染病之一。本实验室从病死犬的内脏中分离到1株犬细小病毒,初步命名为CPV-SHZ毒株。
1 材料与方法
1.1 病料及细胞 分别采集病死犬的心、肝、脾、小肠及内容物。CPV阳性血清(细小病毒疫苗免疫家兔制备)、F81猫肾传代细胞(购自中国科学院上海生科院细胞资源中心)。红细胞:采集健康猪抗凝的血液,洗涤后配成0.5%红细胞悬液备用。
1.2 主要试剂 RPMI-1640完全培养基(Gibco公司),犊牛血清(兰州民海生物工程有限公司),胰蛋白酶(Amresco),DNA Marker Gene Ruler 100bp DNA Ladder plus、PCR(上海生工生物工程技术服务有限公司),T aKaRa Ex Taq酶[宝生物工程(大连)有限公司]。PCR回收试剂盒(上海生工生物工程技术服务有限公司)。培养液为10%犊牛血清RPMI~1640,维持液为2%犊牛血清RPMI-1640,消化液为0.25%胰蛋白酶EDTA。
1.3 引物设计 根据已发表CPV的VP2基因序列利用Primer 5.0软件设计了1对引物,由上海生工生物工程技术服务有限公司合成。
上游引物(C1):5′-GGCAAGCT TATGAGTGATGGAGCAGTTC-3′
下游引物(C2):5′-CGCGTCGACTATGT TAATATAAT TT TCT-3′
1.4 病毒分离 采用同步接种法,同步接种F81猫肾细胞,24 h后将生长液弃去换上维持液,逐日观察,待出现明显的CPE(达80%)收毒,细胞长满单层未出现CPE继续传代,整个过程设有对照。收获病毒细胞培养物反复冻融3次,4 000 r/min离心30 min,上清液用氯仿处理2次,水相加入聚乙二醇-6 000(PEG),使其终浓度达 12%,4℃过夜,10 000 r/min离心30 min,沉淀用PBS稀释,打碎沉淀块,再次氯仿处理,水相即为病毒浓缩液。
1.5 病毒纯化 病毒浓缩液用Sepharose-4B柱层析,用 0.01 moL/L PBS(pH值 7.2)平衡并洗脱[6-7],分管收集,用电镜和SDS-PAGE电泳检测洗脱液中的病毒。
1.6 病毒鉴定
1.6.1 HA及HI试验 按文献[8-9]方法进行。1.6.2 病毒毒力测定 F81细胞在96孔板上滴定病毒的TCID50。并用5-IUDR处理待鉴定病毒进行核酸型鉴定。
1.6.3 电镜观察 按文献[1]方法进行。
1.6.4 VP2基因的扩增 取病毒浓缩液50 μ L隔水煮10 min后离心,上清即为模板。
PCR扩增体系:50 μ LPCR反应体系如下:(引物浓度 50 pmol/μ L),ddH2O(29.5 μ L),10 ×PCR Buffer(5 μ L),dNTP(8 μ L),模 板 (5 μ L),C1(1 μ L),C2(1 μ L),Taq 酶(0.5 μ L),PCR 反 应条件:95℃预变性5 min,94℃1 min,54℃1 min,72℃1.5 min,顺序30个循环,72℃再延伸10 min。反应结束,取少量PCR产物琼脂糖凝胶电泳检测扩增结果,阳性产物-20℃保存备用。
1.6.5 VP2基因的序列分析 应用回收试剂盒(上海生工生物工程技术服务有限公司)回收PCR产物,将回收产物连接pMD18-T载体上转化DH5α感受态细胞,37℃培养18~24 h,蓝白斑筛选阳性菌接种于5 mL LB液体培养基(含100 μ g/mL Amp+),37℃培养过夜,分装送上海生工生物工程技术服务有限责任公司进行测序。测序结果用序列分析软件进行比较。
1.6.6 动物回归试验 选取两月龄、未注射犬细小病毒疫苗易感犬5只,2只1组,分别皮下注射和口服途径接种2 mL CPV细胞培养物,余下1只隔离饲养设为对照,攻毒3 d后,每日收集犬肠内容物作PCR检测,逐日观察各项生理指标。
2 结果
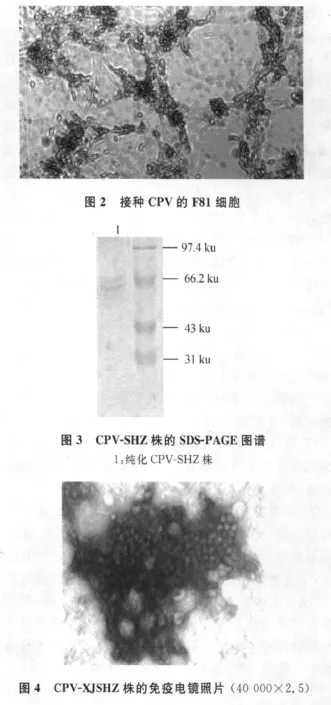
2.1 病毒分离结果 正常的F81细胞为贴壁生长、均质透明的不规则多边形(见图1)。接毒F81细胞,盲传3~4代可见特征病变:脱落、变形、游离、拉网(见图2)。

图1 正常的F81细胞
2.2 病毒纯化结果 病毒浓缩液经Sephrose-4B柱层析后,出现 2个洗脱峰,经 ELISA和 SDSPAGE电泳测定病毒抗原主要在第二峰,可见两条清晰的条带:76 ku的VP1,64 ku的VP2(见图3),与文献报道相[10]符合。免疫电镜观察结果(见图4),可见病毒粒子呈圆形或六边形,直径为20~24 nm,多数为实心,少数为空心,表面无囊膜,病毒粒子呈聚集状态。
2.3 病毒鉴定结果
2.3.1 HA和HI试验结果 病毒培养物能凝集猪的红细胞,其效价高于2×109,用已知CPV阳性血清可规律性的抑制其血凝作用。
2.3.2 PCR扩增结果 PCR扩增在1.7 kb处看到1条明亮的条带,与所设计目的条带大小相符合。2.3.3 病毒毒力测定结果 F81细胞测定CPVSHZ的TCID50为10-6.0,较加 5-IUDR处理(10-4.0)高3个对数。说明病毒代谢可被5-IUDR所抑制,其核酸类型属于DNA型。
2.3.4 序列分析结果 将测定核酸序列及推导的氨基酸序列与 CPV参考株 V154、LCPV-V204、LCPV-V139、LCPV-V203进行比较分析。从结果可看出此次分离到的CPV为2a型。但是其VP2的第970、971、1 694位氨基酸分别发生了A→T、T→A、G→A的替换。其第424位和564位氨基酸发生I→V和S→N的替换。
2.4 动物回归试验 两种途径接种试验动物犬,分别在第3天和第5天出现体温升高、厌食、精神沉郁、灰白色粥状样粪便等临床症状。病犬白细胞数减少到6 400个/mm3(未接种前试验犬的白细胞数为12 000~13 000个/mm3)左右。发病后7 d死亡,剖检可见尸体消瘦,严重脱水,皮肤干燥,有碎屑。可视黏膜苍白,眼球凹陷;胃内空虚,胃底部黏膜出血;空肠及回肠黏膜充血,肠腔扩张;肠内容物水样暗红色,有特殊的臭味,肠系膜淋巴结肿胀,肠绒毛明显萎缩,黏膜脱落。
3 讨论
3.1 病毒分离 用F81猫肾传代细胞增殖CPV出现了明显的CPE,这与前人的研究结果[11]相符合。为提高病毒的分离率,在粪便处理时可使用氯仿抽提,并按细胞培养液的1/20进行接种。由于CPV的DNA在复制时需要处于有丝分裂过程中宿主细胞某些机能的辅助[12],采取细胞培养同步接种病毒,能达到使病毒良好增殖的目的。
3.2 病毒鉴定 HA检测结果与犬细小病毒特性相符,并且能被CPV阳性血清规律性抑制,在日常应用中能经济、简便、快捷、可靠的对CPV作出鉴定;免疫电镜观察到大小均一、成聚集状态的病毒粒子,从形态上对CPV作以鉴定;根据犬细小病毒的基因组设计特异性寡核苷酸引物进行PCR扩增,经琼脂糖凝胶电泳检测到相应的目的条带。测序得到犬细小病毒VP2全基因组序列。序列比较分析,与CPV参考株同源性在99%以上。在分子水平上对CPV作以鉴定。
3.3 病毒纯化 用Sephrose-4B柱层析纯化CPV,具有操作简单、快速的特点,可以处理大量的病毒细胞培养物,纯化的病毒可用作制备诊断抗原和疫苗。3.4 序列比对分析 1978年CPV被发现至今,先后出现了 5个突变株亚型,即 CPV-2、CPV-2a、CPV-2b、CPV-2c(a)、CPV-2c(b)[13]。Parrish C R等[14]在研究CPV的进化时发现,CPV-2a是在1981年取代了自 1978年以来的CPV-2型,而CPV-2b抗原类型在1986年发现。CPV-2到CPV-2a、CPV-2b,只有几个碱基发生了变异,抗原则发生变异。CPV-2a(2b)VP2的87位、300位氨基酸和305位氨基酸与 CPV-2不同。CPV-2a和CPV-2b只有426位氨基酸不同,426D是CPV-2b特有的[15]。在CPV-2a和CPV-2b的VP2的第300位氨基酸发生G到D替换,分别命名为 CPV-2c(a)和 CPV-2c(b)[16]。本试验克隆了CPV-VP2基因的1 755 bp,从起始密码子到1 755 bp处,参照分型标准应为CPV-2a型,这与文献报道目前在我国流行的毒株以CPV-2a占主要地位相符合,这与CPV在意大利、澳大利亚和英国的流行情况相似。分离株在324、424位氨基酸与564位氨基酸突变,这种变异还未见文献报道,该位氨基酸变化是否引起生物学特性改变还有待进一步研究。
本试验通过新疆石河子分离株(CPV-SHZ)VP2基因的序列分析,为我国CPV分子流行病学调查提供了一定的参考依据,并为进一步探讨CPV的抗原变异及研制CPV基因工程疫苗奠定了基础。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]孔繁德,陆承平.CPV病原特性的研究概况[J].中国兽医科技,1995,25(1):18-20.
[3]丁壮,徐彦勤.犬细小病毒肠炎研究进展[J].辽宁畜牧兽医,1997,5:40-41.
[4]邱薇,范泉水,李作生,等.犬细小病毒的比较及分型研究[J].动物医学进展,2005,26(5):69-72.
[5]吴健敏,闵下沛.犬抗细小病毒抗体的调查[J].中国养犬杂志,1995,6(4):9-10.
[6]马波,向左云,钟光禄,等.应用凝胶过滤筛选甲型肝炎病毒介质[J].中国生物制品学杂志,2004,17(2):102-103.
[7]李茂祥,李俊宝,郑玉美.小鹅瘟病毒纯化及其理化特性的研究[J].病毒学报,1990,6(2):155-159.
[8]宋珍华,金淮,徐汉坤.犬细小病的血凝特性的研究[J].中国畜禽传染病,1998,50(1):5-7.
[9]朱君,李峰.犬细小病毒最佳血凝条件初探[J].畜禽业,2005,177(1):57-58.
[10]Hurtado A,Rueda P,Nowicky J,et al.Identification of Domains in Canine Parvovirus VP2 Essential for the Assembly of Virus-Like Particles[J].Journal of Virology,1996,70(8):5422-5429.
[11]Parker J S,Parrish C R.Canine parvovirus host range is determined by the specific conformation of an additional region of the capsid[J].Journal of Virology,1997,71(12):9214-9222.
[12]Parrish C R,Oconnel P H,Evermann J F,et al.Natural varition of canine parvovirus[J].Science,1985,230(4729):1046-1048.
[13]Battilani M,Ciulli S,Tisato E,et al.Genetic analysis of canine parvovirus isolates(CPV-2)from dogs in Italy[J].Virus Res,2002,83:149-157.
[14]Parrish C R,Aquadro C F,Strassheim M L,et al.Rapid and genic-ty pe replacement and sequence evolution of canine parvovirus[J].J Virol,1991,65(12):6544-6552.
[15]Q Qin,Loeffler I K,M Li K,et al.Sequence analy sis of a canine parvovirus isolated from a red panda(Ailurus fulgens)in china[J].Virus Gene,2007,34:299-302.
[16]Steinel A,Munson L,M Van Vuuren,et al.Genetic characterization of feline parvovirus sequences from various carnivores[J].J Gen Virol,2000,81:345-350.

