肠内免疫营养物对癌性恶病质小鼠营养和免疫状态的调控作用
郑亚兵,马胜林 ,姜初明 ,孔祥鸣,周卫民
(1.浙江省肿瘤医院,浙江 杭州 310004; 2.浙江中医药大学,浙江 杭州 310053)
癌性恶病质是癌症晚期的一个重要并发症,60%~80%的晚期肿瘤患者都存在此综合征,是癌症患者死亡的重要原因,约占50%以上[1]。笔者采用肿瘤特异性肠内免疫营养物supportan治疗小鼠癌性恶病质,观察其生理状况并对与癌性恶病质相关的血清细胞因子加以分析,探讨supportan的治疗作用,报道如下。
1 材料与方法
1.1 动物与试药
清洁级C57小鼠[合格证号为SCXY(沪)2003-0003,中国科学院上海实验动物中心]40只,雌雄各半,体重18~20 g,近交系。Lewis肺癌细胞株(中国科学院上海实验动物中心)。supportan(华瑞制药有限公司,批号为050908);醋酸甲羟孕酮(南京先河制药有限公司,批号为20051106,用蒸馏水配置成质量浓度为3 mg/mL的溶液);白细胞介素 1α(IL-1α)试剂盒(批号为 EK0391),白细胞介素 6(IL-6)试剂盒(批号为 EK0411),肿瘤坏死因子 α(TNF- α)试剂盒(批号为EK0527),均由博士德公司提供。
1.2 试验方法
建立癌性恶病质动物模型:在无菌条件下,剥离Lewis肺癌荷瘤鼠皮下瘤块,用手术刀切取瘤块外周供血丰富的瘤块组织,剪碎,放入细胞匀浆器中匀浆,将匀浆液用200目过滤网过滤,取过滤液显微镜下计数并调整浓度到1×107个瘤细胞(活细胞),取制好的瘤细胞混悬液接种于C57小鼠右上肢腋窝皮下处,每只0.1 mL(1×107个瘤细胞)。接种第8天各荷瘤组出现瘤块;接种第14天后,小鼠明显消瘦,体重下降且出现厌食、虚弱、衰竭,进入恶病质状态。
分组及试验方法:将40只小鼠随机均分成4组,非荷瘤空白对照(NTB)组、癌性恶病质(CC)组、supportan(ST)组、醋酸甲羟孕酮治疗(MPA)组,每组10只。取0.1 mL细胞混悬液按常规方法接种于CC,ST,MPA 3组小鼠的右上肢腋窝皮下,NTB组小鼠同部位注射等量生理盐水。接种14 d后恶病质状态出现,ST组予supportan肠内免疫营养治疗,200 mL/kg,灌胃,连续10 d;MPA组予醋酸甲羟孕酮,120 mg/kg灌胃,连续10 d。除ST组予supportan肠内免疫营养外,其余各组均予同一饲料和自来水饮食。
1.3 观察与测定指标
每2天称重1次,精确到0.1 g,称重时间选在上午8点至10点,各接种肿瘤组小鼠体重为除去瘤重(按肿瘤体积计算)后的体重。皮下接种第8天开始用游标尺测定肿瘤的三径,公式为肿瘤体积(V)=π/6·L·W·D。其中 L,W,D分别代表肿瘤的长、宽、深。取小鼠眼眦静脉血,放置1 h左右,待凝后经2 500 r/min离心15 min,即得小鼠血清标本,置-20℃冻存备检。用ELISA试剂盒测定(博士德公司,测定方法根据试剂盒说明)TNF-α,IL-1,IL-6。
1.4 统计学处理
2 结果
荷瘤组小鼠接种Lewis肺癌瘤细胞第8天右腋下出现瘤块;接种第14天后,瘤块明显增大,小鼠明显消瘦,体重下降且出现厌食、活动减少,进入恶病质状态;第21天,CC组小鼠较其他组小鼠明显消瘦,活动减少,摄食量下降,体重下降明显,并有1只雌性小鼠死亡;第24天,荷瘤组小鼠更加虚弱,摄食量减少,以CC组更明显。各组小鼠体重变化见表1。可见,第14天CC组、ST组、MPA组小鼠体重明显较NTB组下降,差异有显著性(P<0.05)。治疗后ST组、MPA组小鼠在第18天体重无明显下降,与CC组比较有显著性差异(P<0.05),第24天有非常显著性差异(P<0.01),提示经免疫肠内营养治疗和醋酸甲羟孕酮治疗后体重无明显下降。
表1 各组小鼠体重变化(± s,g)
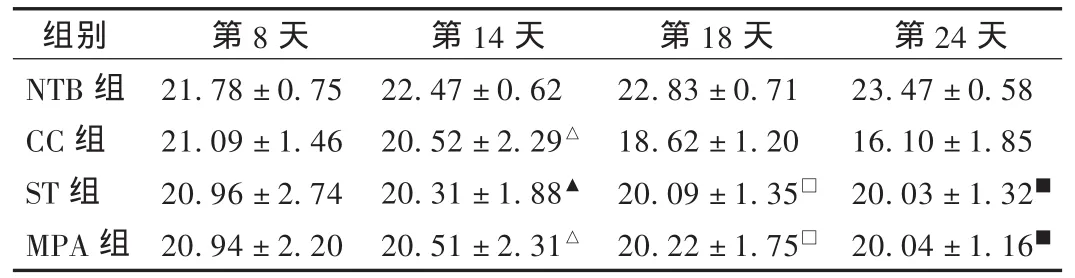
表1 各组小鼠体重变化(± s,g)
注:与 NTB组比较,△P<0.05,▲P<0.01;与 CC组比较,□P<0.05,■P <0.01(下表同)。
第24天23.47±0.58 16.10±1.85 20.03±1.32■20.04±1.16■组别NTB组CC组ST组MPA组第8天21.78±0.75 21.09±1.46 20.96±2.74 20.94±2.20第14天22.47±0.62 20.52±2.29△20.31±1.88▲20.51±2.31△第18天22.83±0.71 18.62±1.20 20.09±1.35□20.22±1.75□
血清细胞因子测定结果见表2。可见,IL-1,IL-6及TNF-α CC组、ST组、MPA组较NTB组均有不同程度升高,CC组升高最明显(P<0.01);用药后ST组及MPA组较CC组明显下降,有显著性差异(P<0.05);ST组与MPA组相比无显著性差异(P>0.05)。
表2 各组小鼠血清细胞因子测定结果(± s,pg/mL)

表2 各组小鼠血清细胞因子测定结果(± s,pg/mL)
组别NTB组CC组ST组MPA组IL-1 14.67±5.68 32.93±14.69▲22.89±6.18△□21.27±7.74△□IL-6 69.87±27.73 126.32±30.63▲85.79±19.48□92.63±31.18□TNF-α 63.42±12.94 89.03±12.90▲75.89±9.83△□73.97±10.82□
3 讨论
癌症患者发生恶病质的一个重要原因是营养底物代谢异常[2]。碳水化合物代谢异常主要表现为糖异生增加和胰岛素敏感性下降引起的葡萄糖利用下降。脂肪代谢异常表现为脂肪动员(包括脂肪降解和脂肪酸氧化)增加。肿瘤细胞由于缺乏脂肪代谢的关键酶,因此对脂肪利用障碍,主要利用葡萄糖作为能量来源。由于乳酸和成糖氨基酸大量糖异生时需要消耗大量的热量,致使基础代谢增加,蛋白分解加速。
在一些恶病质模型中,细胞因子IL-1,IL-6,TNF-α与恶病质的严重程度呈正相关。Bossola等[3]的研究中,TNF-α被认为是导致恶病质的一个重要因子,持续静脉注射TNF-α可引起试验动物厌食、体重减轻、蛋白质和脂肪分解。本研究证实,IL-1,IL-6,TNF-α均随着小鼠的去瘤体重下降而升高。因TNF-α能抑制脂蛋白脂酶(LPL)活性,由此推测IL-1和IL-6两种细胞因子也能抑制LPL活性,增加脂肪分解,降低蛋白质合成,从而导致小鼠体重减轻,出现恶病质。应用IL-1受体拮抗剂、抗IL-6抗体均可抑制恶病质的进一步发展[4]。
目前,尚无有效的治疗方法可以逆转进行性消瘦。近年来研究表明,免疫营养对肿瘤手术患者的免疫和炎性反应具有调节作用,可以减少手术并发症的发生[5]。supportan是根据癌症患者的代谢特点而设计的肠内免疫营养制剂,其组成特点是高热量密度,高蛋白、高脂肪含量(占热量的50%),富含免疫营养物ω-3脂肪酸、核苷酸和抗氧化剂维生素A,E,C。ω-3多不饱和脂肪酸(ω-3 PUFA)被认为在减缓肿瘤生长和癌性恶病质方面具有一定的治疗效果,其可能机制在于抑制NF-κB以减少环氧化酶2(COX-2)的表达,减少由NF-κB诱导产生的其他细胞因子对肿瘤细胞的促进作用。ω-3脂肪酸同时具有强有力的抗炎作用,可以抑制免疫抑制物前列腺素E2(PGE2)的产生。核苷酸具有免疫增强作用,可以提高肿瘤患者的免疫功能[6]。维生素E、维生素C可以帮助清除氧自由基,对手术创伤引起的缺血-再灌注损伤具有防治作用[7]。
由本试验结果可知,supportan具有明显抑制体重下降,明显下调与癌性恶病质发生相关的细胞因子TNF-α,IL-1,IL-6的血清水平,其抗癌性恶病质的作用机理与其配方符合肿瘤患者的代谢特点。与甲羟孕酮相比,无论是在改善摄食量、增加体重方面还是在下调细胞因子水平方面都无显著性差异,这肯定了supportan抗癌性恶病质的作用。
[1]Lawson DH,Richmond A,Nixon DW.Cachexia Annual Review of Nutrition[J].Ann Rev Nutr,1982,2:277-279.
[2]De Blaauw I,Deutz NEP,Von Meyenfeldt MF.Metabolic changes in cancer cachexia:first of two parts[J].Clin Nutr,1997,16(4):169-176.
[3]Bossola M,Muscaritoli M,Bellantone R,et al.Serum tumour necrosis factor-alpha levels in cancer patients are discontinuous and correlate with weight loss[J].Eur J Clin Invest,2000,30(12):1 107-1 112.
[4]Strassmann G,Fong M,Kenney JS,et al.Evidence for the involvement of interleukin 6 in experimental cancer cachexia[J].J Clin Invest,1992,89(5):1 681-1 684.
[5]Braga M,Gianotti L,Vignali A,et al.Immunonutrition in cancer surgical patients[J].Nutrition,1998,14(11):831-835.
[6]Wigmore SJ,Ross JA,Falconer JS,et al.The effect of polyunsaturated fatty acids on the progress of cachexia in patients with pancreatic cancer[J].Nutrition,1996,12(1suppl):S27-S30.
[7]Kinsella J,Lokesh B.Dietary lipids,eicosanoids and the im-munesystem[J].Crit Care Med,1990,18(2s):94.

