胃癌磁共振表观扩散系数测量方法的对照研究
唐磊 孙应实 曹 崔 齐丽萍 李洁 李晓婷 张晓鹏
北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所 医学影像科
恶性肿瘤发病机制及转化研究教育部重点实验室,100142,北京
磁共振扩散加权成像(D iffusion w eigh ted m agnetic resonance imaging,DW-MRI)通过检测生物体内水分子微观扩散运动状态的改变而间接反映组织结构信息[1-2]。近年来DWMRI在腹部的应用研究逐渐增多[3-5],但在胃癌仅见少量初步应用报道[6-8]。本研究拟在前期研究基础上,通过一组实施根治性手术的胃癌病例探讨不同测量方法所得ADC值的一致性,及各方法测得ADC值反映癌肿侵袭性的能力。
1 材料和方法
1.1 患者资料 搜集2006年9月至2008年5月在北京肿瘤医院行MRI检查的胃癌患者,入组标准:(1)胃镜病理证实的胃癌患者;(2)获得根治性手术切除;(3)术前两周内行MRI检查。排除标准:(1)MRI检查前行其他抗肿瘤治疗;(2)MRI检查禁忌证。男44例,女11例;年龄35~83岁,中位年龄64岁。癌肿部位:胃底贲门癌23例、胃体癌9例、胃窦癌21例、同时累及胃体及胃窦部2例。早期胃癌7例,进展期胃癌48例。相关检查均获得患者书面知情同意。
1.2 设备及参数 检查前12h禁饮食。如无禁忌证,检查前5m in~10m in肌内注射山莨菪碱20m g抑制胃肠蠕动,口服清水500m l~1000m l使胃腔适度充盈。常规取仰卧位扫描。检查前训练患者屏气,寻找最佳屏气耐受点。采用GE Signa 1.5T EchoSpeed Plus with Excite Ⅱ超导型MR扫描仪,梯度场强33mT·m-1,梯度切换率120m T·m-1·m s-1。8通道体部相控阵线圈结合ASSET技术,缩减因子为2。55例均行常规及DW-MRI检查。
常规MRI检查参数:以呼吸门控T2W I快速恢复快速自旋回波(fast recovery fast spin echo,FRFSE)序列为主,TR4000ms~8000m s,TE90m s,FOV 36cm×36cm~40cm×40cm,矩阵320×224,层厚5mm,层间距1mm,NEX4,回波链15;遇有运动伪影干扰严重者,补充T2W I单次激发快速自旋回波(sing leshot fast spin echo,SSFSE)序列,TR 2000ms,TE 90ms,FOV 36cm×36cm~40cm×40cm,矩阵384×256,层厚5mm,层间距1mm,NEX 0.57。冠状面和矢状面SSFSE T2W I联合扫描,参数同上。T1W I快速扰相梯度回波(fast spoiled gradient recalled echo,FSPGR)序列,反转角80°,TR170ms,TE4.2ms,FOV 36cm×36cm~40cm×40cm,矩阵320×160,层厚5mm,层间距1mm,NEX1。
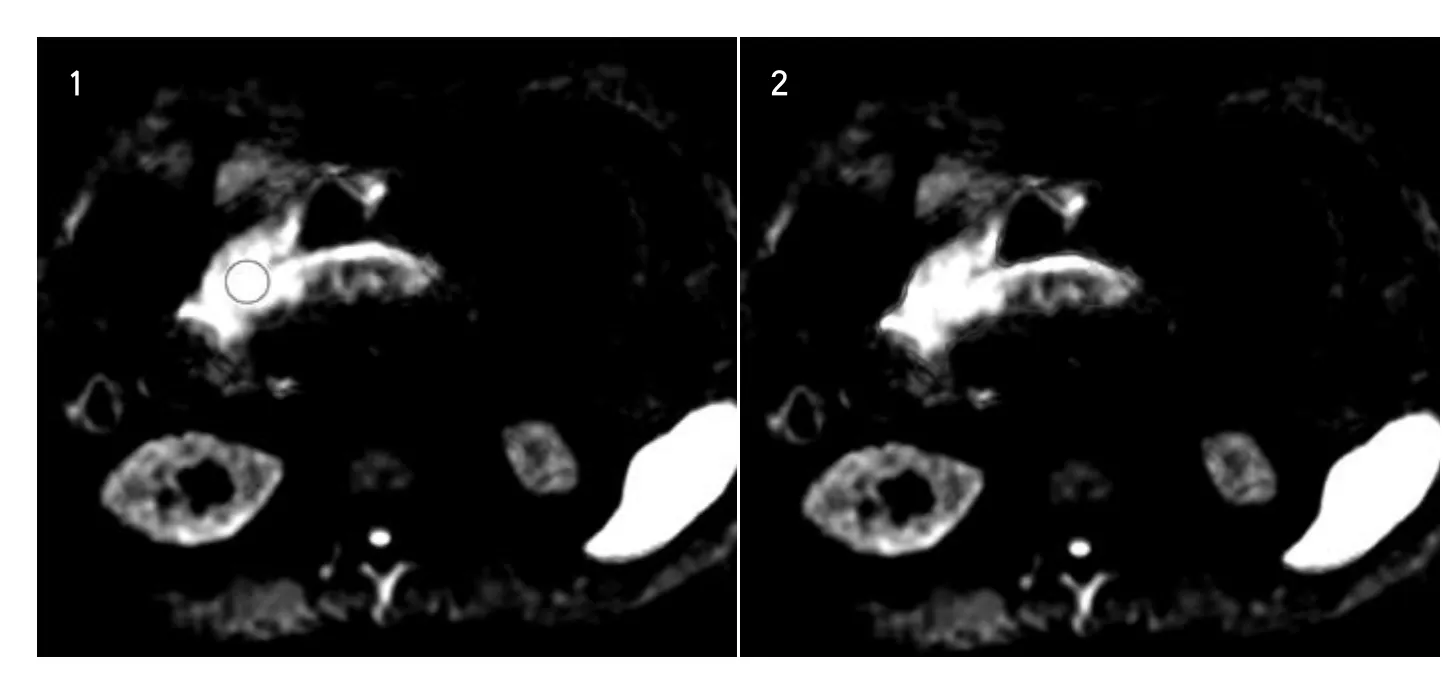
图1 胃窦癌局部测量(RM)法划定感兴趣区。以圆形小ROI包括扩散受限最明显的均匀高亮癌肿区。癌肿ADC值=0.89×10-3mm2/s。Figure1.ROI defined by RM method in a patient with gastric cancer on antrum. A round ROI w as placed to hold the highest signal w hich represent the diffusion confined area. The ADC of cancer w as 0.89×10-3mm2/s.图2 胃窦癌整体测量(WM)法划定感兴趣区。通过边缘勾勒的方法勾画出癌肿胃壁整体。癌肿ADC值=1.12×10-3mm2/s。Figure2.ROI defined by WM method in a patient with gastric cancer on antrum. An irregular ROI along the lesion contour w as p laced to hold the signal w hich represent the diffusion con fined area. The ADC of cancer w as 1.12×10-3mm2/s.
DW-MRI检查参数:单次激发平面回波(sing le-shot echop lanar im aging,SS-EPI)序列,b值取0s/mm2及1000s/mm2;TR2750m s,TE65m s,NEX 4,层厚5mm,层间距1mm,FOV36cm×36cm~40cm×40cm,矩阵128×128,3个扩散方向。结合分次屏气多信号平均技术,视患者屏气耐受情况,分2~3次屏气完成,保持每次屏气基线位于同一水平。
1.3 图像及数据处理 所有数据均传输至GE ADW 4.2工作站,由两名有经验的MRI诊断医师分别利用Functool 2软件独立处理完成。
首先由两名医师共同判断DW-MRI图像是否可用于诊断及ADC值测量,标准为图像无明显变形,无显著影响ADC值测量的伪影,病变与邻近胃壁存在可分辨的信号差异。两名医师意见存在分歧时交由一名更高年资医师进行决策。参考胃镜结果及常规MR图像定位病变后,窄窗DW-MRI图像上选取病变最大范围所在层面,采用两种方法测量ADC值:
(1) 局部测量(Regional measurement, RM):以圆形小ROI包括扩散受限最明显的均匀高亮癌肿区(图1);
(2) 整体测量(Whole measurement, WM):通过边缘勾勒的方法勾画出癌肿胃壁整体,DW-MRI范围显示不清者结合b=0 EPI图像及T2W I图像进行定位校准(图2)。
测量时需同时观察b=0 EPI图像,当图像由于宏观运动发生显著位移时,应用公式计算ADC值。ADC=ln(S2/S1)/(b1-b2),其中ln为自然对数,S1为b1=1000s/mm2时ROI区的信号强度,S2为b2=0时ROI区的信号强度。
以病理所见胃癌生长方式为评价癌肿侵袭性指标,分为两种类型:局限型癌肿与邻近胃壁有清晰分界,包括早期癌及Borrm ann1、2型癌,弥漫型癌肿与邻近胃壁分界不清,包括Borrmann3、4型癌。比较两种ADC值测量方法判断胃癌不同生长方式的评判效能。
1.4 统计学方法 利用SPSS11.5统计软件分析,计量资料进行正态性检验;两种测量方法的ADC值比较采用配对设计t检验;ROC曲线比较两种测量方法所得ADC值判断胃癌生长方式的效能。利用M edCalc 8.0统计软件分析两名医师的ADC值Bland-A ltman一致性分析;若两者测量结果一致性高则取平均作为相应测量方法的ADC均值。以P<0.05为差异有统计学意义。
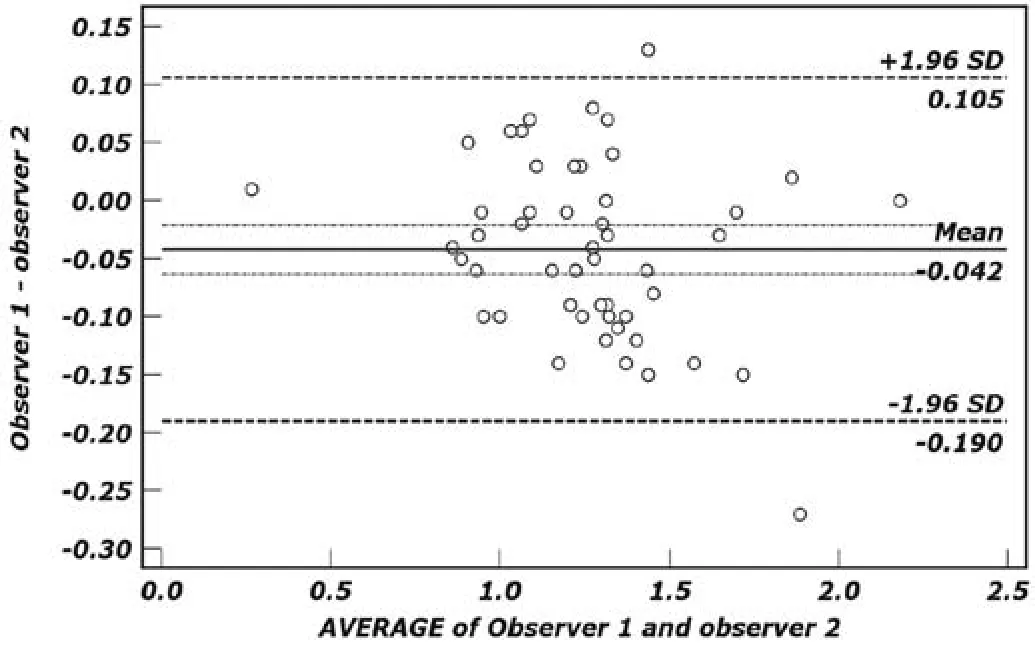
图3.两名观测者利用RM法测量ADC值一致性的Bland-A ltman分析。51个点在d线上下分布均衡,落在一致性界限外的数据点数为2个,占3.9%;一致性界限范围,下限为-0.190×10-3mm2/s,上限为0.106×10-3mm2/s。不同观测者利用该方法测得ADC值具有较好的一致性。Figu re 3. B land-A ltm an p lo t of the d ifferen ce betw een ADC m easurement for observer 1 and 2 against the mean measurement by RM mathod, with 95% lim its of agreement (both readers). Fifty-one scatters are around the bias line with no trend as the average varies and tw o values (3.9%) are outside of 95% LOA.The mean difference in ADC m easurement betw een the tw o observers w as -0.190×10-3 mm2/s (low er lim itation), and 0.106×10-3mm2/s (Upper lim itation). There w as good consistency betw een tw o observers.
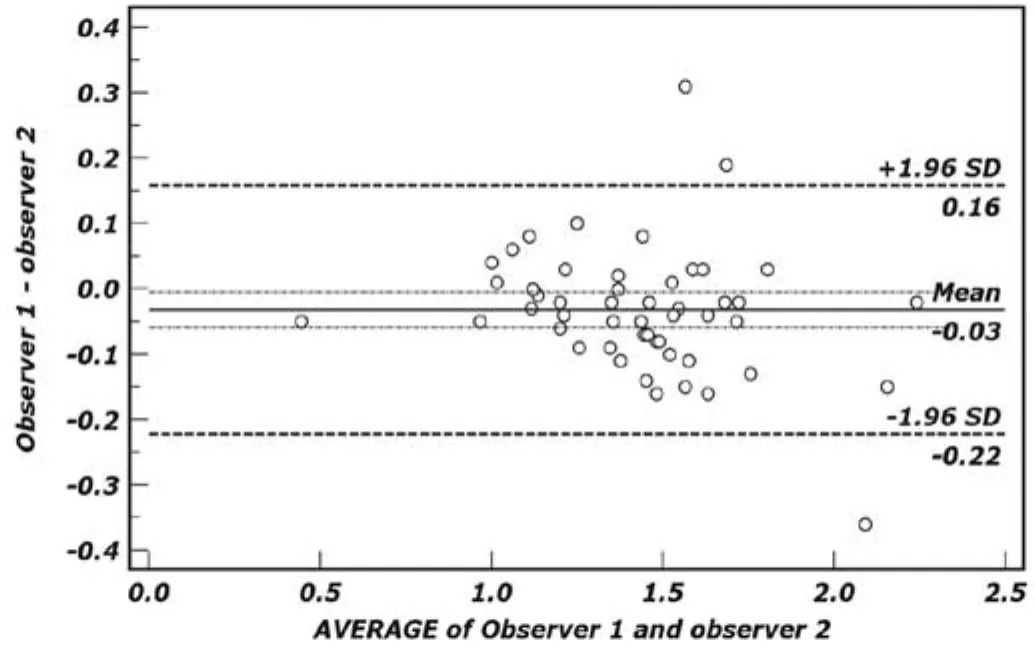
图4.两名观测者利用WM法测量ADC值一致性的B land-A ltm an分析。51个点在d线上下分布均衡,落在一致性界限外的数据点数为3个,占5.9%;一致性界限范围,下限为-0.223×10-3mm2/s,上限为0.158×10-3mm2/s。不同观测者利用该方法测得ADC值具有较好的一致性。Figu re 4. B land-A ltm an p lo t of the d ifferen ce betw een ADC measurement for observer 1 and 2 against the mean measurem ent by RM mathod, with 95% lim its of agreement (both readers). Fifty-one scatters are around the bias line with no trend as the average varies and three values (5.9%) are outside of 95% LOA.The mean difference in ADC measurement betw een the tw o observers w as -0.223×10-3mm2/s (low er lim itation), and 0.158×10-3mm2/s (Upper lim itation). There w as good consistency betw een tw o observers.
2 结果
共有55名患者入组研究。其中53例胃癌在DW-MRI图像上得到显示,2例因伪影干扰无法准确测量ADC值,最终51例入组本项对ADC值测量方法的对照研究。
观测者1利用R M法测得胃癌癌肿的A D C值为(1.24±0.30)×10-3mm2/s,低于WM法测得胃癌癌肿的ADC值(1.41±0.30)×10-3mm2/s(t=-10.202,P<0.001);观测者2利用RM法测得胃癌癌肿的ADC值为 (1.28±0.31)×10-3mm2/s,低于W M法测得胃癌癌肿的ADC值(1.44±0.33)×10-3mm2/s(t=-8.732,P<0.001)。
两种测量方法在两名观测者间均具有较好的一致性,其中RM法(一致性点比例96.1%,2/51)略优于WM法(一致性点比例94.1%,3/51)。
B land-A ltam n分析,两名观测者利用RM法重复测量的差值均数为-0.042×10-3mm2/s[95%CI:(-0.064~-0.021)×10-3mm2/s],标准差为0.075,重复性系数为0.147。结合图3可以看出,代表差值均数的蓝色实线(d线)接近零水平线,51个点在d线上下分布均衡,落在一致性界限外的数据点数为2个,占3.9%(2/51);一致性界限范围,下限为-0.190×10-3mm2/s[95%CI:(-0.227~-0.154)×10-3mm2/s],上限为0.106×10-3mm2/s[95%CI:(0.069~0.142) ×10-3mm2/s]。
两名观测者利用WM法重复测量的差值均数为-0.032×10-3mm2/s[95%CI:(-0.060~-0.005)×10-3mm2/s],标准差为0.098,重复性系数为0.191。结合图4可以看出,代表差值均数的蓝色实线(d线)接近零水平线,51个点在d线上下分布均衡,落在一致性界限外的数据点数为3个,占5.9%(3/51);一致性界限范围,下限为-0.223×10-3mm2/s[95%CI:(-0.270~-0.176) ×10-3mm2/s],上限为0.158×10-3mm2/s[95%CI:(0.111~0.205) ×10-3mm2/s]。
手术病理见胃癌弥漫型生长35例,局限型生长16例。将两名观测者分别利用RM和WM法测得的ADC值加和取平均,得到两种测量方法各自的ADC值均值,进行胃癌生长方式判断的ROC曲线分析。RM法测得ADC值判断胃癌弥漫型生长的曲线下面积0.863,略高于WM法测得ADC值判断胃癌弥漫型生长的曲线下面积0.828(图5)。
3 讨论
随着磁共振快速成像序列及软硬件技术的发展,磁共振扩散加权成像在腹部的应用报道日渐增多[3-5],但应用于胃癌的报道少见[6-8];相关文献主要侧重于成像参数及辅助检出等初步应用探索[6-8],关于胃癌ADC值的测量方法及测量一致性,尚未见有文献报道。ADC值是反映组织内水分子扩散能力大小的表观系数值,目前已有诸多关于颅脑及体部实质性脏器DW-MRI成像的研究证实,ADC值可作为肿瘤影像学评价的功能性指标,在肿瘤良恶性判断、侵袭性、放化疗疗效预测随访等多方面价值正得到不断发掘[9-12]。但是,受到DW-MRI成像分辨率以及肿瘤病变不均质性的影响,ADC值测量的可重复性评价成为各部位肿瘤在进一步临床应用前需要明确和统一的重要步骤[13,14]。
本研究参考相关文献[15,16],针对胃癌癌肿DW-MRI信号不均一的特点,设计了两种ADC值测量方法,一种是针对癌肿均匀高信号区的小RO I局部测量法(RM法),通过窄窗设置突出显示扩散受限最明显的高亮区域,以类圆形RO I包括此区域信号成分,特点是可以避开变性坏死区及周围正常组织部分容积效应的干扰,能够反映组织中扩散受限最明显的区域、往往也是代表肿瘤活性最高区域的特征。同时,类圆形ROI的划取和放置操作相对简便。其不足之处是无法反映胃癌癌肿的整体特征。另一种是针对癌肿全体的边缘勾勒整体测量法(WM法),以不规则线圈入胃癌癌肿整体,其特点是能够反映胃癌的整体特征,有利于胃癌放化疗评效时对癌肿整体变化的评价,不利之处是边缘判断难度相对较大,有时需结合b=0 EPI图像甚至常规T2W I序列判断。另外,边缘勾勒描画操作较类圆形ROI复杂,受操作者主观因素干扰的程度更大。
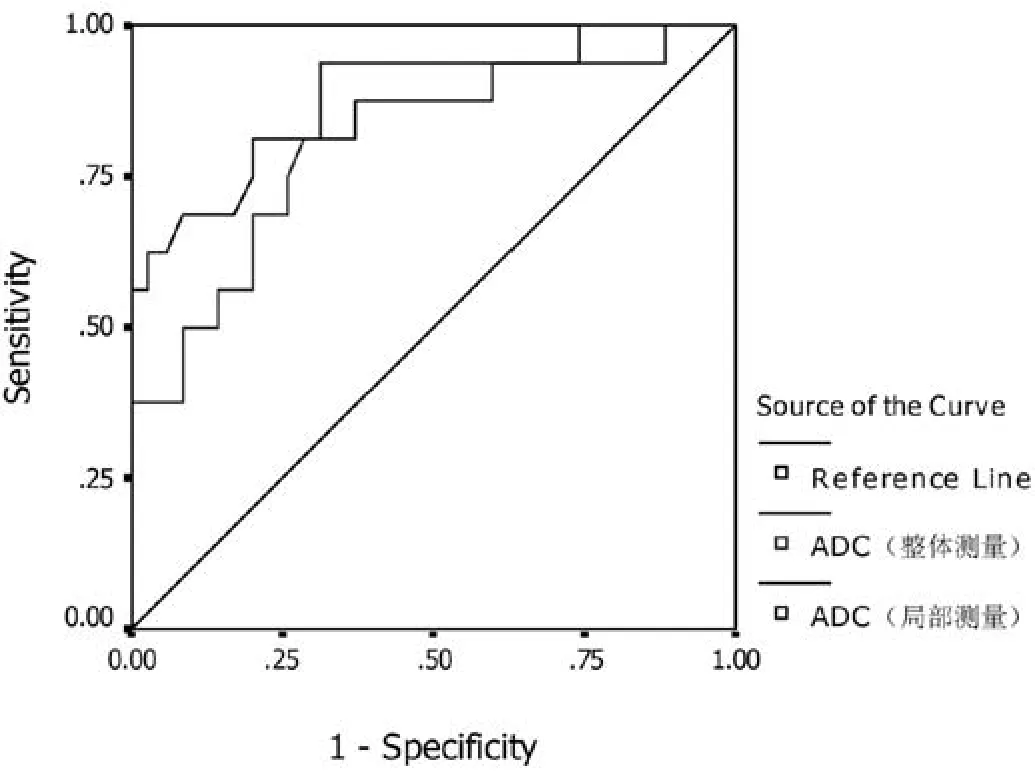
图5.RM法与W M法测得A DC值评判胃癌生长方式的ROC曲线。RM法测得A DC值判断胃癌弥漫型生长的曲线下面积0.863,略高于W M法测得A DC值判断胃癌弥漫型生长的曲线下面积0.828。Figure 5. The ROC curve of ADC evaluation the gastric cancer grow th types used RM and WM. The AUC of ADC judgem ent of in filtration grow th by RM w as 0.863, w hich w as higher than WM with 0.828.
对于两种方法在不同操作者间的可重复性,本研究采用B land-A ltm an法进行了分析。其利用两种测量方法所得对象的差值和均值分别为x、y轴构建二维直角坐标系;代表差值均数的实线(图3、4蓝色实线)接近零水平线、落在一致性界限范围(图3、4两条棕色虚线内)外的数据点比例<5%,则认为两种测量方法的一致性较高[15,17]。本组研究两种测量方法的差值均数均较低且接近零水平线,其中RM法落在一致性界限外的数据点比例占3.9%,小于5%规定值;WM法比例略高为5.9%,基本接近规定值。上述结果表明两种ADC值测量方法在不同测量者间均具有较好的一致性,其中RM法测量的一致性略优于WM法,具体到临床应用时可根据不同的目的需要进行方法选择。
既往对肿瘤ADC值的应用研究表明,其和癌肿侵袭性存在一定相关关系。Sugahara等[18]报道高分化脑胶质瘤的ADC值低于低分化胶质瘤。Kono等[19]报道Ⅱ级星形细胞瘤与胶质母细胞瘤ADC 值存在差异,ADC 值可反映肿瘤细胞的构成。Yoshikawa等[20]报道不同亚型乳腺癌的ADC值差异存在统计学意义。根据上述研究结果,推测胃癌ADC值同样可能为胃癌生物学行为的影像学量化评价提供辅助信息。本研究通过ROC曲线对RM和WM两种测量方法所获得的ADC值判断癌肿侵袭性的能力进行比较,结果发现两者AUC均达到0.8以上,评价效能属于中等水平,且前者略高于后者。结合文献分析,生长方式是反映胃癌侵袭性的重要指标,侵袭性高的肿瘤细胞增殖活跃,癌细胞数目及大分子癌性间质成分相对偏多,水分子扩散自由度降低,故ADC值常偏低[21]。另外,侵袭性低的乳头状腺癌或管状腺癌细胞多呈腺管状排列,多发空腔结构可能也是导致扩散受限相对较轻的原因。RM法测得的ADC值排除了变性坏死成分或可能存在的粘液腺癌粘液成分的干扰,可较为灵敏客观的反映肿瘤活性区域的组织特征,故对于胃癌侵袭性的评判能力略优于WM法测得的ADC值。
本研究存在的不足之处:首先,由于采用屏气EPI序列为DW-MRI成像的基础序列,受到信噪比低及伪影变形等因素的影响,部分病变未能得到清晰显示或准确的ADC值测量,结合基于FSE序列的DW-MRI及呼吸触发技术后可能会进一步提高胃癌DW-MRI的显示能力。其次,本组病例报告的ADC值较既往研究偏高[6,8],考虑与病期较早(均为根治性手术切除的患者)有关,进一步扩大病例数目和类型可能会得到更为客观全面的结果。最后,缺乏病理细致对照,无法对造成两种测量方法ADC值差异的组织学基础进行进一步分析,也是本研究的不足之处。ADC值在胃癌临床应用中的更深层价值尚需继续积累病例进一步探索。
Reference
1.Patterson DM, Padhani AR, Collins DJ.Technology insight: w ater diffusion MRI--a potential new biomarker of response to cancer therapy. Nat Clin Pract Oncol, 2008, 5(4):220-233.
2.Qi LP, Zhang XP, Tang L, et al. Using
diffusion-w eighted MR imaging for tumor detection in the collapsed lung: a preliminary study. Eur Radiol, 2009, 19(2): 333-341.
3.Cui Y, Zhang XP, Sun YS, et al. Apparent diffusion coefficient: potential imaging biomarker for prediction and early detection of response to chemotherapy in hepatic m etastases. Rad io logy, 2008, 248(3):894-900.
4.Schram l C, Schw enzer NF, Martirosian P,et al. Diffusion-w eighted MRI of advanced hepatocellular carcinoma during sorafenib treatment: initial results. AJR, 2009,193(4): W 301-307.
5.Sandrasegaran K, Sundaram CP, Ramaswamy R, et al. Usefulness of diffusion-weighted imaging in the evaluation of renal masses.AJR, 2010, 194(2): 438-445.
6.唐磊, 张晓鹏, 孙应实, 等.胃癌磁共振扩散加权成像:并行采集联合分次屏气多信号平均技术的临床研究.中国医学影像技术, 2005,21(12): 1830-1834.
Lei TANG, Xiao-peng ZHANG, Ying-shi SUN, et al. Diffusion-weighted M R im aging of gastric cancer-study of parallel imaging combined with separate breath--holds and m ulti-_NEX technique. Chin J Med Imaging Technol, 2005, 21(12): 1830-1834.
7.Shinya S, Sasaki T, Nakagawa Y, et al.The usefulness of diffusion-weighted imaging(DW-MRI) for the detection of gastric cancer.Hepatogastroenterology. 2007, 54(77): 1378-1381.
8.张晓鹏, 唐磊, 孙应实, 等.胃癌MR扩散加权成像扩散敏感因子的选择及其与常规序列的对照研究.中华放射学杂志, 2007, 41(12):1339-1343.
Xiao-peng ZHANG, Lei TANG, Ying-shi SUN, et al. MR difusion weighted imaging of gastric cancer: b-value determination and comparison with routine sequence. Chin J Radiol, 2007, 41(12): 1339-1343.
9.Padhani AR, Liu G, Koh DM, et al.Diffusion-w eighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neop lasia, 2009,11(2):102-125.
10.Okamoto K, Ito J, Ishikaw a K, et al.Diffusion-w eighted echo-planar MR imaging in differential diagnosis of brain tumors and tumor-like conditions. Eur Radiol, 2000,10(8): 1342-1350.
11.Shen SH, Chiou YY, W ang JH, et al.Diffusion-w eighted single-shot echo-planar imaging with parallel technique in assessment of endom etria l cancer. A JR, 2008,190(2):481- 488.
12.Razek AA, Elmorsy A, Elshafey M, et al.Assessment of mediastinal tumors with diffusionweighted single-shot echo-planar MRI. J Magn Reson Imaging, 2009, 30(3): 535-540.
13.Koh DM, Blackledge M, Collins DJ, et al.Reproducibility and changes in the apparent diffusion coefficients of solid tumours treated with combretastatin A4 phosphate and bevacizumab in a two-centre phase I clinical trial. Eur Radiol, 2009, 19(11): 2728-2738.
14.Kw ee TC, Takahara T, Koh DM, et al.Comparison and reproducibility of ADC measurements in breathhold, respiratory triggered, and free-breathing diffusionweighted MR imaging of the liver. J Magn Reson Imaging, 2008, 28(5): 1141-1148.
15.郭雪梅,王霄英,吴冰,等. 两种前列腺外周带ADC值测量方法的效能比较. 中国医学影像技术, 2008, 24(8): 1236-1239.
Xue-mei GUO, Xiao-ying WANG, Bin WU,et al. Impact of different methods for apparent diffusion coefficient measurement on diagnosis of peripheral zone of prostate. Chin J Med Imaging Technol, 2008, 24(8): 1236-1239.
16.李艳玲,张晓鹏,曹 ,等. 乳腺动态MR成像:两种感兴趣区法对时间信号强度曲线的评价研究. 中国肿瘤影像学, 2008, 1(1):57-60.
Yan-ling LI, Xiao-peng ZHANG, Kun CAO,et al. Dynamic MR mammography: evaluation of time-signal intensity curves with tw o region-of-interest analysis methods. Chin J Oncoradiol, 2008, 1(1): 57-60.
17.陈卉. Bland-A ltman分析在临床测量方法一致性评价中的应用. 中国卫生统计, 2007,24(03): 308-309.
Hui CHEN. The application of Bland-Altman in the measurement concordance of clinical test.Chinese Journal of Health Statistic. 2007,24(03): 308-309.
18.Sugahara T, Korogi Y, Kochi M, et al.Usefulness of diffusion-weighted MRI withecho-planar technique in the evaluation of cellularity in gliomas. J Magn Reson Imaging,1999, 9(1):53-60.
19.Kono K, Inoue Y, Nakayama K, et al. The role of diffusion-weighted imaging in patients with brain tumors. Am J Neuroradiol, 2001,22(6): 1081-1088.
20.Yoshikawa MI, Ohsumi S, Sugata S, et al.Relation between cancer cellularity and apparent diffusion coefficient values using diffusionweighted magnetic resonance imaging in breast cancer. Radiat Med, 2008, 26(4): 222-226.
21.Herneth AM, Guccione S, Bednarski M.Apparent diffusion coefficient: a quantitative parameter for in vivo tumor characterization.Eur J Radiol, 2003, 45(3): 208-213.

