胃间质瘤MDCT征象与临床病理对比分析
董军强 高剑波 张智栩 郭华 岳松伟潘元威
郑大一附院放射科, 450052, 郑州
胃肠间质瘤(gastrointestinal stromal tumors, GISTs)是消化道最常见的间叶源性肿瘤,多发生于胃肠道、网膜及肠系膜,其中60%~70%发生于胃[1],胃间质瘤称为GSTs(gastric stromal tumors),本文收集了27例GSTs,分析其MDCT表现,并与临床病理对照,探讨CT诊断GSTs的价值。
1 材料与方法
1.1 资料
收集2009年3月至2010年2月间经病理及免疫组化证实的GSTs27例,回顾性分析其MDCT影像资料,男19例,女8例,年龄18~78岁,中位年龄55岁,50岁以上18例。临床症状:无症状体检发现4例,腹部不适17例,腹痛11例,扪及腹部包块8例,呕血2例,黑便4例。
1.2 扫描方法
所有病例应用GE Lightspeed 64排螺旋 CT进行平扫及三期动态增强扫描,扫描前15分钟肌注654-2 10m g并嘱患者口服温开水800m l~1000m l,扫描条件:电压120Kv,电流为自动m A控制,准直器宽度0.625mm,重建间隔0.625mm,螺距为1,对比剂为碘海醇(350m g I/m l),经肘静脉注射,速率为4m l/s,总量为70m l~100m l,扫描时相动脉期为23s~26s,静脉期65s,延迟期120s~300s,数据传输至ADW 4.3工作站进行后处理,采用多平面重建(MPR,multiplanar reformatted),层厚一般为5mm,重建包括横断位、冠状位、矢状位及斜位。
1.3 图像分析
由多名高年资诊断医师对肿瘤进行定位定性分析,包括起源、大小、边缘、密度变化、强化程度、周围组织毗邻关系、有无转移等。
1.4 诊断标准
参照文献[2-5]将GSTs良恶判断标准分为良性、潜在恶性及恶性。恶性指标:⑴肿瘤具有浸润性,与周围结构分界不清,⑵出现远隔脏器转移。潜在恶性指标:⑴肿瘤直径>55mm,⑵表面溃疡,⑶肿瘤有坏死。当肿瘤具备一项恶性指标,或两项潜在恶性指标时则为恶性;仅有一项潜在恶性指标时,则为潜在恶性;没有上述指标时为良性。
1.5 病理结果判定
按照病理标准,由专业病理医师根据肉眼观察、显微镜观察及免疫组化测定,对GSTs起源、良恶性做出诊断。
2 结果

表1 27例GSTs CT征象与病理结果对照Tab le1 Com parision of CT signs and pathological results of 27 GSTs

图A、B为同一患者,病理结果为良性胃间质瘤,图A:平扫见胃大弯侧类圆形肿块,突向腔内,表面见低密度溃疡,图B为增强动脉期图像,呈明显均匀强化,大小约为26mm×31mm。Figu re A,B is the sam e pa tien t,path o log ica l resu lt:benign GST, Figure A:it show s a round shape mass with the surface u lcer proturding to the gastric cavity on the w all of greater curvature of the stom ach in p lain CT scan. Figure B:A rterious phase:it show s a mass with obvious homogeneous enhancem ent and its size is 26mm×31mm.图C、D为同一患者,恶性胃间质瘤,图C为增强动脉期,胃腔外生长肿块呈明显不均匀强化,周边为著,中心见低密度坏死影,图D为静脉期冠状位重建,肿块实性部分强化明显较均匀,坏死区不强化。Figu re C,D is the sam e patien t,path o log ica l result:malignant GST, Figure C:A rterious phase:it show s a ex tra lum inal grow th mass with obvious nonhomogeneous enhancement,enhancem ent of the margin is m ore obvious,low density is necrosis in the center of mass, Figure D:Venous phase and coronal section reconstruction.the solid part of mass is significantly and homogeneously enhanced,there is no enhancem ent in necrosis field.
2.1 病理及免疫组化结果
穿刺7例,手术22例,其中穿刺后手术2例,良性5例,潜在恶性13例,恶性9例,手术者检出淋巴结共35个,未见转移。免疫组化:CD117(+)18例,CD117(±)7例,CD117(-)2例,CD34(+)17例,CD34(±)9例,CD34(-)1例。
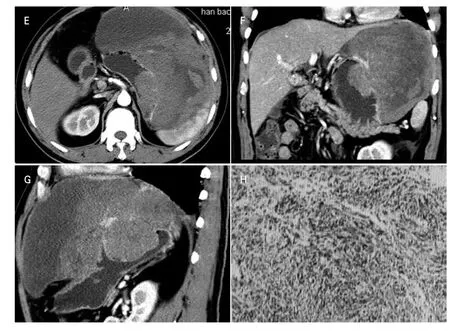
图E-G为同一患者的增强轴位及冠状位、矢状位重建图像,较大肿块呈腔内外生长,实性部分强化明显,坏死区不强化,图H与图E-G为同一患者,病理结果(H E×200):恶性胃间质瘤。Figure E-G is the same patient with ax ial,coronal and saggital post-con trast im aging,it show s a intra-ex tra-lum inal grow th big mass with obvious enhancem ent in solid region and no enhancem ent in necrosis field. Figure H is the sam e patient with figu re E-G, p a th o log ica l resu lt(H E×200):malignant GST.
2.2 CT结果部位
生长于胃底9例,胃体12例,胃窦5例,食管下端及贲门1例。大小:肿瘤最大者220mm×150mm×130mm,最小者直径约为26mm×31mm(图A、B),平均直径约为57mm。生长方式:向胃腔外生长者11例,胃腔内生长9例,腔内外生长7例。表面溃疡13例,中心坏死21例。增强结果:均匀较明显强化4例,不均匀强化23例,发现胃小弯侧肿大淋巴结,考虑转移1例,肝脏多发低密度影,环形强化考虑转移2例,骨多发骨质破坏,考虑转移1例。
2.3 27例间质瘤CT正确定位诊断26例,准确率为96.3%,其中一例位于小网膜囊,CT错误诊断为腹膜后肿瘤,定性诊断21例,准确率为77.8%,错误诊断为胃癌2例,胃淋巴瘤1例,腹腔转移瘤2例,腹膜后肿瘤1例,分级诊断正确16例,准确率为59.3%。
2.4 CT诊断结果与病理结果对照(见表1)
表1中数据结果显示:肿瘤大小方面,7例直径<55mm的GSTs中良性居多,5例为良性,2例为潜在恶性,而20例直径≥55mm的GSTs中恶性居多,良性0例,潜在恶性11例,恶性9例,肿瘤生长方式方面,腔内生长者9例,其中良性4例,潜在恶性3例,恶性2例,腔外生长者11例,其中良性仅1例,潜在恶性7例,恶性3例,腔内外生长者7例,均为恶性,其中潜在恶性3例,恶性4例,肿瘤内部有坏死征象者以恶性较多(图C、D),良性仅1例,潜在恶性及恶性分别为12例和8例,肿瘤无坏死者6例,其中4例为良性,边界清晰者也以良性居多,7例边界清晰者5例为良性,恶性肿瘤多边界模糊,20例边界不清者潜在恶性及恶性者分别为11例和9例,强化特征方面,良性肿瘤多均匀强化,4例均匀强化者均为良性,而恶性肿瘤多不均匀强化(图E-H),23例不均匀强化者良性仅1例,潜在恶性及恶性分别为13例和9例。
3 讨论
3.1 GSTs的病理学特点
80年代前,间质瘤病理学上常被误诊为平滑肌源性或神经源性肿瘤,但随着免疫组化及电镜技术的发展,研究者起初发现间质瘤是起源于一种具有多分化潜能干细胞(cajal细胞)的肿瘤,于是在1983年M azur和Clark首先提出了“胃肠间质瘤(GIST) ”的概念[6],现多数人认为GISTs起源于一种具有多向分化潜能的间质干细胞。胃肠道间质瘤常发生于50岁以上中老年人,60%~70%发生于胃,20%~30%发生于小肠、食管、网膜等其他部位的发生率约10%[7]。生长特点:良性GSTs主要呈膨胀性生长,潜在恶性及恶性GSTs呈侵袭性生长,边界不清,向腔内生长者多为良性,边界清,坏死少见,向腔外生长者恶性者居多,周围组织受侵常见,而且多见出血坏死,孙勇一组43例GISTs结果显示:呈现腔内/外生长的胃间质瘤,更加倾向于恶性,恶性程度方面腔内/外型>腔外型>腔内型[8]。本组结果亦显示跨胃壁生长及胃外生长者恶性程度较高,18例中17例为恶性或潜在恶性。临床症状:常见腹部包块、腹部不适及消化道出血。大体病理上,良性GSTs多为境界清楚的孤立性圆形或椭圆形肿块,体积多较小,边界清楚,肿瘤切面灰白,呈编织状,质硬韧,少见出血或坏死灶。恶性GSTs体积多较大,形状差异较大,边界欠清,切面呈灰白色或呈鱼肉状,较大的肿瘤内可见明显的粘液样变、出血坏死、囊性变[9],显微镜下GISTs由上皮样细胞和梭形细胞组成,排列方式较复杂,上皮样细胞占优势时称上皮样间质瘤,梭形细胞成分为主时称梭形细胞间质瘤,两种比例大致相同时称混合型间质瘤。免疫组化特点:GISTs来源的间质干细胞属于髓细胞样干细胞,含有c-kit原癌基因,其CD117 和CD34 呈阳性表达,研究表明CD117和CD34为GISTs重要标志物。81%~100%的GISTs CD117呈弥漫性表达,而平滑肌细胞和神经纤维不表达CD117。56%~82%的GISTs肿瘤细胞中,CD34呈弥漫阳性表达,并且良性的GISTs的CD34表达较高,联合检测CD117和CD34的表达对本病的诊断有较高的价值[10],其它免疫标记物如destin、S-100、nestin、NSE等,有利于了解GISTs细胞的分化方向及鉴别诊断。本组27例中CD117阳性、局灶阳性或倾向阳性者达25例,仅有2例阴性,但CD34均为阳性,其它免疫组化指标均为阴性,故此亦给出了GSTs的诊断,27例中CD34阳性、局灶阳性或倾向阳性者达26例,仅有1例阴性,结合CD117阳性结果,也诊断为GST。
3.2 GSTs的CT征象
3.2.1 GSTs的大小
本组中GSTs最大者220mm×150mm×130mm,最小者直径约为26mm×31mm,平均直径约为57mm,大小在55mm以下的GSTs有7例,其中良性5例,潜在恶性2例,大小在55mm以上的GSTs有20例,其中良性0例,潜在恶性11例,恶性9例,恶性肿瘤共计22例,55mm以上的恶性肿瘤占90.9%,本组结果显示肿瘤大小是判断良恶性的一个重要指标,K ima[11]等也认为肿瘤大小是影像学评价其良恶性程度的最可靠征象。
3.2.2 GSTs的形态及生长方式
肿瘤的形态决定于肿瘤的生长方式,而肿瘤的生长方式决定于其良恶性,良性肿瘤生长缓慢,一般多为膨胀性生长,有包膜,呈类圆形,密度均匀,周围组织呈现受压移位改变,而恶性肿瘤多为侵袭性生长,生长迅速,形态不规则,常见分叶征、毛刺征,中心组织因生长迅速而营养不足,导致缺血坏死、囊变、粘液样变等,周围组织结构常呈受侵犯改变,本组中发现表面溃疡者13例,中心坏死者21例,恶性GSTs为20例(20/21),且坏死者直径大多在50mm以上,因此认为中心坏死对诊断GSTs的良恶性有一定意义。本组中胃腔内生长者9例,基本征象为胃腔内圆形或椭圆形肿块,边界光滑,与胃壁间夹角为锐角,垂直于胃壁向腔内生长,直径55mm以上3例,55mm以下6例,表面溃疡者3例,跨胃壁生长者7例,基本征象为胃腔内外均可见软组织肿块影,有分叶,腔内小,腔外大,跨胃壁处狭窄,呈“8”字形,垂直于胃壁向腔内外生长,直径均大于55mm,胃腔外生长者11例,基本征象为胃腔外圆形或椭圆形、不规则形肿块,边界光滑或不光滑,与胃壁间夹角为锐角,亦垂直于胃壁向腔外生长,较大者判断起源困难,对于此三种肿瘤生长方式,冠状位重建及肿块切线位的斜位重建有助于判断肿块与胃壁的关系。
3.2.3 GSTs的强化特征
应用MDCT多期扫描,可得到肿块的动态血供情况,动脉期血供丰富者可以看到肿瘤血管,部分可见肿瘤的供血动脉起源,应用三维重建显示更加清晰,可为临床手术或介入治疗提供血供情况,多期对比可以显示肿块的血供变化情况,静脉期或延迟期显示肿瘤与周围组织关系更清晰。良性GSTs一般多为较均匀一致的中等程度强化,本组中4例强化均匀者均为良性,强化程度变化不大。恶性或潜在恶性GSTs因肿瘤成分不同及生长速度的差异,导致强化多为不均匀强化,常见索条状、结节状、辐辏状强化,强化程度从轻微至明显强化,胃腔外生长者可见肿块起源处胃壁增厚并明显强化,呈粘膜线征,有助于GSTs起源诊断。本组中不均匀强化23例,明显强化者3例,中等程度不均匀强化20例,其中1例为良性,22例为恶性及潜在恶性,因此认为不均匀强化可以作为诊断恶性GSTs的征象之一。另外增强扫描亦可发现平扫未能发现的转移灶,肝转移多呈环形强化。
3.2.4 GSTs的鉴别诊断
GSTs的CT表现具有一定的特征性,但有些不典型病例,需与其它肿瘤相鉴别[12]:(1)胃癌:起源于上皮组织,常见粘膜破坏中断,溃疡形成,呈沿胃壁生长特性,局部侵犯及淋巴结转移常见,增强呈明显强化且延迟强化较有特征性,可与GSTs鉴别。(2)胃淋巴瘤:CT显示胃壁均匀弥漫性增厚,有沿胃壁蔓延生长特性,呈均匀中等程度强化,胃粘膜保持完整,坏死少见,常见胃周淋巴结肿大,而GSTs多呈垂直胃壁生长趋势,且有局部胃粘膜明显强化的粘膜线征。(3)平滑肌源性和神经源性肿瘤: 两者均起源于具有多分化潜能的间质干细胞,因此CT表现与GSTs极为相似,鉴别困难,确诊依靠病理学结合免疫组化检查[13,14],在其他免疫组化指标不支持GSTs诊断时,S-100阳性有助于诊断神经鞘瘤,SM A阳性有助于诊断平滑肌瘤,笔者收集了34例CT诊断为GSTs的患者,追踪病理结果显示有2例为神经鞘瘤、1例为平滑肌瘤,回顾分析CT图像,依然不能做出正确诊断。
3.2.5 GSTs良恶性的判定
有关GSTs良恶性的判定,研究及文献报道众多,判断良恶性的指标及标准常见有:恶性指标:①远处转移;②侵犯邻近器官;③核分裂>10个/50HPF;④肿瘤浸润肌层。潜在恶性指标:①GSTs>55mm;②肿瘤中心坏死明显;③核异型性明显;④瘤细胞密度大,生长活跃。但始终没有任何一个标准能够完全准确地区分良恶性,原因在于GSTs本身就是多潜能未定向发展的肿瘤,从良性至明显恶性均可出现,且为动态发展过程,文献[15]报道显示良性间质瘤术后随访有发现转移征象,近年更多学者认为GIST基本都具有潜在的恶性,只是程度不同而已,应用低危状态来代替良性更确切。以往多认为间质瘤良性居多,但研究显示恶性多于良性,本组结果显示恶性GSTs22例(22/27),达81.48%,因此笔者认为GSTs应以恶性肿瘤来对待,即使病理结果为良性,亦应定期随访复查。
总之,GSTs的CT表现具有一定的特征性,比如垂直于胃壁生长、表面溃疡、坏死后并与胃腔相通等特征,结合M DCT的多平面重建,可以做出较为明确的定位、定性诊断及良恶性判定,但CT对GSTs的一些不典型病例,诊断准确性有待进一步提高。
Reference
1.Miettinen M, Lasota J. Gastrointestinal stromal tumordefinition, clinical, histological,immunohistochem ical, and molecular genetic features and differential diagnosis. Virchow s Arch, 2001, 438(1): 1-12.
2.Fletcher C, Berman JJ, Corless C, et al.Diagnosis of gastrointestinal stromal tumors:a consensus approach. Hum Pathol, 2002,33(5): 459-465.
3.Miettinen M, Elrifai W, Solin LH, et al.Evaluation of malignancy and prognosis of gastro- intestinal stromal tumors: a review.Hum Pathol,2002, 33(5): 478-483.
4.Lew in KJ, Riddell RH, Weinstein Y, et al,eds. Gastrointestinal pathology and its clinical implications. New Youk: Lgakushoin, 1992:284-341.
5.黄海花, 吴秀浅, 郑志超, 等. 胃肠道及胃肠道外间质瘤的临床病理及免疫组化分析.临床肿瘤学杂志, 2006, 11(2): 95-99.
Hai-hua HUANG, X iu-qian WU, Zhichao ZHENG, et a l. To ana lysis the clinicopathologic and immunohistochem ical features of gastrointestinal stromal tumor and external gastrointestinal stromal tumor. Chinese Clinical Oncology, 2006, 11(2): 95-99.
6.Mazur MT, Clark HB. Gastric strom al tumors:reappraisal of histogenesis. Am J Surg Pathol, 1983, 7(6): 507-519.
7.Heinrich MC, Corless CL. Gastric GI stromal tumors(GISTs): the role of surgery in the era of targeted therapy. J Surg Oncol, 2005,90(3): 195-207.
8.孙勇, 高剑波, 温平贵, 等. 螺旋CT分析胃间质瘤的生长方式与病理及预后的关系.实用放射学杂志, 2008, 24(11): 1496-1498.
Yong SUN, Jian-bo GAO,Ping-gui WEN,et al. Spiral CT analysis for correlation of grow th pattern with pathology and prognosis in gastric stromal tumors. J Pract Radiol, 2008,24(11): 1496-1498.
9.黄传涌, 康德勇. 胃肠道间质瘤的临床病理及免疫组织化学研究. 中华腹部疾病杂志,2005, 5(6): 395-397.
Chuan-yong HUANG, De-yong KANG.Clinicopathologic and immunohistochemical features of 36 cases of gastrointestinal stromal tumors. Chinese Journal of Celiopathy. 2005,5(6): 395-397.
10.高峰, 吴云林.胃肠道间质瘤的研究进展.上海第二医科大学学报, 2005, 9(25): 889-893.
Feng GAO, Yun-lin W U. Research advancement of gastrointestinal stromal tumor.Academic Journal of Shanghai Second Medical University. 2005, 9(25): 889-893.
11.Kima HC, Leea JM, Kima SH, et al. Small gastrointestinal stromal tumours with focal areas of low attenuation on CT: pathological correlation. Clin Radio, 2005, 60(3): 384-388.
12.郑育聪, 李健丁, 张瑞平. 胃肠道间质瘤的影像学研究进展.世界华人消化杂志, 2010,18(1): 49-53.
Yu-cong Zheng, Jian-ding Li, Rui-ping Zhang.Advances in imaging diagnosis of gastrointes- tinal stromal tumors. World Chinese Journal of Digestology, 2010, 18(1):49-53.
13.Hargunani R, Maclachlan J, Kaniyur S, et al.Cross-sectional imaging of gastric neoplasia.Clin Radiol, 2009, 64(4): 420-429.
14.U lusan S, Ko c Z, Kay ase lc uk F.Gastrointestinal stromal tumours:CT findings.Br J Radiol, 2008, 81(968): 618-623.
15.高剑波, 杨学华, 孙勇, 等. 胃间质瘤CT征象与病理及预后的关系. 中国医学影像技术,2007, 23(10): 1523-1526.
Jian-bo GAO,Xue-hua YANG, Yong SUN, et al. Correlation of CT findings with pathology and prognosis of gastric stromal tumors. Chin J Med Imaging Technol, 2007,23(10): 1523-1526.

