锂离子电池正极材料的表面包覆研究现状
郭 瑞,史鹏飞,程新群,马玉林
(哈尔滨工业大学化工学院,黑龙江哈尔滨 150001)
锂离子电池中,由于正极材料所处的电势较高,且脱锂态正极材料具有较强的氧化性,易与有机电解液发生副反应,以至于恶化电池的性能。对正极材料进行表面包覆改性是提高正极材料电化学性能的重要手段之一。本文就常用包覆材料的种类和包覆使正极材料性能改善的原因进行了简要的归纳与总结。
1 包覆方法
目前用于表面包覆的常用方法主要有:
1.1 气相沉积法
将含有所需沉积元素的气态或液态反应剂的蒸气及反应所需其它气体引入反应室,通过发生化学反应,在加热的固态基体表面沉积所需的固态膜材料。这种方法目前主要用于在正极材料表面沉积碳膜[1]。
1.2 有机物热解法
将有机物与合成好的正极材料或与合成正极材料所需的原料混合均匀后进行高温热处理,主要是利用有机物的碳化反应对正极材料进行碳包覆。常用来作为碳源的有机物有糖类(蔗糖、葡萄糖)、聚合物类(酚醛树脂、聚乙二醇、聚乙烯醇、聚乙烯醇缩丁醛、聚丙烯酸酯等)、沥青等。
1.3 沉淀法
向含有正极材料和改性离子的溶液中加入沉淀剂,使改性离子发生沉淀反应,以正极材料颗粒为核,在颗粒表面析出,之后进行热处理,从而得到包覆后的正极材料。这种方法可用来包覆氧化物[2]、磷酸盐[3]、氟化物[4]等材料。
1.4 溶胶凝胶法
将改性材料前驱物无机盐或金属醇盐溶于溶剂中形成溶液,利用溶质与溶剂的溶剂化、水解、或聚合反应形成溶胶。再将被包覆颗粒与溶胶均匀混合,使其均匀分散于溶胶中,然后将其经过陈化、干燥等处理转变为凝胶,最后高温煅烧凝胶得到外表面包覆有改性材料的粉体。溶胶凝胶法通常用来包覆一些氧化物[5]、复合氧化物[6]和氢氧化物[7]等。
1.5 化学镀
化学镀技术是通过溶液中适当的还原剂使金属离子在材料表面自催化作用下还原进行的金属沉积过程。该方法主要用于在正极材料表面沉积金属单质,如Ag[8]等。
2 常用的包覆物质
对于理想的包覆物质来说,首先应当具备一定的稳定性,即在电解液体系中不能溶解以及在较高的电位下不能够被破坏;同时还应具备良好的电子、锂离子导电性,以有利于电极内电子的传导和锂离子的扩散。通常报道的包覆物质主要有以下几种:
2.1 碳材料
碳是一种常见的包覆物质。通常导电性不好的正极材料常采用包覆碳的方法来改善电化学性能,如LiFePO4、Li3V2-(PO4)3、Li2MnSiO4等。还有部分研究者将碳包覆改性应用到了导电性相对较好的氧化物类正极材料(如LiCoO2、LiNi1/3-Mn1/3Co1/3O2等)上。由于此类正极材料高温下易被碳还原,因此一般选择易碳化物质作为碳源,并在空气中碳化得到碳包覆的正极材料。Cao等[9]利用蔗糖作为碳源,于空气中600℃碳化0.5 h对LiCoO2材料包碳处理。包碳后LiCoO2结构没有被破坏,首次放电比容量由110mAh/g提高到130 mAh/g。Kim等[10]用食糖作为碳源,以更低的温度(350℃)热解1 h,得到包覆碳的LiNi1/3Mn1/3Co1/3O2。碳质量分数为1%的样品5 C放电容量为0.1 C放电容量的87.4%,高于未包碳材料的84.9%。DSC测试表明碳包覆还可以提高材料的热稳定性能。
2.2 金属单质
常用作正极材料表面改性的金属单质主要是金属银。Sun等[8]对LiMn2O4材料包覆质量分数为3.2%的Ag,在2 C充放电制度下,Ag包覆的样品具有更高的放电容量和循环效率。
2.3 氧化物
氧化物作为包覆材料在锂离子电池正极材料的表面包覆改性中应用十分广泛。可用来包覆的氧化物有Al2O3、MgO、TiO2、ZnO、ZrO2、SiO2、CeO2、La2O3、RuO2等。其中,以 A l2O3、MgO、TiO2包覆最为常见。Xiang等[11]用A l(NO3)3作为反应物在LiNi0.8Co0.2O2表面包覆4~6 nm厚的Al2O3层。包覆前,LiNi0.8Co0.2O2循环80次容量损失35%,60℃循环55次比容量仅有83mAh/g;包覆后,循环100次容量只损失11%,60℃循环55次比容量还有142mAh/g。DSC测试表明,包覆后的充电态(4.35 V)材料的放热量降低,热稳定性得到改善。Hu等[12]在微孔LiFePO4/C复合材料中填充了RuO2。由于RuO2具有很好的电子导电性和Li+通过性,可以使微孔“金属化”,并还能起到“修复”不完整碳包覆层的作用,完善碳的导电网络。在30C放电电流下,包覆RuO2的LiFePO4/C仍有约50 mAh/g的可逆比容量,而不含RuO2的LiFePO4/C几乎没有容量。
2.4 复合氧化物
其中一类用作包覆物的复合氧化物是一些含锂的复合氧化 物 ,如 Li2O-2B2O3[13]、La2O3/Li2O/TiO2[14]、Li2ZrO3[15]、LiAlO2[6]等。这类材料多是锂离子导体材料,与单纯氧化物材料比具有较好的Li+通过性能,不但可以改善正极材料的循环性能和倍率性能,而且对Li+的嵌入和脱出影响较小[6]。
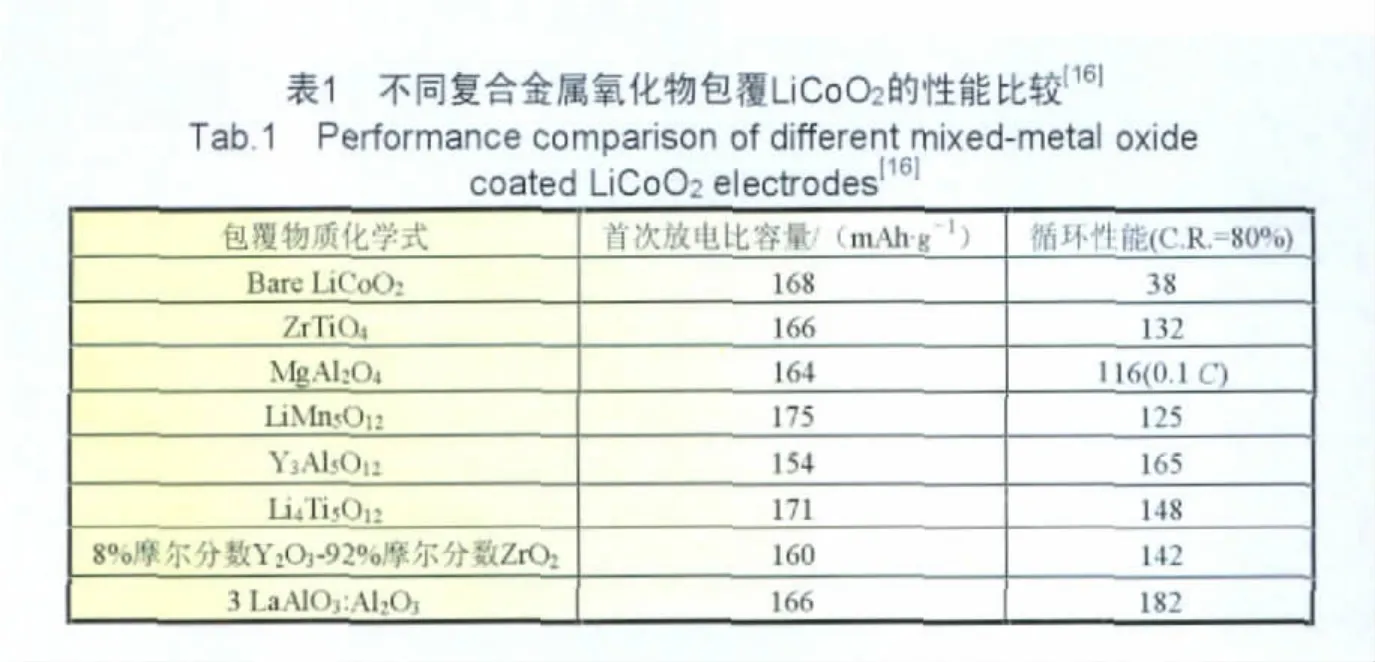
Fey课题组对LiCoO2材料进行了一系列复合氧化物的包覆改性研究,结果列于表1中。电池的充放电电压范围为4.4~2.75 V,电流为0.2 C。表中的循环性能指容量保持率(C.R.)下降到80%时的循环次数。从表1中可以看出包覆含锂复合氧化物LiMn5O12、Li4Ti5O12使LiCoO2的首次放电容量有所提升。但包覆Y3A l5O12和3LaAlO3:Al2O3的循环性能较好,这是由于这类陶瓷类材料由于具有较高的热力学稳定性,较强的耐氧化、耐还原性质,是一种合适的包覆物质[16]。
2.5 氟化物
Sun课题组通过对氧化物包覆材料的研究,发现包覆到正极材料表面的氧化物可以捕获电解液中的痕量HF,进一步反应生成相应的氟化物[17],长期循环可能会导致氧化物包覆层破坏。由于A lF3在HF中稳定,可以抵挡HF对正极材料的侵蚀,因此该课题组对各种正极材料进行了表面包覆A lF3研究,并得到了相似的结果:A lF3包覆能减少金属离子的溶解,提高正极材料的长期循环性能(500~1 000次)以及热稳定性[4]。
2.6 氢氧化物
同样是Sun课题组分别对Li[Li0.2Ni0.2Mn0.6]O2[7]和LiNi1/3-Mn1/3Co1/3O2[18]材料进行了Al(OH)3表面包覆研究。充放电测试结果表明质量分数为1.4%A l(OH)3包覆的Li[Li0.2Ni0.2Mn0.6]O2在1、2、5 C倍率下的容量保持率分别为 85%、73%、60%,高于未包覆的 80%、60%、45%;A l(OH)3包覆的 LiNi1/3Mn1/3-Co1/3O2材料在55℃高温循环45次后容量保持率为96%,略高于未包覆材料的92%。
2.7 磷酸盐
由于A lPO4中PO43-与Al离子之间的化学键具有很强的共价性,会阻碍正极材料与电解液之间的反应,对包覆后材料的热稳定性有利。Cho等[19]对比了Al2O3和A lPO4包覆对Li-CoO2的性能影响,发现充电截止电压为4.6 V时二者对Li-CoO2的循环性能影响不大。但当充电截止电压提升到4.8 V时,AlPO4包覆要比A l2O3包覆时容量衰减更慢、热稳定性更好,说明磷酸盐包覆要比氧化物包覆的耐过充性能好。
Hu等[3]研究发现Co3(PO4)2包覆的LiNi0.8Co0.2O2首次放电容量、60次循环的容量保持率和热稳定性均好于AlPO4包覆的LiNi0.8Co0.2O2。原因在于部分包覆的Co3(PO4)2可以与杂质LiOH和Li2CO3反应在LiNi0.8Co0.2O2表面生成LixCoPO4相,不仅能减少电极/电解液的接触面积,还能净化LiNi0.8Co0.2O2的表面,减少金属离子的溶解。而AlPO4只能起到减少接触面积的作用。
2.8 硅酸盐
由于SiO44-聚阴离子具有很强的Si-O键,可以阻挡一定的化学侵蚀。包覆MnSiO4后的LiCoO2材料在循环20次后比容量有183.0mAh/g,远好于未包覆的LiCoO2(114.4mAh/g)[20]。
2.9 聚合物
用导电高分子聚吡咯(PPy)等对现有正极材料进行改性,由于PPy导电良好,可以替代碳作为导电剂,可以提高正极材料的导电性,改善循环性能;另一方面其具有电化学活性,因此PPy修饰的正极材料较原材料具有较高的容量[21]。
3 表面包覆使正极材料性能改善的机理
表面包覆可以明显地改善正极材料的电化学性能,但是其作用机理目前还不是很明确,尚存在一定的争议。
3.1 包覆的作用
由于电解液中不可避免地含有痕量水,LiPF6会发生水解反应,生成 HF[13]:
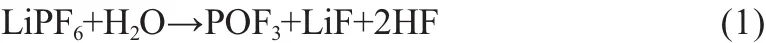
HF可以侵蚀正极材料,造成容量衰减。表面包覆能减少正极材料与电解液的直接接触面积[13]、减少电解液中游离HF的含量[17]以减轻材料中金属离子的溶解,即可减轻对正极材料本体的破坏。
包覆材料经过热处理或充放电循环后能扩散到正极材料内部形成表面固溶体,这可从包覆后材料的晶格参数变化体现出来[22]。通过化学分析光电子能谱(ESCA)的离子溅射方法对包覆后的材料进行了表面下不同深度的元素含量测试,也证实包覆材料的表面存在固熔体层[16]。表面固溶体层同样可以有效地维持材料的结构[16]。
表面包覆能稳定充放电过程中的晶体结构,抑制正极材料在锂离子嵌入脱出过程中的相变化。Cho等[22]研究了ZrO2包覆的LiNiO2在嵌脱锂过程中LiNiO2的结构变化。结果发现包覆ZrO2后,在锂离子的脱嵌过程中,LiNiO2的晶格参数变化幅度减小,ZrO2包覆层能抑制LiNiO2晶格潜在的畸变发生。ZrO2包覆还能抑制LiNiO2的H1↔M、M↔H2和H2↔H3相变(M和H分别代表单斜相和六方相,其中M↔H2和H2↔H3相变对循环容量衰减影响较大),因此ZrO2包覆改善了LiNiO2的循环性能。
电化学阻抗谱可以用来确定Li+嵌入/脱出过程中的动力学。电荷传递阻抗Rct与交换电流密度i0有以下关系式[23]:

式中:R为气体常数;T为绝对温度;F为法拉第常数;n为反应中转移的电子数。Rct越小,交换电流密度越大,电化学反应越容易进行。表面包覆能减小正极材料的电荷传递阻抗并抑制了锂离子反复脱出、嵌入过程中电荷传递阻抗的增大[15],对电化学反应是有利的。
3.2 碳或金属单质包覆的其它作用
碳包覆同样可以作为正极材料的保护层,抑制金属离子的溶解;减小电荷传递阻抗[24]。此外,碳或金属单质包覆还有其特殊的作用。一般认为,包覆的碳或金属可以提高材料的表面电子导电率,改善材料颗粒之间的电接触,进而改善材料的电化学性能[25]。
碳的引入还可以减小合成出的正极材料的粒径[26],可以缩短Li+在颗粒内部的扩散路径。Gaberscek等[27]发现不论包/掺碳与否,LiFePO4的放电容量几乎随材料平均粒径的增大而线性下降,包覆碳缩小材料粒径要比改善电子导电率对材料电化学性能的影响要更为显著。
3.3 表面包覆改性的新观点
Wang等研究了A l2O3包覆的LiCoO2在电解液中浸渍后表面生成的SEI膜,发现表面包覆并不能阻止LiCoO2与电解液之间的生成SEI膜副反应[28]。作者还发现包覆YPO4、将YPO4与LiCoO2混合、甚至将YPO4作为电解液添加剂使用都能使LiCoO2的性能得到一定程度的改善[29]。包覆对电化学性能改善的本质不在于包覆层与材料接触是否紧密,而是在于添加剂/包覆物质能与电解液反应生成Lew is酸,这种Lew is酸会通过(1)增加LiPF6电解液酸度并净化商品LiCoO2的表面;(2)促进电解液的分解并生成导电性更好的SEI膜;(3)能够稳定结构的表面固溶体的形成来改善LiCoO2的电化学性能。
4 结语与展望
正极材料的表面包覆是改善其电化学性能和热稳定性的有效手段之一。表面包覆物质的选择和包覆量控制都是实际应用过程中需要注意的问题。新型包覆材料如磷酸盐、硅酸盐类包覆能提供出色的热稳定性能,含锂复合材料的包覆则对容量影响较小。寻找易操作、低成本、性能出色的包覆材料仍是目前的研究重点。对于包覆改性的机理,还需从正极材料的结构、电极/电解液界面变化等多方面进行深入的研究来得到进一步证实。
[1]ENDOA E,YASUDA T,YAMAURA K,et al.LiNiO2electrode modified by plasma chem ical vapor deposition for higher voltage performance[J].JPower Sources,2001,93:87-92.
[2]LIU L,WANG Z X,LIH,et al.A l2O3-coated LiCoO2as cathode material for lithium ion batteries[J].Solid State Ionics,2002,152-153:341-346.
[3]HU G R,DENG X R,PENG Z D,et al.Comparison of AlPO4-and Co3(PO4)2-coated LiNi0.8Co0.2O2cathodematerials for Li-ion battery[J].Electrochim Acta,2008,53:2567-2573.
[4]SUN Y K,HAN JM,MYUNG S T,et al.Significant improvement of high voltage cycling behavior AlF3-coated LiCoO2cathode[J].Electrochem Commun,2006,8:821-826.
[5]LIU D,LIU X,HE Z.Surfacemodification by ZnO coating for improving the elevated temperature performance of LiMn2O4[J].J Alloys Compd,2007,436:387-391.
[6]CAO H,XIA B J,ZHANG Y,et al.LiA lO2-coated LiCoO2as cathodematerial for lithium ion batteries[J].Solid State Ionics,2005,176:911-914.
[7]KANG Y J,KIMJH,LEE SW,etal.The effectof Al(OH)3coating on the Li[Li0.2Ni0.2Mn0.6]O2cathode material for lithium secondary battery[J].Electrochim Acta,2005,50:4784-4791.
[8]SON JT,PARK K S,KIMH G,etal.Surface-modification of LiMn2-O4with a silver-metal coating[J].JPower Sources,2004,126:182-185.
[9]CAO Q,ZHANG H P,WANG G J,etal.A novel carbon-coated Li-CoO2as cathode material for lithium ion battery[J].Electrochem Commun,2007,9:1228-1232.
[10]KIMH S,KONG MZ,KIMK,et al.Effect of carbon coating on LiNi1/3Mn1/3Co1/3O2cathodematerial for lithium secondary batteries[J].JPower Sources,2007,171:917-921.
[11]XIANG JF,CHANG C X,YUAN L J,et al.A simple and effective strategy to synthesize Al2O3-coated LiNi0.8Co0.2O2cathodematerials for lithium ion battery[J].Electrochem Commun,2008,10:1360-1363.
[12]HU Y S,GUO Y G,DOMINKO R,et al.Improved electrode performance of porous LiFePO4using RuO2as an oxidic nanoscale interconnect[J].Adv Mater,2007,19(15):1963-1966.
[13]S,AHAN H,GÖKTEPE H,PATAT S,et al.The effect of LBO coating method on electrochemical performance of LiMn2O4cathodematerial[J].Solid State Ionics,2008,178:1837-1842.
[14]WANG H,ZHU L Y,CHEN MC.Effects of La2O3/Li2O/TiO2-coating on electrochem ical performance of LiCoO2cathode[J].J Rare Metals,2007,25:124-128.
[15]NIJF,ZHOU H H,CHEN JT,et al.Improved electrochem ical performance of layered LiNi0.4Co0.2Mn0.4O2via Li2ZrO3coating[J].Electrochim Acta,2008,53:3075-3083.
[16]LU C Z,CHEN JM,CHO Y D,etal.Electrochem ical performance of LiCoO2cathodes by surfacemodification using lanthanum aluminum garnet[J].JPower Sources,2008,184:392-401.
[17]MYUNG S T,IZUMIK,KOMABA S,et al.Role of alum ina coating on Li-Ni-Co-Mn-O particles as positive electrodematerial for lithium-ion batteries[J].Chem Mater,2005,17(14):3695-3704.
[18]JANG SB,KANG H S,AMINE K,etal.Synthesis and improved electrochemical performance of Al(OH)3-coated Li[Ni1/3Mn1/3Co1/3]-O2cathodematerials atelevated temperature[J].Electrochim Acta,2005,50(20):4168-4173.
[19]CHO J,KIMT G,KIMC,et al.Comparison of Al2O3-and AlPO4-coated LiCoO2cathode materials for a Li-ion cell[J].J Power Sources,2005,146:58-64.
[20]YANG Z X,YANG W S,EVANS D G,et al.Enhanced overcharge behavior and thermal stability of commercial LiCoO2by coating with a novel material[J].Electrochem Commun,2008,10:1136-1139.
[21]PASQUIER A D,ORSINIF,GOZDZ A S,et al.Electrochem ical behaviour of LiMn2O4-PPy composite cathodes in the 4-V region[J].JPower Sources,1999,81-82:607-611.
[22]CHO J,KIMT J,KIMY J,et al.High-performance ZrO2-coated LiNiO2cathodematerial[J].Electrochem Solid-State Lett,2001,4(10):A 159-A 161.
[23]BARD A J,FAULKNER L R.Electrochem icalMethods[M].New York:W iley,1980:213.
[24]SHIN H C,CHOW I,JANG H.Electrochemical properties of the carbon-coated LiFePO4as a cathode material for lithium-ion secondary batteries[J].JPower Sources,2006,159:1383-1388.
[25]SHIN H C,CHOW I,JANG H.Electrochem ical properties of carbon-coated LiFePO4cathode using graphite,carbon black,and acetylene black[J].Electrochim Acta,2006,52:1472-1476.
[26]YUN N J,HA H W,JEONG K H,et al.Synthesis and electrochem ical properties of olivine-type LiFePO4/C composite cathode material prepared from a poly(vinyl alcohol)-containing precursor[J].JPower Sources,2006,160:1361-1368.
[27]GABERSCEK M,DOMINKO R,JAMNIK J.Is small particle size more important than carbon coating An example study on LiFePO4cathodes[J].Electrochem Commun,2007,9:2778-2783.
[28]WANG Z X,HUANG X J,CHEN L Q.Characterization of spontaneous reactions of LiCoO2with electrolyte solvent for lithium-ion batteries[J].JElectrochem Soc,2004,151(10):A 1641-A 1652.
[29]BAIY,YIN Y F,LIU N,et al.New concept of surfacemodification to LiCoO2[J].JPower Sources,2007,174(1):328-334.

