PRRSV的分离鉴定及与其他5种猪病毒混合感染情况调查
李吉达,尹燕博*,徐守振,王建琳,王 光,刘兴彩,韩丽敏,郭妍妍
(1.青岛农业大学动物科技学院,山东青岛 266109;2.青岛澳兰百特生物工程有限公司,山东青岛 266101)
PRRSV的分离鉴定及与其他5种猪病毒混合感染情况调查
李吉达1,尹燕博1*,徐守振1,王建琳1,王 光1,刘兴彩1,韩丽敏2,郭妍妍2
(1.青岛农业大学动物科技学院,山东青岛 266109;2.青岛澳兰百特生物工程有限公司,山东青岛 266101)
应用PCR检测方法,对来自山东、河北、河南等10省44份表现高热病症状的临床发病猪病料,进行猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒(PCV)、猪伪狂犬病病毒(PRV)、猪巨细胞病病毒(PCMV)和猪流感病毒(SIV)6种病原的检测。结果发现,6种病原中PRRSV的检出率最高为72.7%;单纯PRRSV感染的比例仅为2.27%。根据PCR检测结果分析PRRSV与其他5种病毒的混合感染情况,结果发现两重感染中PRRSV/PRV并发率最高(62.50%),三重感染中PRRSV/PRV/PCV并发率最高(43.75%),四重感染中PRRSV/PRV/PCV/PCMV并发率最高(28.125%),五重感染中PRRSV/PCV/PCMV/CSFV/PRV并发率最高(15.625%),PRRSV/PCV/PCMV/CSFV/PRV/SIV六重感染的比例为9.375%。将PRRSV阳性病料接种猪肺巨噬细胞和Marc-145细胞,共分离到9株PRRSV,分离率为28.1%。结果表明,发病猪多为感染PRRSV的同时混合感染其他多种病毒,为制定合理的免疫程序预防猪场各种疾病提供科学依据。
猪繁殖与呼吸综合征病毒;分离鉴定;混合感染
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)也称猪蓝耳病,最初于1987年首次报道于美国[1-2],其后在加拿大、德、法、荷兰、英、西班牙、比利时、澳大利亚、日本、菲律宾等国家发生[3],并有全球蔓延趋势。1992世界动物卫生组织(OIE)在国际专家研讨会上采用猪繁殖与呼吸综合征(PRRS)这一名称。1996年郭宝清等首次在暴发流产的胎儿中分离到猪繁殖与呼吸综合征病毒(PRRSV),证实了我国也有 PRRS的流行[4]。
2006年6月份开始,我国南方部分省市发生了以高热不退、皮肤发红、呼吸困难为主要临床症状的猪高热病疫情。中国动物疫病预防控制中心的田克恭博士最终确定本次高热病是由猪繁殖与呼吸综合征病毒变异株(NVDC~JXA1株)造成的,并定名为高致病性猪蓝耳病,这次疫情的暴发给国内养猪业造成了巨大的经济损失[5-6]。2008年1月至2009年3月在对表现高热病症状的临床发病猪进行剖检时发现,许多病猪在表现间质性肺炎、肺淤血实变等高热病病变的同时,也表现大肠的扣状溃疡等猪瘟和其他病毒感染的病变,根据临床症状初步诊断为PRRSV与其他多种病毒混合感染。本试验对来自山东 、河北 、河南 、浙江 、湖南 、江 苏 、上海 、江西 、福建、广西10省市44份发病猪病料进行猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒(Porcine circo virus,PCV)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪巨细胞病病毒(Porcine cytomegalo virus,PCMV)、猪流感病毒(Swine influenza virus,SIV)6种病毒的检测,拟对PRRS与以上其他5种病毒的混合感染情况进行研究,为猪病的综合防控提供参考资料。
1 材料与方法
1.1 材料
1.1.1 病料 2008年1月到2009年3月,来自山东 、河北 、河南 、浙江 、湖南 、江苏 、上海 、江西 、福建 、广西10省临床发病猪病料。
1.1.2 细胞与毒株 原代猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)由本实验室制备;Marc-145细胞由本实验室冻存;PRRSV毒株JXA1株,购自中国动物疫病预防控制中心。
1.2 方法
1.2.1 引物设计 应用Primer 5.0设计PCR引物,参照序列VR-2332设计针对PRRSV N蛋白基因 检 测 引 物 PRRSV1:5′-GCCCCTGCCCACCACgG-3′PRRSV2:5′-TCGCCCTAAT TGAATAGGT-3′;参照序列 J04358.2设计针对 CSFV 多聚蛋白基因检测引物CSFV1:5′-GCTCCTGGTTGGTAACCTCGG-3′CSFV2:5′-TGATGCTGTCACACAGGTGAA-3′;参照序列 DQ017036 设计针对PCV-2型 Rep蛋白基因检测引物 PCV1:5′-TTATTGTTGGCGAGGAGGGTA-3PCV2:5′-CCATCCCACCACTTGTT TCTA-3;参照序列AF207700设计针对PRV gE基因检测引物PRV1:5′-TACGTCACGGTCATCAAGG-3 PRV2:5′-CATATGTGGGTCCAT TCGTC-3′;参 照 序 列AF394056设计针对PCMV gB基因检测引物PCMV1:5′-ATGACAGTGAGCAGTCGGAA-3 PCMV2:5′-TCACACGTCCTCGGTGGATAG-3′;参照序列CY022955设计针对SIV M蛋白基因检测引 物 SIV1:5′-CAAGACCAATCCTGTCAATC-3′SIV2:5′-GCCTCTGCCTGTTCACT-3′。
1.2.2 PRRS与其他5种病毒病混合感染情况调查
1.2.2.1 组织样品的处理 称取病料组织10 g于组织匀浆机中,加入生理盐水100 mL研磨,待匀浆后转移至盐水瓶内反复冻融3次,置-20℃冻存。
1.2.2.2 组织样品的RT-PCR检测 取冻融好的组织匀浆液,用酸性酚-硫氰酸胍-氯仿法提取病毒RNA,通过一步法RT-PCR试剂盒对猪病料进行各种病毒的检测。
1.2.2.3 检测结果的统计分析 根据PCR检测结果,比较6种病毒的检出率;PCR检测PRRSV阳性病料中,分别统计PRRS与其他5种病毒病二重感染、三重感染、四重感染、五重感染以及六重感染的比例。
1.2.3 病毒分离鉴定
1.2.3.1 PAM细胞的制备 将50日龄的无特定病原(specific pathogen free,SPF)仔猪放血,结扎气管后无菌摘取肺脏,先用9 g/L的生理盐水洗涤外表面,将pH7.4的PBS 50 mL从气管灌入肺脏,轻轻拍打肺表面,5 min后回收灌洗液,如此反复进行,直至共回收约200 mL。将回收的支气管肺泡灌洗液用吸管轻轻吹打,将细胞团块打散,用单层无菌100目不锈钢筛过滤,收集全部灌洗液,1 500 r/min离心10 min,留沉淀;用无菌的PBS(pH 7.4)重悬细胞,1 500 r/min离心10 min,留沉淀;同上方法重复1次;含100 mL/L胎牛血清的1×RPMI1640营养液重悬细胞,置细胞瓶,在37℃、体积分数为5%的CO2培养箱中吸附2 h。弃上清,用含20 mL/L胎牛血清的1×RPMI1640营养液洗涤2次,除去非黏附细胞继续用含100 mL/L胎牛血清的1×RPMI1640培养液培养备用。
1.2.3.2 病毒的分离 取RT-PCR检测PRRSV阳性的肺组织匀浆,3 000 r/min离心15 min,取上清经0.22 μ m微孔滤膜进行过滤除菌。按10%的比例接种长成单层的PAM细胞和Marc-145细胞,37℃CO2培养箱内吸附1 h后倒掉毒液,加入含20 mL/L小牛血清的细胞维持液,37℃CO2培养箱内培养5 d后收细胞及细胞液,置-20℃冻存。将上一代的细胞及细胞液反复冻融2次以后接种下一代长成单层的PAM细胞和Marc-145细胞,如此盲传直至出现典型的细胞病变,收获细胞毒。
1.2.3.3 分离株的RT-PCR鉴定 收获的细胞毒反复冻融2次以后,用酸性酚-硫氰酸胍-氯仿法提取病毒 RNA,通过一步法 RT-PCR试剂盒进行PRRSV分离株鉴定。核酸提取时设正常的Marc-145细胞为阴性对照,JXAI株为阳性对照。
2 结果
2.1 PRRSV与其他5种病毒检测结果
自2008年1月-2009年3月对来自山东、河北 、河南、浙江 、湖南、江苏 、上海 、江西 、福建 、广西10省市的44份猪病料分别进行PRRSV、CSFV、PCV、PRV、PCMV和SIV的6种疾病检测,结果见表1。
2.2 PRRSV与其他5种病毒混合感染情况统计
2.2.1 各种病毒检出率对比观察 根据表1所列检测结果,统计所检测病料中各种病毒的检出率,对比观察各种病毒检出率的高低(图1)。阳性率分别为 PRRSV 72.7%、PCV 59.1%、SIV 54.5%、PRV 52.3%、CSFV 50.0%、PCMV 45.5%。统计显示,2008年以来猪病以PRRS的发病率最高。
2.2.2 PRRSV与另外一种病毒二重感染情况分析 根据表1所列检测结果,PRRS阳性结果中,统计其他一种病毒与PRRSV同时感染的概率(图2)。PRRSV/PRV的并发率为62.5%;PRRSV/PCV的并发率为59.4%;PRRSV/SIV的并发率为53.1%;PRRSV/CSFV的并发率为50.0%;PRRSV/PCMV的并发率为50.0%。PRRSV与一种病毒混合感染情况统计比较显示,PRRSV/PRV的并发率最高,这与临床中发病猪大都出现神经症状密切相关,而与其他病毒的并发率也都在50%以上,单纯的PRRS发病率仅有2.27%。
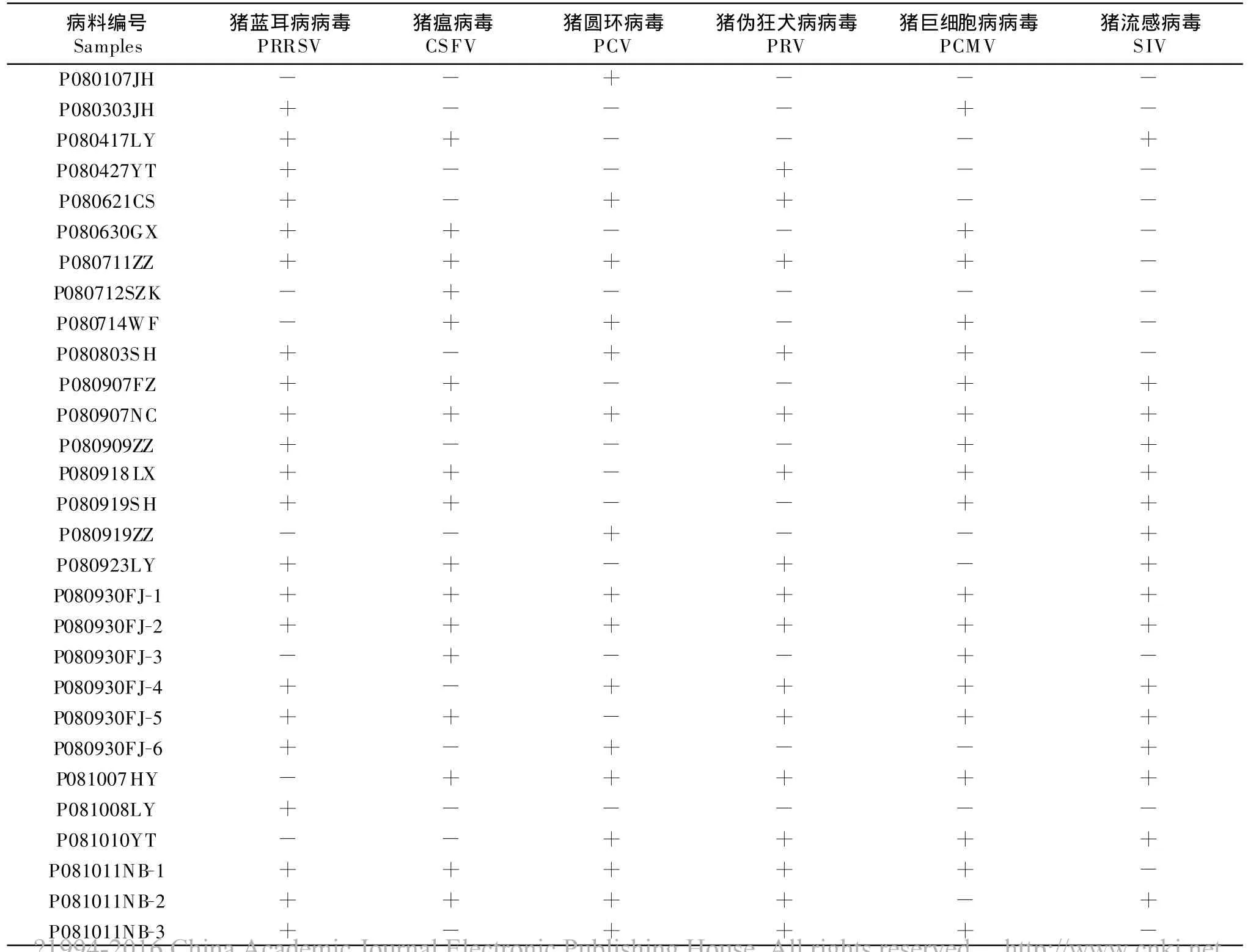
表1 RT-PCR检测结果Table 1 Result of RT-PCR dection

(续表)
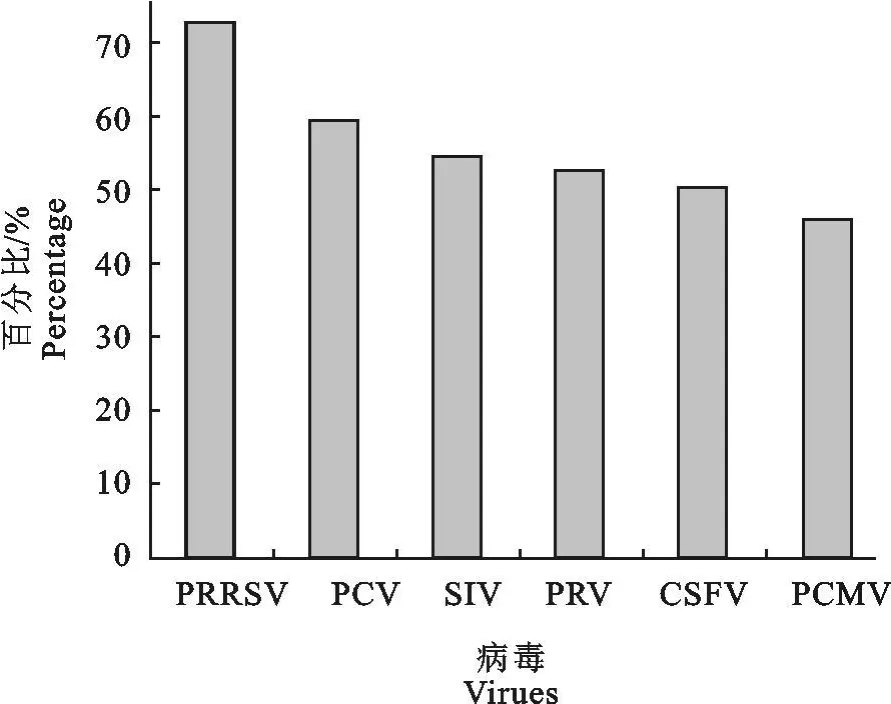
图1 不同病毒的检出率 Fig.1 Detection rates of different viruses
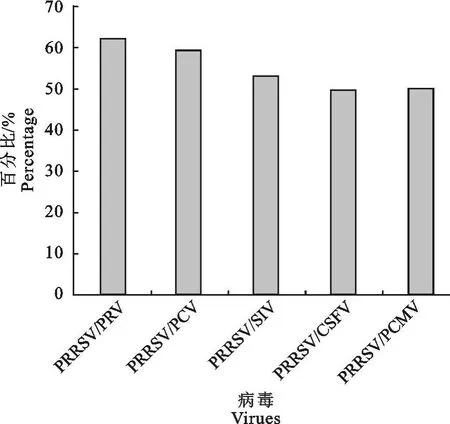
图2 PRRSV与另外一种病毒二重感染情况Fig.2 Dual infection of PRRSV and another virus
2.2.3 PRRSV与另外两种病毒三重感染情况分析
根据表1所列检测结果,PRRS阳性结果中,统计其他两种病毒与 PRRS同时感染的概率,对比观察PRRSV与其他两种病毒的混合感染情况(图3)。PRRSV/PRV/PCV的并发率为43.75%;PRRSV/CSFV/SIV的并发率为37.5%;PRRSV/PRV/PCMV的并发率为34.375%;PRRSV/CSFV/PRV的并发率为31.25%;PRRSV/CSFV/PCMV的并发率为31.25%;PRRSV/PRV/SIV的并发率为31.25%;PRRSV/PCMV/SIV的并发率为28.125%;PRRSV/PCMV/PCV的并发率为28.125%;PRRSV/PCV/SIV的并发率为28.125%;PRRSV/CSFV/PCV的并发率为25%。PRRSV与两种病毒混合感染情况统计显示:PRRSV/PRV/PCV的并发率最高。
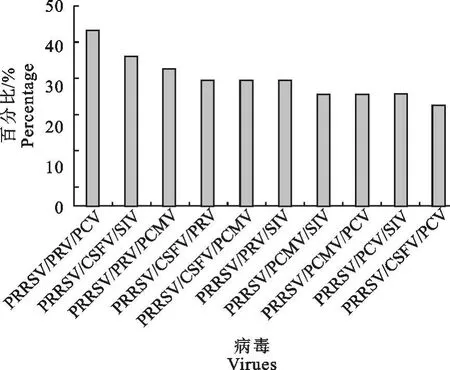
图3 PRRSV与另外两种病毒三重感染情况Fig.3 Triple infection of PRRSV and the other two viruses
2.2.4 PRRSV与另外3种病毒四重感染情况分析 根据表1所列检测结果,PRRS病毒阳性结果中,统计其他3种病毒与PRRSV同时感染的概率,对比观察PRRSV与其他 3种病毒的混合感染情况(图4)。PRRSV/PRV/PCV/PCMV的并发率为28.125%;PRRSV/PCV/SIV/PRV的并发率为21.875%;PRRSV/CSFV/PCV/PRV的并发率为18.75%;PRRSV/PCMV/SIV/PRV的并发率为18.75%;PRRSV/PCV/SIV/CSFV的并发率为15.625%;PRRSV/PCV/PCMV/CSVF的并发率为15.625%。PRRSV与3种病毒混合感染情况统计比较显示,PRRSV/PRV/PCV/PCMV的并发率最高。
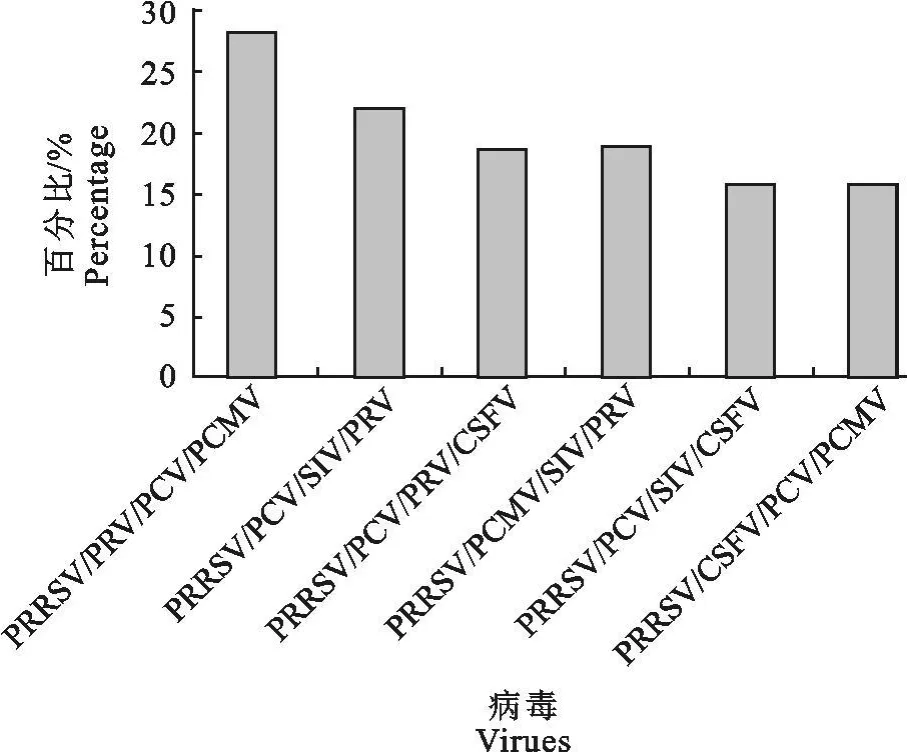
图4 PRRS与另外3种病毒四重感染情况Fig.4 Mixed infection of PRRSV and the other three viruses
2.2.5 PRRS与另外4种病毒五重感染情况分析 根据表1所列检测结果,PRRSV阳性结果中,统计其他4种病毒与PRRS同时感染的概率,对比观察PRRS与其他4种病毒的混合感染情况(图5)。PRRSV/PCV/PCMV/CSFV/PRV的并发率为15.625%;PRRSV/PCV/PCMV/SIV/PRV的并发率为12.5%;PRRS/PC/PCM/SI/CSF的并发率为9.375%;PRRSV/PCV/PCMV/PRV/CSFV的并发率为9.375%。PRRSV与4种病毒混合感染情况统计显示,PRRSV/PCV/PCMV/CSFV/PRV的并发率最高。
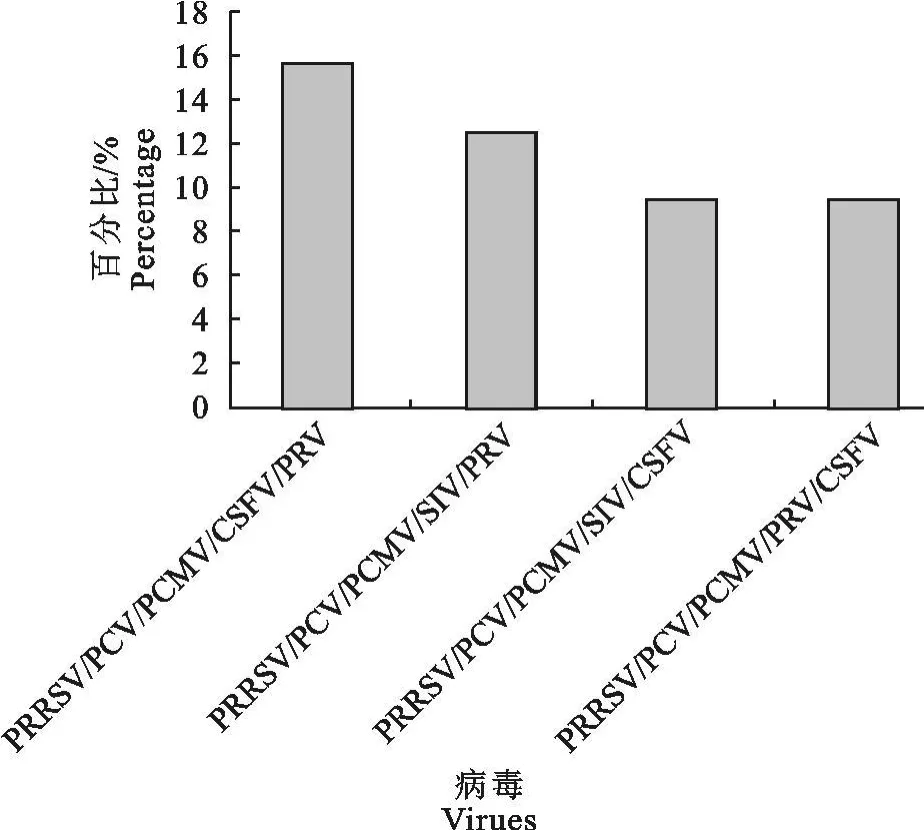
图5 PRRSV与另外4种病毒五重感染情况比较Fig.5 Mixed infection of PRRSV and the other four viruses
2.2.6 PRRSV与另外5种病毒的六重感染情况分析 结果显示PRRSV/PCV/PCMV/CSFV/PRV/SIV并发率为9.375%。
2.3 病毒分离鉴定结果
2.3.1 PRRSV在细胞上的增殖 长成单层的PAM细胞在接种PRRSV阳性病料72 h后,细胞出现聚堆、脱落等典型的病变;长成单层的Marc-145细胞接种PRRSV阳性病料后,盲传至第3代时开始出现聚堆、拉网、脱落等典型的细胞病变。
2.3.2 分离株RT-PCR鉴定结果 经RT-PCR鉴定,共分离出9株PRRSV,图6所示为分离株RTPCR鉴定后的电泳结果。根据猪病料的采集时间及来源对9株PRRSV分别进行命名(表2)。
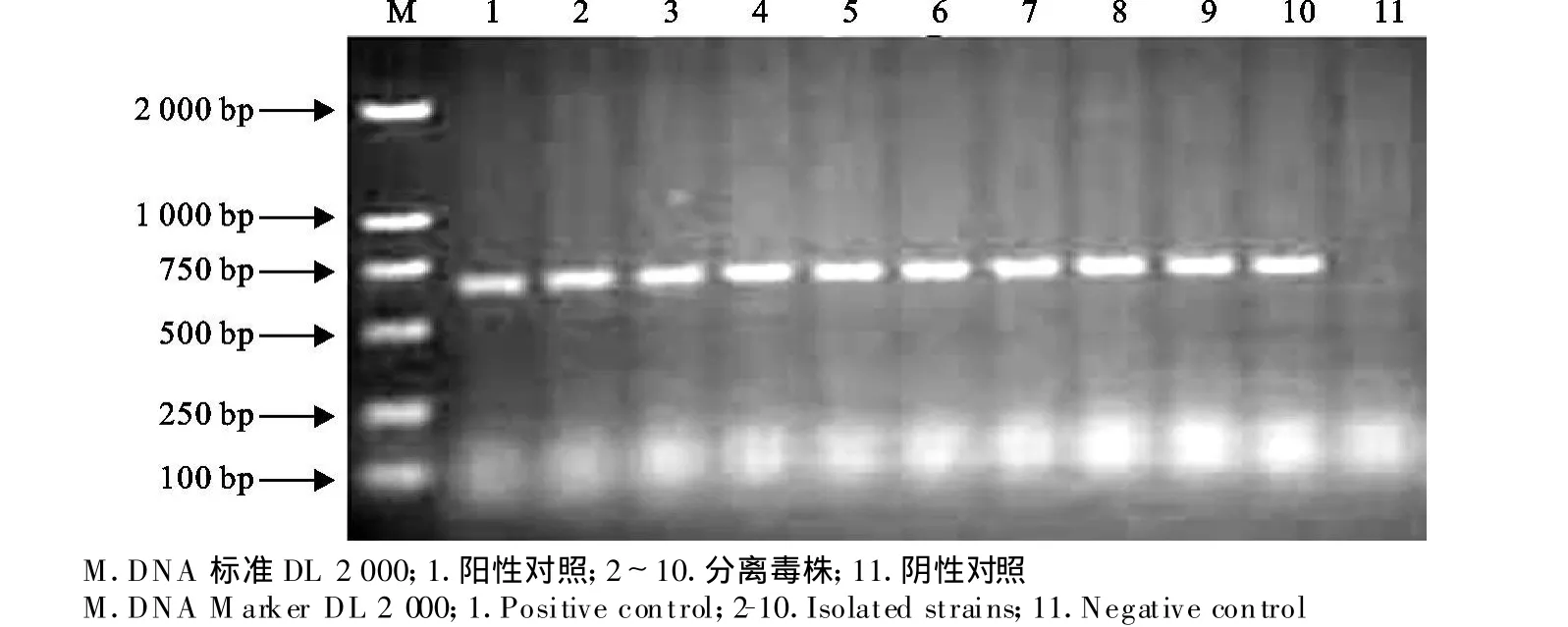
图6 RT-PCR分离株检测结果Fig.6 Detection result of isolated strains by RT-PCR

表2 分离的9株PRRSVTable 2 9 PRRSV isolated strains
3 讨论
自2006年7月以来,先后在我国河北、湖北、浙江、江西、安徽、山东等地出现了以育肥猪和架子猪体温升高(39.5℃~41.8℃),高热不退,卧地不食,体表皮肤发红,运动不协调等主要临床症状的一种急性传染病。由于该病病因复杂,且为多病原混合感染,故统称为“猪无名高热综合征”[7]。2007年Tian K等[5]的试验表明,2006年猪“高热病”是由PRRSV变异株(JXA1株)引起的,业内公认该毒株是高致病性猪蓝耳病病毒。本次研究对来自全国10省市的44份表现高热病症状的临床发病猪进行了6种病毒病的检测,统计检测结果,44份被检测病料中有32份PRRSV阳性,检出率高达72.7%,PRRSV无疑是造成高热病的主要病因。在后续的研究中(尚未发表),通过测序结果发现分离到的 PRRSV均为变异株,且与高致病性毒株JXA1株高度同源。在SPF动物房对PRRSV抗原抗体双阴性猪进行的免疫保护试验中,针对PRRSV变异株的疫苗对高致病性猪蓝耳病的发生起到了有效地预防作用。
然而,据养殖户及临床兽医反映,针对PRRSV变异株的疫苗在临床应用中效果并不是很好,仍有猪死于高热病。我们在对临床发病猪进行观察及剖检时发现,多数的临床发病猪有神经症状,剖检时病死猪大肠的扣状溃疡、肾脏的出血、脾脏边缘出血性梗死等猪瘟特征性病变和其他病毒病的病变非常普遍,根据临床病变我们初步诊断为PRRSV与其他多种病毒(尤其是猪瘟病毒)混合感染。PRRSV主要在单核巨噬细胞内复制,尤其是肺泡巨噬细胞,然后进一步扩散到全身多处组织的巨噬细胞和单核细胞,使猪的免疫力降低,从而产生免疫抑制,促使其他多种病毒感染的发生,从而引起混合感染,并最终导致猪的死亡[8]。显然,单纯接种PRRS疫苗对于潜在多种病原的猪场不会起到有效的防控作用。我们的研究结果证实,在所检测的 6种病毒中,PRRSV的发生率最高(72.7%)。PRRSV与一种疾病混合感染情况统计显示,在所检测的5种病毒中,PRV/PRRSV的并发率最高(62.5%),PRRS与其他4种病毒并发的比例均在50%以上。本次研究中,针对6种病毒的检测并没有进行野毒株和疫苗株的区分,因此检测结果中不排除有疫苗株。
PRRSV高达70%以上的检出率提示我们,PRRS是当前危害养猪场的主要疾病之一,PRRS的防控刻不容缓。本研究分别统计了PRRSV与其他2种~5种病毒并发感染的情况。结果表明,绝大多数情况下PRRSV与多种病毒混合感染引起猪发病,单纯的PRRSV发生几率很小,仅为2.27%,可见猪场疫病防控应以综合防控为主。针对PRRSV及其他多种病毒制定科学的免疫程序,以及必要的生物安全措施,是决定综合防控成败的关键所在。目前猪场疫病的防控难度越来越大,引进阴性种猪,对猪场进行各种疫病的净化刻不容缓。
用于PRRSV分离和体外培养的细胞主要有猪肺泡巨噬细胞[6]、非洲绿猴肾细胞传代细胞系Marc-145细胞[9],以及CL2621细胞等。本次研究中采用了猪肺泡巨噬细胞(PAM)和Marc-145细胞两种细胞进行病毒分离。有研究表明 PRRSV更易在PAM 细胞中生长[10-11],本研究发现,相比较而言,毒株在PAM细胞上有良好的适应性,病毒在Marc-145细胞上的适应时间更长。本次试验中共分离到9株PRRSV,分离率为28.1%。分离病毒时我们发现并非所有的阳性病料中都能够分离到病毒,这可能与病料中活毒的含量以及不同毒株在细胞上适应性不同有关。
[1]Keffaber K K.Reproductive failure of unknown etiology[J].Am A ssoc Swine Pract Newslett,1989(1):1-9.
[2]Biodeau R,Dea S,Sauvageau R A,et al.Porcine reproductive and respiratory syndrome in Quebec[J].Vet Rec,1991,129(5):102-103.
[3]蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001:213.
[4]杨汉春.我国猪繁殖与呼吸综合征的流行现状与控制对策[J].猪世界,2003(4):3-5.
[5]Tian K,Yu X L,Zhao T Z,et al.Emergence of fatal P RRSV variants:Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLOS ONE,2007,2(6):e526
[6]张青娴.高致病性蓝耳病的研究进展[J].中国畜牧兽医,2008,35(9):105-107.
[7]姚纪元.“猪无名高热综合症”的发生与防制[J].中国畜牧兽医,2007,34(5):120.
[8]Duan X,Nauwynck H J,Pensaert M B.Virus quantification and identification of cellular targets in the lungs and lymphoid tissues of pigs at different time intervals after inoculation with porcine reproductive and respiratory syndrome virus(P RRSV)[J].Vet Microbiol,1997,56:9-19.
[9]Kim S,Kwang J,Joo H S,et al.Enhanced replication of porcine reproductive and respirato ry syndrome(PRRS)virus in a homogenious subpopulation of MA-104 cell line[J].ArchVirol,1993,33:477-483.
[10]M olitor T W,Choi C S,Leitner G.M odulation of host immune response by SIRS virus[J].Am Assoc Swine Pract Newsletter,1992,4:27-28.
[11]Zhou Y,Barghusen S,Choi C.Effect of SIRS virus infection on leukocy te populations in the peripheral blood and on cytokine ex pression in alveolar macrophage of growing pigs[J].Am Assoc Swine Pract Newletter,1992,4:28.
Isolation and Identification of PRRSV and Investigation of Mixed Infection between PRRSV and Other Five Viruses
LI Ji-da1,YIN Yan-bo1,XU Shou-zhen1,WANG Jian-lin1,WANG Guang1,LIU Xing-cai1,HAN Li-min2,GUO Yan-yan2
(1.College of Animal Science and Veterinary Medicine,Qingdao Agricultural University,Qingdao,Shandong,266109,China;2.QingdaoOland-Better Bioengineering CO.L TD,Qingdao,Shandong,266101,China)
The PRRSV,CSFV,PCV,PRV,PCMV and SIV were detected by PCR from 44 clinical samples from ten provinces including Shandong,Hebei,and Henan etc,and the mixed infection information among PRRSV and CSFV,PCV,PRV,PCMV,SIV were analysed.The results showed that the incidence of PRRSV was highest in these six viruses and its detection rate was up to 72.7%,single infection rate of PRRSV was only 2.27%.The mixed infection information analysis among PRRSV and other viruses indicated that PRRSV/PRV was highest in the co-infection of PRRS with another viruses and its detection rate was up to 62.50%,PRRSV/PRV/PCV was highest in the co-infection of PRRS with other two viruses and its detection rate was up to 43.75%,PRRSV/PRV/PCV/PCMV was highest in the co-infection of PRRSV with other three viruses and its detection rate was up to 28.125%,PRRSV/PCV/PCMV/CSFV/PRV was highest in the co-infection of PRRSV with other four viruses and its detection rate was up to 15.625%,and PRRSV/PCV/PCMV/CSFV/PRV/SIV was up to 9.375%.Nine PRRSV strains were isolated by inoculating the PAM and MARC-145 cells from positive samples and isolating rate was upto 28.1%.The results demonstrated that the clinical cases were co-infected with PRRSV and other viruses mostly,which provided scientific basis for formulating the reasonable immune program to prevent all kinds of diseases in the swine farm.
PRRSV;isolation and identification;mixed infection
S852.659.6;S858.28
A
1007-5038(2010)03-0048-07
2009-10-13
李吉达(1984-),男,山东邹平人,硕士,主要从事分子流行病学研究。*通讯作者

