化瘀理肺方对大鼠肺纤维化形成的干预作用及对 Smad7表达的影响
李 飞 刘世青 黄晓日 李长生 时衍同 孙 清 刘 群 孙德刚 鹿 伟 李 霞
(日照市人民医院,山东 日照 276800)
肺纤维化是一种渐进性致死性疾病,发病机制尚不完全明确,目前对于肺纤维化的治疗主要是基于抑制炎症可阻止肺纤维化进展这一观念,一般采用激素治疗,但疗效甚微,仅对 20%的肺纤维化患者有效,而且常常为一过性反应〔1〕,应用免疫抑制剂或细胞毒类药物对某些肺纤维化病人作为第二线药物用于治疗,不仅存在潜在的严重副作用,而且对肺纤维化治疗基本无效。化瘀理肺方是以“化瘀理肺、畅利气机”为治则组成的中药方剂,本课题拟通过动物实验研究化瘀理肺方对大鼠肺纤维化模型的干预作用,并用组织芯片和免疫组化相结合的办法检测 Smad7蛋白表达,探讨其可能作用机制。
1 材料与方法
1.1 动物与分组 雄性 Wistar大鼠 44只,体重(180~220)g,清洁级,由山东大学试验动物中心提供,动物合格证号为 ssxk(鲁)20030004。动物随机分为 4组:模型组(博莱霉素 +生理盐水)、中药组(博莱霉素 +化瘀理肺方)、激素组(博莱霉素 +氢化可的松琥珀酸钠)、对照组(生理盐水 +生理盐水),中药组 14只,其余每组 10只。
1.2 药品与试剂 化瘀理肺方由丹参、半夏、当归、水蛭、黄芪、补骨脂、薏苡仁、鱼腥草、地龙等组成,所用中药为浓缩颗粒剂,由江阴天江药业有限公司生产,生产批号为 0509025,经溶解配成含生药 1 341 mg/ml的溶剂,高压灭菌,4℃冰箱保存备用;注射用盐酸博莱霉素(15 mg/支)由日本化药株式会社生产,产品批号为 950330,使用时以生理盐水配成 1 mg/ml;氢化可的松琥珀酸钠(50 mg/支)购自天津市生物化学制药厂,产品批号为 20060301;Smad7抗体(0.2 ml,200μg/ml)及链霉亲和素-过氧化物酶复合物(SABC)免疫组化试剂盒均购自武汉博士德生物工程有限公司。
1.3 模型的建立与标本处理 用 1%戊巴比妥钠(35 mg/kg)腹腔内注射麻醉,固定四肢及头部,在额镜直视下,将与 1ml注射器相连的带接头硬脊膜外麻醉导管插入气管,注入 0.4%博莱霉素 0.25 ml(5 mg/kg),对照组注入生理盐水 0.25 ml作为正常对照,注药后立即将动物直立旋转,使药物在肺内分布均匀。次日开始,中药组每天给予化瘀理肺方药物灌胃(13 410mg/kg),激素组每天给予氢化可的松琥珀酸钠腹腔注射(25mg/kg),对照组和模型组每天给予生理盐水(2 ml/只)灌胃。给药后第 14和 28天每组各处死 5只大鼠(中药组处死7只),取右肺中叶置于 10%中性甲醛固定,石蜡包埋、切片,HE染色。
1.4 组织芯片的制作 按刘卫平等〔2〕的方法制作组织芯片,具体步骤如下:制作空白石蜡块,根据样本的数量在空白石蜡块上钻孔 (选用钻头的直径约 2 mm),在HE染色切片上选取具代表性的部位并标记,再用金属空心管(内径约 2 mm)从经定位的目标石蜡块上钻取组织,并转移到已钻孔的空白石蜡块的相应位置,将蜡块置 40℃烤箱内数天,使组织与石蜡充分融合,按常规方法连续切片,厚 4μm,裱于 10%多聚赖氨酸处理的载玻片上,56℃烤片 3h以上,供免疫组化染色。
1.5 免疫组化染色 免疫组化染色采用链霉亲和素-生物素-酶复合物(SABC)法进行,具体实验步骤严格按照试剂盒说明书进行操作。
1.6 观测指标
1.6.1 肺泡炎、肺纤维化程度判断 HE切片按 Szapiel等〔3〕的方法确定肺泡炎和肺纤维化的程度:(1)肺泡炎分级:0级:无肺泡炎(-);1级:轻度肺泡炎(+),受累面积小于全肺20%;2级:中度肺泡炎(⧺),占 20%~50%;3级:重度肺泡炎(⧺),受累面积大于 50%。(2)肺间质纤维化分级:0级:无肺间质纤维化(-);1级:轻度肺间质纤维化(+),病变范围局限在全肺 20%以下;2级:中度肺间质纤维化(⧺),病变范围占全肺 20%~50%;3级:重度肺间质纤维化(⧺),病变范围大于50%,肺泡融合,肺实质结构紊乱。 -为 0分,+为1分,⧺为 2分,⧺为 3分,将等级资料转化为计量资料。
1.6.2 免疫组化染色程度判断 免疫组化染色以细胞中出现黄色或棕黄色颗粒为阳性反应。半定量判定根据 Wilentz等〔4〕的标准略做修改:染色强度A:无色、淡黄、棕黄、棕褐分别计为0、1、2、3分;染色广度 B:阳性细胞数占总细胞数的百分比;A、B两项所得相乘所得数值为免疫组化染色指数。
1.7 统计学处理 采用 SPSS13.0软件,数据以 x±s表示。同一时间点的 4个组进行单因素方差分析,并用 q检验进行不同组间的两两比较。
2 结 果
2.1 组织病理形态学改变
2.1.1 大体观察 对照组大多双肺外观无异常,肺叶轮廓清晰,表面光滑、粉红色、弹性良好;第 14天有 1只大鼠肺叶呈淡红色,但无结节样改变。模型组第 14天双肺膨大,红色,可见散在点状暗红色出血,局部见大小不等灰白色结节样改变,弹性差;第 28天双肺较前体积缩小,硬度增加,表面结节样改变、串珠状充气空泡及条索状凹沟。中药组部分呈暗红色,偶见大小不等结节样改变、边缘有点状出血及部分肺叶体积缩小。激素组与模型组相似,部分肺叶表面光滑,局部见大小不等结节样改变,边缘有点状出血,部分肺叶体积缩小,有白色结节。
2.1.2 光镜观察 对照组大鼠大多肺结构清晰,观察各时间段未出现明显形态学改变,极少数出现肺泡间隔增宽及少量炎性细胞浸润情况。模型组第 14天肺泡间隔明显增宽,可见大量炎性细胞浸润的改变,伴成纤维细胞增多;第 28天肺泡结构破坏,肺泡间隔增宽及肺间质纤维成分增多较前更为明显,毛细血管腔明显增厚,个别闭塞,但肺部炎性细胞浸润情况较前有所减轻(见图 1)。激素组和中药组肺泡炎程度同模型组比较均明显减轻(P<0.05或P<0.01),且随着时间演变有继续减轻趋势;中药组肺泡炎减轻程度更为明显,第 28天时同对照组比较已无统计学意义(P>0.05)。激素组肺纤维化程度与模型组比较有所减轻,但不明显(P>0.05),且仍有继续加重趋势;中药组纤维化程度同模型组比较明显减轻(P<0.01),而且肺纤维化发展有减缓趋势,其中,第 28天时肺纤维化程度同激素组比较也明显减轻(P<0.05),但同对照组比较仍较重(P<0.01)(见表 1)。

图1 第 28天时各组肺组织病理图片(HE,×100)
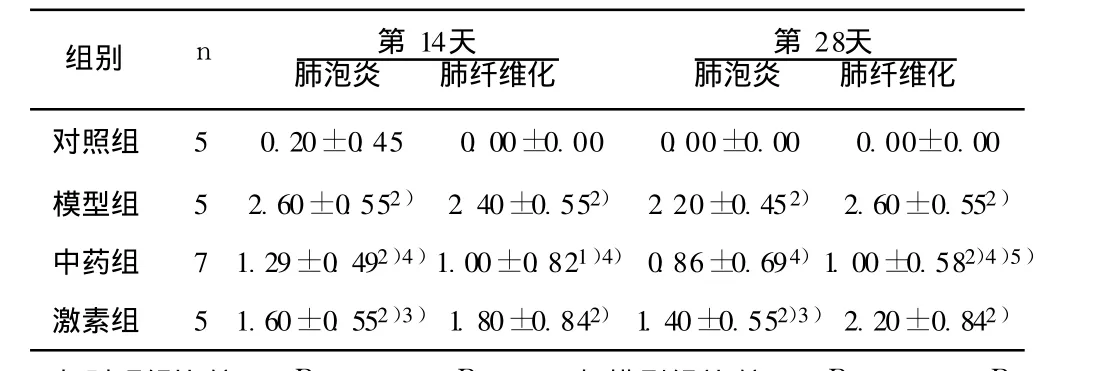
表1 4组大鼠各时间点肺泡炎、肺纤维化程度比较(分,x±s)
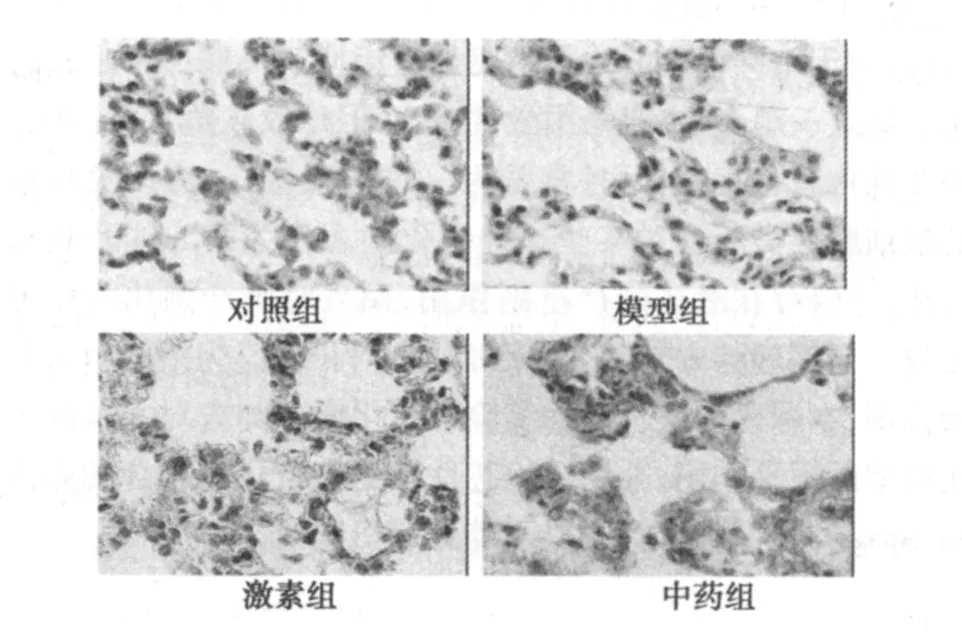
图2 第 28天时各组 Smad7免疫组化染色(DAB,×400)

表2 4组大鼠各时间点Smad7蛋白表达指数(x±s)
2.2 Smad7蛋白的表达 Smad7蛋白在对照组中大量表达,主要定位在肺泡上皮细胞的胞质中,支气管上皮细胞及少量间质细胞的胞质中也有少量表达,胞核中偶有表达(见图 2)。模型组Smad7蛋白表达明显少于对照组(P<0.01),并且有减少趋势。激素组 Smad7蛋白表达也显著少于对照组(P<0.01),同模型组比较有所增强,但无统计学意义(P>0.05),而且也有减少的趋势。中药组 Smad 7蛋白表达与激素组和模型组比较均明显增强(P<0.01),并且有升高趋势,第 28天已接近正常对照组水平(见表 2)。
3 讨 论
目前对于肺纤维化的治疗主要是应用激素、免疫抑制剂及细胞毒药物,但效果尚不能让人满意。近年来,辛洪涛〔5〕,蒋云峰〔6〕,李玉盛〔7〕等应用中医中药治疗肺纤维化取得一定效果。我们在原有中医防治肺纤维化理论基础上,深入研究其发病机制,认为肺肾亏虚为发病之本,痰瘀阻络为发病之标,毒邪是急性发作的诱因、病情加重的条件,以“活血化瘀,祛痰理肺,畅利气机”为治则组成化瘀理肺方。方中丹参功长活血化瘀生新,通行血脉,半夏燥湿化痰浊,消痞散结,既消已生之痰,又杜生痰之源,二者合用有利于消除络脉之痰浊瘀血,共为君药;当归、水蛭为臣药,助君药祛瘀生新、化痰散结、畅利络脉;黄芪具有补气升阳、益肺固表之功,补骨脂补肾壮阳,温脾,治肺肾虚喘,有补肾纳气定喘之功,二药为伍,补肺气,摄纳肾气,助阳以化阴,培补后天以养先天,共同辅助君药,达到气旺血生,血充气固,瘀去络通,百脉流畅,以维持正常气机的升降出入;薏苡仁、鱼腥草、地龙合用为佐药。全方共奏补肺固表、益肾纳气、逐瘀通络、畅利气机之功。
Smad7是转化生长因子 β(TGF-β)信号转导途径的主要抑制性调控蛋白,可以通过抑制TGF-β的信号传导发挥负调控作用〔8~10〕。在研究中人们发现,阻断 Smad7内源性表达可促进TGF-β对肺上皮细胞发育的抑制作用〔11〕,经气管内注入携带Smad7基因的重组腺病毒,则能抑制Ⅰ型前胶原 mRNA的表达,降低肺组织羟脯氨酸含量,改善肺组织纤维化程度〔12〕,提示 Smad7蛋白表达情况与肺纤维化关系密切。因而,作为TGF-β活性及肺纤维化的一种重要负向调节剂,Smad7蛋白在抗纤维化治疗的研究中日益受到重视。
通过实验我们发现,造模后第 14天后肺泡间隔明显增宽,可见大量炎性细胞浸润的改变,伴成纤维细胞增多,第 28天炎症有所减轻,但肺间质纤维成分增多较前更为明显,达到预期造模目标。给予激素干预可明显减轻肺部炎症反应,但对博莱霉素引起的肺纤维化模型的纤维化进展干预作用不大,这与目前临床应用激素治疗肺纤维化效果差的现状相符。经化瘀理肺方干预组大鼠肺部炎症及纤维化程度均明显轻于同期模型组,其中第 28天纤维化程度轻于激素组,提示化瘀理肺方对博来霉素引起的大鼠肺纤维化有干预作用。另外,我们利用组织芯片进行免疫组化染色发现,模型组的Smad7蛋白表达明显减少,且有进行性减少趋势,造模后第 14天肺纤维化大鼠的Smad7蛋白表达平均水平较对照组减少了 61%,到造模后第28天则减少了 71%,提示Smad7蛋白表达减少可能在博莱霉素致大鼠肺纤维化中起了重要作用;而经化瘀理肺方干预后,Smad 7蛋白的表达明显增强,其中到第 28天甚至与对照组表达水平相仿,提示化瘀理肺方可能部分通过增强 Smad 7蛋白表达,从而抑制 TGF-β生物活性发挥作用。
1 Selman M,King TE,Pardo A.Idiopathic pulmonary fibrosis:prevailing and evolving hypothesesabout its pathogenesis and implications for therapy〔J〕.Ann Intern Med,2001;134(2):136-51.
2 刘卫平,张红英,郭 嘉,等.组织芯片技术及其在病理学研究中的初步应用〔J〕.中华病理学杂志,2002;31(2):179-80.
3 Szapiel SV,Elson NA,Fulmur JD,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse〔J〕.Am Rev Respir Disease,1979;120(4):893-7.
4 Wilentz RE,Su GH,Dai JL,et al.Immunohistochemical labeling for DPC4 mirrors genetic status in pancreatic adenomas a new marker of DPC4 inactivation〔J〕.Am JPathol,2000;156(1):37-43.
5 辛洪涛,刘庆华,张 欣,等.芪丹颗粒剂治疗肺间质纤维化的临床研究〔J〕.山东医药,2002;42(19):20-1.
6 蒋云峰,黄 芪.桃红汤治疗特发性肺纤维化 24例〔J〕.吉林中医药,2003;23(11):14.
7 李玉盛,马淑荣.益气化纤汤治疗特发性肺纤维化 34例〔J〕.实用中医内科杂志,2006;20(3):282.
8 Zimmerman CM,Padgett RW.Transforming growth factor-βsignaling mediators and modulators〔J〕.Gene,2000;249(1-2):17-30.
9 Kavsak P,Rasmussen RK,Causing CG,et al.Smad7 binds to smurf2 to form an E3 ubiquitin ligase that targets the TGF-beta receptor for degradation〔J〕.Mol Cell,2000;6(6):1365-75.
10 Shi W,Sun C,He B,et al.GADD34-PP1c recruited by Smad7 dephosphorylates TGF beta type I receptor〔J〕.JCell Biol,2004;164(2):291-300.
11 Zhao J,Crowe DL,Castillo C,et al.Smad7 is a TGF-beta inducible attenuator of Smad2/3-mediated inhibition of embryonic lung morphogenesis〔J〕.Mech Dev,2000;93(1-2):71-81.
12 Nakao A,Fujii M,Matsumra R,et al.Transient gene transfer and expression of Smad7 prevents bleomycin-induced lung fibrosis in mice〔J〕.J Clin Invest,1999;104(1):5-11.

