联合应用全反式维甲酸与单纯疱疹病毒腺苷激酶基因对髓母细胞瘤的协同杀伤作用研究
蒲珂,李少一,马丽,高芸,刘云会
(1.中国医科大学 附属盛京医院神经外科,沈阳 110004;2.上海交通大学 医学院附属第九人民医院口腔医学院,上海 200011;3.中国医科大学 附属第一医院内分泌研究所,沈阳 110001)
髓母细胞瘤(medulloblastoma,MB)是恶性程度极高的儿童后颅窝肿瘤,呈浸润性生长,易播散转移,手术难以完全切除,预后极差[1]。基因治疗为颅内恶性肿瘤的治愈带来了希望,其中研究最广泛、最有希望的是单纯疱疹病毒腺苷激酶/更昔洛韦(herpes simplex virus-thymidine kinase/ganciclovir,HSV-tk/GCV)自杀基因系统。HSV-tk/GCV系统抗肿瘤作用的原理是在肿瘤细胞中导入腺苷激酶(thymidine kinase,TK)基因,TK基因表达的腺苷激酶可以将无毒的更昔洛韦(ganciclovir,GCV)在肿瘤局部转化为有毒的三磷酸更昔洛韦,从而发挥高效的抗肿瘤作用。该自杀基因系统毒副作用小,抗肿瘤效果强,受到了广泛关注。
TK基因介导的自杀基因治疗中还存在一种机制——“旁观者效应”:当给予更昔洛韦时,导入TK基因的“阳性细胞”周边的未导入TK基因的“阴性细胞”也会被一同杀死的现象。在“旁观者效应”存在的情况下,TK基因对肿瘤细胞的杀伤作用进一步增强。在我们以前的研究中,应用HSV-tk/GCV自杀基因系统对胶质瘤细胞系进行了较系统的研究,并且应用神经干细胞携带TK基因,对该治疗系统进行了优化,获得了很好的治疗效果[2~5]。而在好发于儿童的髓母细胞瘤中应用HSV-tk/GCV自杀基因系统的研究还未见报道。本研究联合应用全反式维甲酸(all-trans retinoic acid,ATRA)与 HSV-tk/GCV 系统,研究二者联合应用对人的髓母细胞瘤细胞系Daoy的杀伤作用,旨在探讨在髓母细胞瘤细胞系中应用HSV-tk/GCV自杀基因治疗可行性,并且针对ATRA对该系统中“旁观者效应”的影响进行了初步探讨。
1 材料与方法
1.1 主要试剂及细胞株
ATRA、噻唑蓝(MTT)、G418、二甲基亚枫(DMSO)均购自Sigma公司,Polybrene购自Aldrich公司。Daoy髓母细胞瘤细胞系购自美国ATCC公司。产生复制缺陷型HSVtk逆转录病毒的PA317包装细胞由Genetic Therapy公司提供。
1.2 ATRA对Daoy细胞生长抑制作用的测定
取对数生长期的Daoy细胞,以2×103/孔接种于96孔板,待细胞贴壁后加不同浓度的ATRA(0~1 μmol/L),每个浓度设3个复孔,每天换液1次,3 d后MTT法测细胞存活率。
1.3 Daoy细胞的转染及筛选
取对数生长期的Daoy细胞,以50%~60%细胞密度铺于6孔板,4~6 h后更换为加入1 ml HSV-tk逆转录病毒上清和8μg/ml的Polybrene的培养液,继续培养24 h后更换为正常培养液,继续培养12 h。将转染后细胞转移至24孔板,加200μg/ml G418筛选,每3 d换液1次,筛选12 h,选取有G418抗性的细胞在以后的实验中应用。
1.4 Daoy-tk细胞对GCV敏感性测定
对照组:正常Daoy细胞;实验组:Daoy-tk细胞。分别取对数生长期的两种细胞以2×103/孔密度接种于96孔板,细胞贴壁后,加不同浓度梯度的GCV(0~30μg/ml),每个浓度设3个复孔,条件培养液每2 d更换1次。第7天MTT法测细胞生存率:每孔加入5μg/ml的MTT 20μl,37℃孵育4 h,弃培养液,加入DMSO 150μl,在酶联免疫检测仪上以492 nm波长检测各孔吸光光度值(A)。细胞存活率=实验组A均值/对照组A均值×100%。
1.5 在不同浓度GCV存在下,Daoy-tk细胞通过“旁观者效应”对Daoy细胞的杀伤作用
对照组:单独Daoy细胞;治疗组:Daoy-tk与Daoy 1∶1比例混合,以4×103/孔的细胞密度接种于96 孔板,加不同浓度的 GCV(0~30 μg/ml),每个浓度设3个复孔,条件培养液2 d更换1次。7 d后MTT法测细胞生存率。
1.6 Daoy-tk联合ATRA对Daoy细胞杀伤作用的观察
(1)对照组:单独 Daoy细胞;(2)Daoy-tk单独治疗组:Daoy-tk与Daoy细胞按不同比例(1∶1~1∶16)混合;(3)Daoy-tk 与 ATRA 联合治疗组:Daoy-tk与Daoy细胞按不同比例(1∶1~1∶16)混合。以上3组均以4×103/孔的细胞密度接种于96孔板,每种细胞比例设3个复孔,对照组和Daoy-tk单独治疗组加3μg/ml GCV,Daoy-tk与ATRA联合治疗组加3 μg/ml GCV和1μmol/L的ATRA。2 d换液1次,7 d后MTT法测细胞生存率。
1.7 统计学分析
实验数据应用SPSS12.0统计,以x±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 ATRA对Daoy细胞生长的抑制作用
不同浓度的ATRA对Daoy细胞作用3 d后,MTT结果表明:在0.5~1μmol/L区间范围内,ATRA即可对Daoy细胞的生长产生明显抑制作用,并且随ATRA浓度的增加,抑制作用逐渐增强。当ATRA浓度为0.5μmol/L时,Daoy细胞的存活率约为90.13%;ATRA浓度为1μmol/L时,Daoy细胞的存活率为79.13%,与ATRA浓度为0μmol/L时的对照组相比存在统计学差异(P<0.05)。见图1。

2.2 Daoy-tk对GCV的敏感性
Daoy细胞与转染后的Daoy-tk细胞分别加入不同浓度的GCV,7 d后MTT结果显示:Daoy-tk细胞在GCV浓度为0.1μg/ml时出现大量死亡,3μg/ml时达到最大杀伤作用,而未转染的Daoy细胞在GCV浓度为30μg/ml时才出现明显死亡,两组差异有统计学意义(P<0.05)。见图2。

2.3 在不同浓度GCV存在下,Daoy-tk细胞通过“旁观者效应”对Daoy细胞杀伤作用
为了观察不同浓度GCV作用下,Daoy-tk细胞通过“旁观者效应”对Daoy细胞的杀伤作用及确定GCV的最低有效剂量,在Daoy与Daoy-tk混合细胞中加入不同浓度的GCV,7 d后MTT结果显示:GCV在3μg/ml浓度时即对Daoy产生最大杀伤作用,此时Daoy细胞的存活率为57.69%。继续加大GCV浓度,不能增强其抗肿瘤效果。见图3。
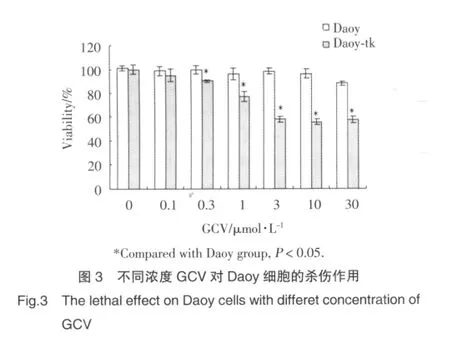
2.4 联合应用ATRA与Daoy-tk对Daoy细胞杀伤作用
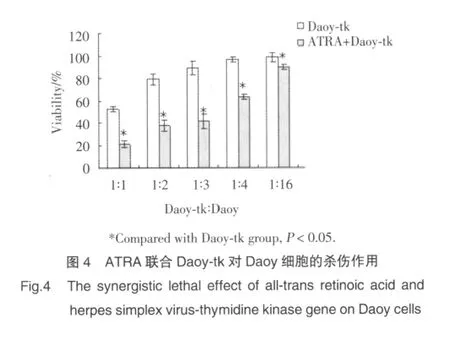
Daoy-tk与Daoy细胞按不同比例混合,加入3 μg/ml的GCV后,对Daoy细胞产生明显的杀伤作用,并且随Daoy-tk细胞比例的增加,杀伤作用逐渐增强,Daoy-tk∶Daoy=1∶4时,Daoy细胞存活率为89.23%;联合应用1μmol/l的ATRA后,明显增强对Daoy细胞的杀伤作用,Daoy-tk∶Daoy=1∶16时,仍有明显的杀伤作用,Daoy细胞存活率为89.7%。见图4。
3 讨论
自杀基因疗法是基因治疗中研究最广泛、最有希望的治疗方法,在体内外实验中,对多种肿瘤细胞系均具有很强的杀伤作用。但临床实验中抗肿瘤效果并不让人满意[6],除了病毒载体的转染效率低之外,“旁观者效应”作用低下也是重要原因。“旁观者效应”的发挥依赖于细胞间缝隙连接通讯(gap junctional intercellular communicatisn,GJIC)的建立,恶性肿瘤细胞具有浸润性生长、易播散转移的特性,GJIC的建立相对较少[7]。如何增强“旁观者效应”,成为目前自杀基因治疗需要攻克的重要课题。在我们以前的研究中,应用神经干细胞携带TK基因,利用神经干细胞对胶质瘤细胞的主动运动的趋化能力,将TK基因尽可能携带到肿瘤细胞周围,产生更大的“旁观者效应”,获得了非常好的治疗效果[4],但针对“旁观者效应”机制方面加强TK基因抗肿瘤效果的研究报道很少,这方面的工作必将为HSV-tk/GCV自杀基因治疗系统取得更好的临床疗效提供有益补充。
ATRA是维生素A的重要衍生物,临床已广泛应用于血液系统肿瘤的治疗,其自身即可以诱导肿瘤细胞分化与凋亡。本研究发现ATRA在极低浓度下(0.5~1μmol/L)即可对髓母细胞瘤细胞系Daoy的生长产生明显抑制作用。而有报道ATRA在1~10 μmol/L浓度范围内才可对胶质瘤C6细胞的生长产生抑制作用[8],可见Daoy细胞系对ATRA的敏感性更高。
ATRA除了自身对肿瘤细胞的抑制作用外,还可以上调肿瘤细胞间GJIC的表达。张雪峰等研究表明,ATRA能提高胶质瘤C6细胞系中Cx43的表达,ATRA提高Cx43表达后能进一步增强HSV-tk/GCV系统对胶质瘤的杀伤作用[9]。Chen 等[10]研究表明,联合应用ATRA能增强HSV-tk/GCV系统对前列腺癌细胞的杀伤作用。本实验中我们证实,tk细胞与Daoy细胞比例为1∶4时,对肿瘤细胞生长有明显的抑制作用。联合应用ATRA时即使tk细胞与肿瘤细胞比例低至1∶16时仍有明显的肿瘤抑制作用,并且同等细胞比例条件下,联合治疗组对肿瘤细胞杀伤作用更强。作为脂溶性药物,ATRA可以自由通过血脑屏障在脑内储集,是联合HSV-tk/GCV系统治疗颅内恶性肿瘤的理想用药。
综上所述,ATRA与HSV-tk/GCV系统联合应用,对人的髓母细胞瘤细胞系Daoy的杀伤具有协同作用。联合应用两种临床安全性都已得到证实的治疗方案,必定使颅内恶性肿瘤的治疗具有广阔的前景。
[1]Packer RG,Vezina G.Management of and prognosis with medulloblastoma:therapyatacrossroads[J].Arch Neurol,2008,6(11):1419-1424.
[2]Li S,Tokuyama T,Yamamoto J,et al.Potent bystander effect in suicide gene therapy using neural stem cells transduced with herpes si mplex virus thymidine kinase gene[J].Oncology,2005,69(6):503-508.
[3]Li S,Tokuyama T,Yamamoto J,et al.By stander effect-mediated gene therapy of gliomas using enetically engineered neural stem cells[J].Cancer Gene Therapy,2005,12(7):600-607.
[4]Li S,Gao Y,Tokuyama T,et al.Genetically engineered neural stem cells migrate and suppress glioma cell growth at distant intracranial sites[J].Cancer Letters,2007,251(2):220-227.
[5]李少一,高芸,刁宏宇,等.应用导入HSV-tk基因的神经干细胞治疗胶质瘤的体外实验研究[J].中华神经外科杂志,2006,22(12):759-761.
[6]林松,王忠诚,张懋植,等.胸苷激酶基因治疗恶性胶质瘤I期临床研究[J].中华神经外科杂志,2004,20(05):381-384.
[7]Huang RP,Hossain MZ,Sehgal A,et al.Reduced connexin43 expression in high-grade human brain glioma cells[J].Surg Oncol,1999,70(1):21-24.
[8]綦斌,谭岩,罗毅男,等.全反式维甲酸诱导大鼠C6脑胶质瘤细胞凋亡的实验研究[J].中国肿瘤临床,2008,35(1):44-48.
[9]张雪峰,任祖渊,方福德,等.全反式维甲酸与单纯疱疹病毒胸苷激酶基因对胶质瘤的协同杀伤作用[J].癌症,2002,25(5),473-479.
[10]Chen W,Yan C,Hou J,et al.ATRA enhances bystander effect of suicidegenetherapyinthetreatmentofprostatecancer[J].Urol Oncol,2008,26(4):397-405.

