胰高血糖素受体siRNA对糖尿病模型小鼠的降糖作用研究
周洁,彭金良,徐宇虹#(.上海交通大学药学院分子药剂学实验室,上海市 200240;2.上海交通大学生命科学技术学院,上海市 200240)
对于2型糖尿病病症,胰高血糖素受体(GCGR)与胰高血糖素之间的相互作用对于血糖调节具有重要意义。一方面,胰高血糖素可促进糖异生和糖原分解;另一方面,胰高血糖素可间接影响胰岛素分泌情况。因此通过抑制GCGR发挥作用可以缓解高血糖症状。有研究[1]发现GCGR的基因敲除后模型小鼠中血糖浓度明显降低,并且小鼠的糖耐量得到了很好的提高,这一发现也证实了GCGR在降糖中的重要地位。
为了达到降糖的目的,需要有效的手段以抑制肝脏中GCGR的表达。近年来小分子药物GCGR拮抗药被报道具有很好的降糖稳定作用[2];GCGR的反义抑制核苷酸也被证实能够有效地改善糖尿病模型小鼠的高血糖症状[3]。而近年来,siRNA类药被认为是一种更有效的抑制特定基因表达的药物,具有极大的应用前景[4]。基于此,在本研究中,笔者设计和研发了针对糖尿病小鼠模型GCGR的siRNA,考察了经高压快速静脉注射系统给药后,siRNA类药在缓解模型小鼠血糖症状中的作用情况。
1 材料
Milli-Q型纯水机(美国Millipore公司);BS210S电子天平(德国Sartorius公司);UV-21.2PC可见-紫外分光光度计(尤尼柯上海仪器有限公司);pHS-2S型数显酸度计(上海天达仪器有限公司);Centrifuge 5415R离心机(德国Eppendorf公司);BCM-100生物洁净工作台(苏州净化设备有限公司);DK-S24电热恒温水槽(上海精宏实验设备有限公司)。
四氧嘧啶(Alloxan monohydrate,美国Sigma公司,色谱纯);葡萄糖测定试剂盒(上海荣盛生物技术有限公司,批号:20030101);靶向GCGR的3条长度为21 bp的siRNA双链序列(上海吉玛制药技术有限公司,色谱纯化单链冻干粉,纯度:>97%);焦磷酸二乙酯(DEPC)处理除去RNA酶的磷酸盐缓冲溶液(PBS,自制)。
健康昆明鼠,♂,6周龄,体质量30 g左右,由上海斯莱克试验动物责任有限公司提供(许可证号:SCXK(沪)-2007-0005)。于上海交通大学药学院实验动物中心20℃明暗交替环境中适应性预培养1周后进行实验。
2 方法与结果
2.1 siRNA设计合成
设计针对小鼠GCGR的siRNA。根据GCGR的refseq序列NM_008101,根据siRNA设计原理,使用siRNA设计软件[5],设计格式为AA19NTT、长度为21 bp的siRNA。挑选3条分别靶向于GCGR基因不同位点的siRNA,结果如下:GCGR siRNA-1靶序列AAAGCTCTTCAGGAGGAAAGGTT(GCGR基因1451~1473 bp处),正义链5′-AGCUCUUCAGGAGGAAAGGUU,反义链3′-UUUCGAGAAGUCCUCCUUUCC;siRNA-2靶序列AAAGTGCAGCACCGCCTAGTGTT(455~477 bp处),正义链5′-AGUGCAGCACCGCCUAGUGUU,反义链3′-UUUCACGUCGUGGCGGAUCAC;siRNA-3靶序列AACTACATCCATGGGAACCTGTT(707~729 bp处),正义链 5′-CUACAUCCAUGGGAACCUGUU 反义链 3′-UUGAUGUAGGUACCCUUGGAC。对照组非靶向性siRNA正义链5′-UUCUCCGAACGUGUCACGUTT,反义链3′-TTAAGAGGCUUGCACAGUGCA。siRNA的合成均由上海吉玛制药技术有限公司完成。
将合成得到的4条siRNA序列用DEPC处理过的pH7.4、平衡后的PBS溶解,浓度为1 nmol·mL-1,备用。整个实验操作过程在无菌操净台上进行,移液枪枪头耗材等均使用DEPC处理过。
本文中数据处理以及作图采用Microsoft Office Excel 2003,组内标准差计算采用Excel标准计算函数Stdev。
2.2 糖尿病模型小鼠以及血糖检测方法的建立
2.2.1 糖尿病模型小鼠建立及其健康状况监测。本研究中采用2%(W%)四氧嘧啶/PBS诱导建立小鼠糖尿病模型:取小鼠20只,适应饲养环境1周并测正常小鼠空腹4 h后的体质量以及血糖含量;小鼠禁食不禁水12 h后,配制新鲜的四氧嘧啶诱导剂溶液,给药方式为一次性腹腔注射(ip),剂量为200 mg·kg-1(体质量)。注射完毕后为小鼠补充饮水以及食物,并且更换垫料。注射诱导剂72 h后,测量空腹4 h以后的小鼠体质量以及血糖含量,检测建模成功率并且进行分组。20只小鼠诱导前血糖含量均值为(7.1±3.0)mmol·L-1,诱导后死亡2只,血糖含量大于15 mmol·L-1的小鼠共12只,血糖含量均值(34.6±3.9)mmol·L-1,诱导建模成功率为60%。
将12只建模成功后的小鼠分为4组,每组3只,各组血糖含量平均值分别为A组(38.4±3.3)mmol·L-1、B组(29.2±4.6)mmol·L-1、C 组(34.8±3.8)mmol·L-1、D 组(36.1±2.1)mmol·L-1。
建模后16 d内,检测各组小鼠体质量情况以了解其健康状态,结果见表1。
表1 建模后不同时间各组小鼠体质量变化数据(g,,n=3)Tab 1 Changes of body weight of mice after modeling(g,,n=3)
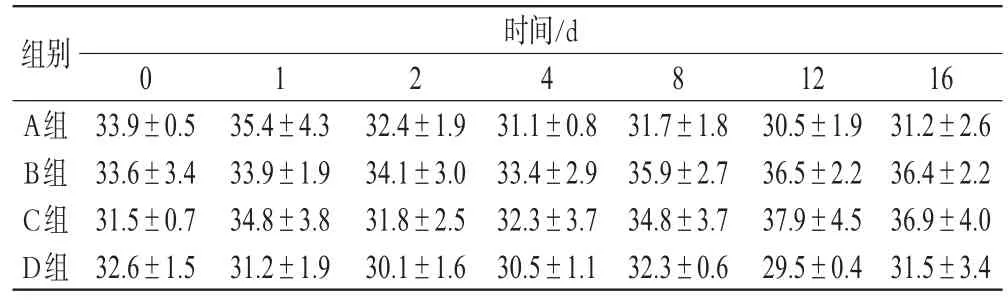
表1 建模后不同时间各组小鼠体质量变化数据(g,,n=3)Tab 1 Changes of body weight of mice after modeling(g,,n=3)
1631.2±2.636.4±2.236.9±4.031.5±3.4组别A组B组C组D组时间/d 033.9±0.533.6±3.431.5±0.732.6±1.5124835.4±4.333.9±1.934.8±3.831.2±1.932.4±1.934.1±3.031.8±2.530.1±1.631.1±0.833.4±2.932.3±3.730.5±1.131.7±1.835.9±2.734.8±3.732.3±0.61230.5±1.936.5±2.237.9±4.529.5±0.4
由表1可知,诱导后糖尿病模型小鼠体质量较为稳定,健康状态良好。
2.2.2 血糖含量检测方法的建立。小鼠禁食不禁水4 h后,尽量保持小鼠情绪平静,迅速用毛细玻璃管于小鼠眼底取血100 μL左右(3~4滴血),置于0.5 mL离心管中。血液样本于4℃冰箱中冷藏放置至离心管底部出现血液凝结后,立即于4℃离心(3000 r·min-1,5 min),取上层血清作葡萄糖含量检测。
将葡萄糖检测试剂盒中的R1、R2工作液等比例混合作为测试液。取血清样本4µL加入1 mL的测试液中,充分混匀,立即置于37℃电热恒温水槽中放置15 min,使之显色。在紫外波长505 nm处,以空白测试液加蒸馏水作对照调零,读取样本管的吸光度值。同时,制备5~30 mmol·L-1梯度浓度的葡萄糖标准液,制作吸光度值-葡萄糖浓度标准曲线从而读取样本的葡萄糖浓度。
本实验条件下葡萄糖系列浓度回归方程为葡萄糖浓度(mmol·L-1)=59.265×吸光度值-2.250(R2=0.9962),按照此回归方程可测算血液中的葡萄糖浓度。
2.3 小鼠给予siRNA后血糖含量及糖耐量实验
2.3.1 给药。造模成功后,模型小鼠正常饲养第2天,按照“2.2.1”项下分组情况分别给药:A组siRNA-1,B组siRNA-2,C组siRNA-3,D组非靶向性siRNA。
取“2.1”项中浓度为1 nmol·mL-1的4种siRNA溶液,按照溶液体积为小鼠体质量的10%进行给药,例如,1只体质量为30 g的小鼠给药剂量约为3 nmol siRNA物;给药剂量参考文献[6],进行小鼠肝靶向体内静脉给药实验。给药方式采用尾静脉高压快速推注法一次性给药;给药完毕后密切观察小鼠,及时补充水和饲料。
2.3.2 给药后血糖含量-时间变化情况。分别于给药后第1、2、4、8 d时按照“2.2.2”项下方法测量4组中各小鼠血糖含量,得到不同siRNA序列给药后小鼠血糖含量变化曲线,见图1。

图1 给药后不同时间各组小鼠血糖含量变化Fig 1 Level of blood glucose in diabetic rats at different time points after treatment
由图1可见,A组给药后第1天血糖含量(5.4±1.5)mmol·L-1,与给药前比较降低了86.0%,此后的几天内血糖含量有所回升,但第8天血糖含量依然低于给药前血糖,为(11.7±3.5)mmol·L-1,与给药前比较降低了69.4%;B组给药后第1天血糖含量(17.1±1.4)mmol·L-1,与给药前比较降低了41.4%,此后的几天血糖含量回升;C组给药后第1天血糖含量(27.1±7.8)mmol·L-1,与给药前比较降低了22.2%,此后的几天血糖回升;D组给药后第1天血糖含量(37.8±4.2)mmol·L-1,与给药前比较升高了4.7%,此后的几天血糖逐渐升高,第8天时与给药前比较升高了32%。
2.3.3 糖耐量试验。在siRNA给药后第2天,所有4组小鼠禁食4 h后取血测血糖含量,并定为零时刻数据,ip葡萄糖,剂量为2 g·kg-1。于给糖后30、60、90、120 min时间点分别取血测量4组小鼠血糖含量,得到血糖含量-时间曲线,见图2。
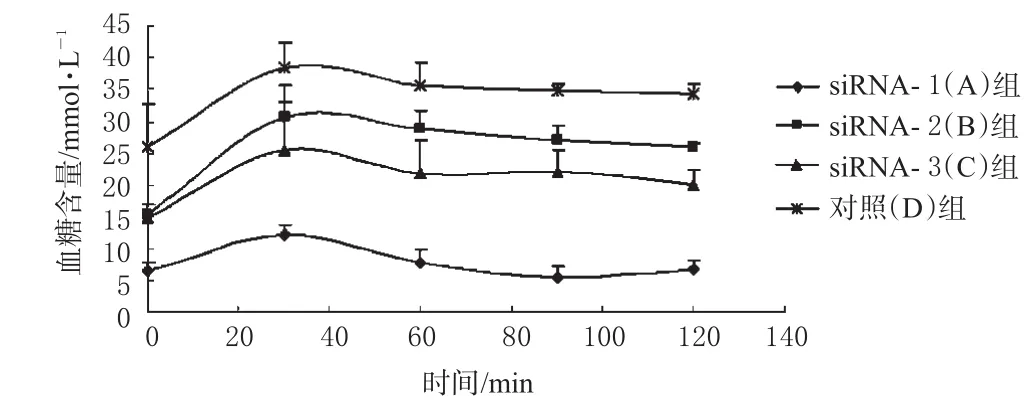
图2 腹腔注射葡萄糖后不同时间点各组小鼠血糖含量变化Fig 2 Level of blood glucose in diabetic rats at different time points after intraperitoneally injected with glucose
计算得出A、B、C、D 4组血糖含量-时间曲线下面积(AUC)分别为964.5、3216.1、2606.9、4173.9 min·mmol·L-1。此值可反映小鼠对葡萄糖的利用程度,AUC的值越小,证明其越能有效地利用葡萄糖。其中A、B、C组的AUC值分别为D组的23.11%、77.1%、62.5%。
3 讨论
通过对给药后模型小鼠血糖含量的监测,证实siRNA对模型小鼠具有一定的缓解高血糖症状的效果。其中,siRNA-1的降糖效果最为显著,给药后第1天血糖含量与给药前比较降低达86.0%,siRNA-2和siRNA-3也有不同程度的降糖作用,并以在给药后第1天作用最明显,第3天后血糖含量有所回升,这可能与siRNA在小鼠体内发生降解有关。此外,siRNA-1在给药后8 d内血糖并未回升到给药前水平,这可能是siRNA-1给药后具有改善小鼠机体功能的作用,引发了小鼠体内自主降糖的生理过程所致。siRNA-1、siRNA-2、siRNA-3对模型小鼠的不同降糖作用说明,针对GCGR基因的不同位点进行转录后可能产生各异的作用。
在糖耐量实验中,由AUC结果可知,siRNA给药后与对照组比较能更好地改善小鼠利用葡萄糖情况,说明siRNA不仅能够有效地缓解高血糖症状,还能够改善糖尿病小鼠对于葡萄糖的生物利用率,该过程机制还需要进一步的研究。
[1]Gelling RW,Du XQ,Dichmann DS,et al.Lower blood glucose,hyperglucagonemia,and pancreatic cell hyperplasia in glucagon receptor knockout mice[J].PNAS,2003,100(3):1438.
[2]Unson CG.Glucagon and the glucagon receptor:merrifield years at the interface of chemistry and biology[J].Int J Pept Res Ther,2007,13(1):19.
[3]Sloop KW,Cao JX,SieskyAM,et al.Hepatic and glucagon-like peptide-1 mediated reversal of diabetes by glucagon receptor antisense oligonucleotide inhibitors[J].J Clin Invest,2004,113(11):1571.
[4]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806.
[5]Jagla B,Aulner N,Kelly PD,et al.Sequence characteristics of functional siRNAs[J].RNA,2005,11(6):864.
[6]Song E,Lee SK,Wang J,et al.RNA interference targeting Fas protects mice from fulminant hepatitis[J].Nat Med,2003,9(3):347.

