聚乳酸作为脑植入剂载体的安全性初步研究
唐华非,刘松青,李飞,冯华(1.第三军医大学西南医院药学部,重庆市 400038;.第三军医大学西南医院神经外科,重庆市 400038)
由于血脑屏障的存在,多数药物如化疗药、抗生素等以常规方式给药后难以在脑内达到有效浓度,若加大给药量又会增加全身性毒副作用。脑植入剂作为一种新型制剂,不仅可以使化疗药物避开血脑屏障,直接作用于肿瘤组织,减少全身性毒副作用,还具有缓控释特性,在一定时间内使药物能够在病变部位维持在有效浓度。
聚乳酸(Poly-lactic acid,PLA)属于脂肪族聚酯化合物,因其具有完全生物降解性和优良的生物相容性,在1997年被美国食品药品管理局(FDA)批准作为药用辅料,并广泛地应用于药物缓控释系统。笔者曾以聚乳酸作为药物缓释载体自制羟基喜树碱脑植入缓释片,已完成缓释片的处方优化[1],并初步用于实验动物恶性脑肿瘤的研究,取得了良好效果。脑组织具有其特殊性,尤其是脑神经元为高度分化的细胞,被损伤后不能再生。为了解聚乳酸对神经元和脑组织的影响,本文通过体外细胞培养和大鼠体内实验观察聚乳酸对神经元和脑组织的作用,综合评价聚乳酸在脑内应用的生物安全性。
1 材料与方法
1.1 试药、仪器与动物
聚乳酸(山东省医疗器械研究所,批号:060501,分子量:20000);自制聚乳酸空白片(直径3 mm,厚度2 mm,60Co照射灭菌后备用);D-Hanks、DMEM/F12培养基(北京Hyclone公司);胎牛血清、马血清(美国Gibco公司);N3培养基、细胞分裂抑制剂(北京军事医学科学院);神经特异性烯醇化酶(NSE)单克隆抗体、3,3-二氨基联苯胺(DAB)显色试剂盒(北京中山生物技术有限公司);细胞计数试剂盒(Cell counting kid-8,CCK-8,日本同仁化学研究所中国上海代表处);Hoechst33258染液、抗荧光萃灭液、苏木素-伊红染液(Hematoxylin-Eosin,HE)、尼氏染液(Nissl)均由上海Beyotime公司提供。
激光共聚焦显微镜(德国Zeiss公司);倒置相差显微镜(日本Olympus公司)。
成年SD大鼠18只,♂,体质量200~230 g;新生1 d的SD大鼠。生产合格证号:SCXK(军)2002-007,由第三军医大学实验动物中心提供。
1.2 体外试验方法
1.2.1 孔板预处理。聚乳酸组孔板采用溶剂挥发成膜法[2]进行处理,即将定量的聚乳酸溶解在二氯甲烷和丙酮的混合溶剂中(体积比为9∶1),然后倒入铺有聚四氟乙烯薄膜的孔板中,待溶剂挥发完全后,加入异丙醇浸润,脱膜后,干燥至恒重,60Co(2.0 Mrad)照射灭菌[3],小牛皮胶包被,隔夜使用。正常对照组孔板仅用小牛皮胶包被。
1.2.2 大脑皮层神经元原代培养[4]。将新生1 d的SD大鼠用75%的乙醇浸泡消毒后,采用无菌方法迅速断头,取大脑,用D-Hanks液清洗并剔除脑膜和血管,将分离得到的大脑皮质剪成约1 mm3大小的组织块,用0.125%胰蛋白酶37℃消化30 min。经200目筛网过滤,离心(800 r·min-1,5 min)后弃去上清,加入含马血清培养基制成细胞悬液。计数后按每毫升106个接种于预处理的96孔培养板或24孔培养板中,置于37℃、5%CO2孵箱内培养。48 h后全量换N3培养基[5](DMEM/F12培养基+2%N3),并加入细胞分离抑制剂(5-氟-2’-脱氧尿苷15 μg·mL-1和尿苷35 μg·mL-1),作用48 h后更换新鲜培养液。以后每3 d半量更换培养液1次。
1.2.3 神经元纯度鉴定。神经元体外原代培养至第7天,进行NSE染色鉴定。神经元可被NSE特异性识别并表现为弥漫性胞浆染色。随机计数500个细胞,计算NSE阳性细胞染色率。方法步骤参照试剂盒说明书。
1.2.4 倒置相差显微镜观察。体外原代培养的大脑皮层神经元生长周期较长,分别在不同时间点观察聚乳酸组和正常对照组细胞的生长情况。
1.2.5 细胞毒性测定。分别在体外培养神经元至第7、9、12天时利用CCK-8[6]检测聚乳酸对神经元的影响。该试剂中含有WST-8,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的formazan,细胞毒性越大,则颜色越浅。
将神经细胞分别接种于预处理的96孔板中,每个处理组设6个复孔,并设不含细胞的空白对照孔。每孔加CCK-8试剂10 μL,37℃孵育2 h后,在酶标仪上采用双波长进行测定,检测波长490 nm,参比波长550 nm。
1.2.6 检测聚乳酸对细胞凋亡的影响。分别将体外培养至第7、9、12天的神经元用4%多聚甲醛4℃固定5 min,蒸馏水充分漂洗后,加Hoechst33258工作液染色10 min。蒸馏水漂洗后,用滤纸吸去残留的液体,滴加少许抗荧光萃灭剂和封片剂于载玻片上,将盖玻片的细胞面朝下进行封片,置于激光共聚焦显微镜下观察。随机选择不同视野,至少计数500个细胞,细胞的凋亡情况用百分率表示。
1.3 体内实验方法
1.3.1 大鼠分组。将SD大鼠随机分为3组,分别为聚乳酸空白片组、假手术组和正常对照组,每组6只。
1.3.2 模型制作。采用3%戊巴比妥钠40 mg·kg-1腹腔注射进行麻醉,立体定向仪固定大鼠头部,无菌开颅,以冠状缝前3 mm,矢状缝右侧3.5 mm为中心,开直径为3 mm的骨窗[7],切开硬膜,取60Co照射灭菌的聚乳酸空白片植入皮层下1 mm,缝合。假手术组采用同样方法开颅,模拟聚乳酸空白片机械损伤,剪去一定大小的皮质后,缝合。正常对照组不作任何处理。
1.3.3 大鼠术后观察。在术后不同时间点对大鼠各项指标进行观察检测,包括饮食、行为、体质量变化等,进而对大鼠受损和恢复程度进行评价分析。
1.3.4 标本取样及检测。植入缓释片后30 d,分别对大鼠实施麻醉,4%多聚甲醛全身灌注,取大脑,去除缓释片残片,生理盐水冲洗,滤纸吸干水分,10%福尔马林溶液固定保存。HE染色后观察神经元和胶质细胞的数量和分布,对大脑正常组织和病变组织的形态结构进行比较。Nissl染色后观察神经元尼氏体受染情况,在生理情况下,尼氏体大而数量多,反映神经细胞合成蛋白质的功能较强,在神经元受损时,尼氏体的数量可减少甚至消失。
1.4 统计学分析
2 结果
2.1 神经元纯度鉴定结果
体外原代培养至第7天的神经细胞,经NSE染色,胞浆和突起被染成棕褐色而胞核未被染色的为阳性细胞,整个细胞都未被染色的为阴性细胞。采用该方法体外培养大脑皮层神经元纯度经鉴定达95%以上。
2.2 倒置相差显微镜观察结果
神经元接种6~12 h后开始贴壁,并有集合现象,种植12 h后,大部分细胞贴壁呈圆形,其中少数神经细胞开始伸出1~2个突起。培养24 h后,伸出突起的神经细胞逐渐增多,突起一般长为20~40 μm。7 d后神经元胞体大,饱满,直径8~12 μ m,有立体感,轴突细长均匀,直径恒定,树突长而多,呈网格状。2组细胞形态见图1。

图1 2组神经元的生长情况(×200)a.正常对照组;b.聚乳酸组Fig 1 The growth of neurons in 2 groups(×200)a.normal control group;b.PLAgroup
图1显示,体外原代培养皮层神经元9 d后,2组神经元胞体均比较饱满,周围有光晕,生长状态良好。
2.3 聚乳酸对体外培养大脑皮层神经元毒性的影响
以CCK-8吸光度值为指标测得聚乳酸对体外培养的大脑皮层神经元毒性的影响见表1。
表1 2组不同时间点神经元的CCK-8吸光度值()Tab 1 The CCK-8 absorbance of neurons in 2 groups at different time points()
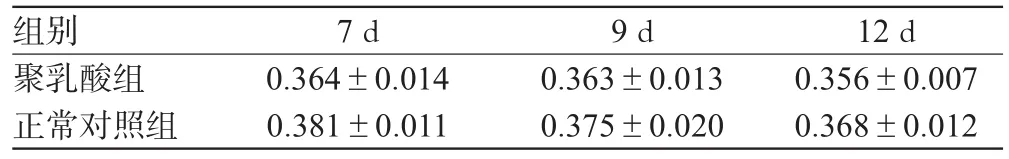
表1 2组不同时间点神经元的CCK-8吸光度值()Tab 1 The CCK-8 absorbance of neurons in 2 groups at different time points()
12 d 0.356±0.0070.368±0.012组别聚乳酸组正常对照组7 d 0.364±0.0140.381±0.0119 d 0.363±0.0130.375±0.020
表1显示,各时间点2组两两比较,正常对照组CCK-8吸光度值均略高于聚乳酸组,但经统计学分析没有显著性差异(P>0.05)。
2.4 聚乳酸对体外培养大脑皮层神经元凋亡的影响
聚乳酸对体外培养的大脑皮层神经元凋亡的影响见表2。表2显示,随时间的延长,2组神经元凋亡率均有所增加;各时间点2组两两比较,聚乳酸组致神经元凋亡率略高于正常对照组,但经统计学分析没有显著性差异(P>0.05)。
表2 2组不同时间点神经元凋亡率(%,)Tab 2 Apoptosis rates of neurons in 2 groups at different time points(%,)

表2 2组不同时间点神经元凋亡率(%,)Tab 2 Apoptosis rates of neurons in 2 groups at different time points(%,)
组别聚乳酸组正常对照组12 d 4.59±0.954.50±0.987 d 3.68±2.423.64±2.219 d 4.25±2.293.88±2.86
2.5 大鼠行为能力观察结果
术后各组大鼠活动量均减少,食物和水的消耗量降低;1 d后能正常饮食,聚乳酸空白片组较假手术组警觉性降低。在术后3 d内聚乳酸空白片组体质量下降较多,5 d后各组大鼠行为能力差异不明显,实验期间各组大鼠均未发生非处死性死亡。
2.6 聚乳酸空白片对大鼠脑组织的影响
各组脑组织HE染色和Nissl染色结果见图2(A点指示假手术所致脑损伤;B点指示聚乳酸空白片所致脑组织缺损,箭头指示小胶质细胞增生)、图3(图f中箭头指示尼氏染色的神经元)。

图2 各组脑组织HE染色(×200)c.正常对照组;d.假手术组;e.聚乳酸空白片组Fig 2 Brain tissue stained by HE in each group(×200)c.normal control group;d.sham-operated group;e.PLAblank tablet group
图2为30 d后大鼠脑组织HE染色结果。与假手术组比较,聚乳酸空白片组大鼠受损脑组织处出现小胶质细胞增生,但神经元数量和形态没有明显变化。图3为30 d后大鼠脑组织的Nissl染色结果。脑组织神经元的尼氏体着蓝色,胞核淡染。与假手术组比较,聚乳酸空白片组大鼠脑组织神经元尼氏体的数量仍维持在较高水平,差异不明显。
上述各实验结果表明,本实验采用的原代细胞培养方法可以得到纯度较高、活性较好、生长稳定的大脑皮层神经元;聚乳酸对体外培养的大鼠大脑皮层神经元抑制作用和诱导凋亡作用均不明显;聚乳酸植入脑部后,脑组织有一定的炎症反应,但神经元的数量和活性未受显著影响。
3 讨论
神经元是高等动物神经系统的结构单位和功能单位。随着脑内靶向治疗技术的开发和应用,越来越多的缓控释材料被应用于脑肿瘤的治疗。作为脑植入缓释制剂的载体,除了要具有良好的生物降解性,更重要的是对神经元的生长和功能影响要小。本实验首次对聚乳酸和大脑皮层神经元进行了共培养,证实了聚乳酸与体外培养的大脑皮层神经元可以长期共存,神经元经聚乳酸诱导后凋亡不明显。
在神经元体外培养过程中,前期主要是对神经元的纯化过程,神经元也会发生部分自然死亡,7 d后存活下来的细胞数量才趋于稳定。为减少实验误差,检测神经元活性一般选择在培养至7~9 d后进行。
聚乳酸空白片植入脑内后,脑组织有轻微的的炎症反应,且略强于假手术组,其原因除机械损伤外,可能与聚乳酸代谢过程中产生的部分碎片有关[8]。尼氏染色结果显示神经元的数量和蛋白合成能力受影响程度不明显,与文献[7]对聚己内酯(PCL)和聚乳酸乙醇酸共聚物(PLGA)生物相容性研究结果相符,聚乳酸对脑组织的损伤不明显。对高分子材料的体内降解研究[9]表明,PLGA被植入体内4周时,74%以上已被降解代谢,而聚乳酸的降解要更快些,所以动物体内实验选择30 d作为观察时间点。
本研究通过体外和体内实验观察聚乳酸对神经元和脑组织的影响,初步证实聚乳酸对体外培养的大脑皮层神经元抑制作用和诱导凋亡作用均不显著,对脑内神经组织无明显毒性。
[1]胡 婧,刘松青.羟基喜树碱缓释片的制备以及处方优化研究[J].中国药房,2009,20(22):1731.
[2]杨 帆,陈一岳,林 茵,等.聚乳酸的降解性能及其微球剂的研究[J].中国药房,2002,13(5):263.
[3]Rosanna DT,Vittorio B,Santi S.Biocompatibility and integrin-mediated adhesion of human osteoblasts to poly(DL-lactid-co-glycolide)copolymer[J].European Journal of Pharmaceutical Sciences,2004,21(2):161.
[4]Silva RFM,Falcao AS,Fernandes A,et al.Dissociated primary nerve cell cultures as models for assessment of neurotoxicity[J].Toxicology Letters,2006,163(1):1.
[5]王福庄,丁爱石.新生大鼠海马神经元在无血清培养液中的生长特性[J].细胞生物学杂志,1993,15(2):88.
[6]Isabelle IS,Amy ET,Daniel EV,et al.Toxin-induced resistance in bacillus anthracis lethal toxin-treated macrophages[J].Proceedings of the National Academy of Sciences,2003,100(21):12426.
[7]Darice YW,Scott JH,Paul HK,et al.Poly(e-caprolactone)and poly(L-lactic-co-glycolic acid)degradable polymer sponges attenuate astrocyte response and lesion growth in acute traumatic brain injury[J].Tissue Engineering,2007,13(10):2515.
[8]Suganuma J,Alexander HD.Biological response of intramedullary bone to poly-L-lactic acid[J].J Appl Biomater,1993,4(1):13.
[9]Sung HJ,Meredith C,Johnson C,et al.The effect of scaffold degradation rate on three-dimensionalcell growth and angiogenesis[J].Biomaterials,2004,25(26):5735.

