控制性低中心静脉压在部分肝脏切除术中的应用
项余华,曹志得,李有辉
肝脏部分切除术是治疗原发性和继发性肝脏肿瘤的一种重要方法,在行部分肝脏切除术时,术中极易发生大出血,而出血量及输血量与术后并发症及死亡率有密切关系。控制性低中心静脉压(Controlled Low Central Venous Pressure)技术是近年来用于减少肝脏部分切除术术中出血的一种新方法,2008年1月—2009年5月,我院在肝脏部分切除术中应用该技术30例,现报告如下。
1 资料与方法
1.1 一般资料 本组共者60例,男32例,女28例;年龄22~73岁,平均(49.8±12.6)岁。体重45.5~73.5 kg,平均(48.0±17.8)kg。ASAⅠ~Ⅱ级。均为肝脏占位性病变,行右半肝切除19例,左半肝切除33例,左外叶切除8例。随机分为控制性低中心静脉压组(观察组)和对照组各30例。术前肝功能改良Child分级,A级(良好)55例,B级(减退)5例。并存糖尿病、高血压、凝血功能异常或心、肺、脑疾病者排除在本观察之外。
1.2 麻醉方法 均在静脉复合全麻下手术。行右侧颈内静脉穿刺置管,用于输液和监测CVP,行桡动脉插管连续监测动脉压。麻醉诱导后留置导尿管,监测术中尿量。麻醉诱导:缓慢静注咪达唑仑(0.1mg/kg)、芬太尼(0.005mg/kg)、依托咪酯(0.2mg/kg)、阿曲库铵(0.6~0.8mg/kg)。气管内插管后接麻醉呼吸机,呼吸参数调节到PETCO2在30~35mmHg(1mmHg=0.133kPa)。麻醉维持以吸入异氟烷(浓度1%~2%)、泵注丙泊酚(速度15~30mL/h),并间断静注芬太尼和肌松药阿曲库铵。
1.3 输液及CVP管理 观察组在麻醉诱导前输注乳酸钠林格液,输液量控制在250~500mL,麻醉诱导后采取头低15度倾斜位,至肝实质完全离断前输液量控制为1~2mL/(kg·h),通过控制液体输入量及采用异氟烷复合丙泊酚麻醉在肝实质横断过程中使CVP控制在0~5cmH2O范围。部分病人通过上述方法处理后若CVP仍大于5cmH2O,可用静脉输注少量硝酸甘油降低CVP。在维持CVP过程中监测血压和尿量,当平均动脉压小于60mmHg、病人尿量少于30mL/h,则减少静脉麻醉药或吸入麻醉药用量,同时用100~200mL平衡液冲击治疗。或同时给以少量的多巴胺2~5μg/(kg·min)维持足够的尿量,必要时静注呋噻米5~20mg利尿。在冲击疗法过程中始终维持中心静脉压小于5 mH2O。完全离断肝实质后采用乳酸钠林格液和羟乙基淀粉(130/0.4,万汶)恢复血容量,在肝创面止血完成前将CVP提高至8cmH2O以上。观察组静脉输液按晶胶比2∶1常规进行,晶体为乳酸钠林格液,胶体为万汶或血浆,术中CVP维持在6~12cmH2O之间,平均动脉压维持在60mmHg以上。围术期中以Hct<25%或血红蛋白(Hb)<80g/L时开始输注全血或浓缩红细胞。两组病人术中均未使用止血药。肝血管阻断采用Pringle法,每次阻断时间不超过15~20min,阻断次数不超过2次。
1.4 监测及观察指标 术中常规行中心静脉及桡动脉穿刺。用Drager多功能监护仪连续监测平均动脉压、脉搏氧饱和度(SPO2)、呼气末二氧化碳分压(PETCO2)、ECG及CVP,并观察围术期尿量,手术结束时根据吸引瓶中血量和纱布吸血量之和计算病人术中总出血量,记录两组患者术中总失血量和输血量,围术期输血例数,同时采静脉血测病人术前、术后24 h血浆尿素氮(BUN)、肌酐(Cr)变化。
1.5 统计学处理 应用SPSS 13.0统计软件包进行统计学分析。计量资料以均数±标准差()表示,组间分析采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 两组患者一般情况的比较,见表1,经统计学分析,P>0.05,差异无显著性。
表1 两组患者一般情况比较(,n=30)
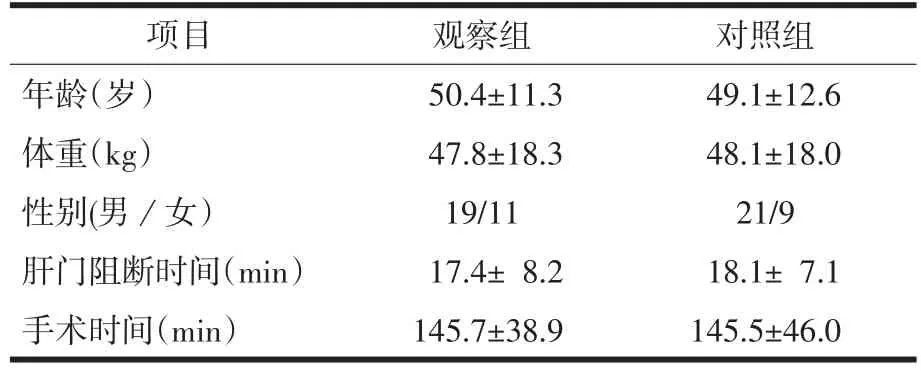
表1 两组患者一般情况比较(,n=30)
项目年龄(岁)体重(kg)性别(男/女)肝门阻断时间(min)手术时间(min)观察组50.4±11.347.8±18.319/1117.4±8.2145.7±38.9对照组49.1±12.648.1±18.021/918.1±7.1145.5±46.0
2.2 两组患者出血量、输血量及尿量 观察组术中出血量及输血量少于对照组,组间比较差异有显著性(P<0.05),两组尿量比较差异无显著性,见表2。
2.3 肾功能变化 两组患者术后24 h BUN及Cr组间比较差异无显著性(P>0.05),见表3。
表2 两组患者术中出血量、输血量及尿量比较(,n=30)
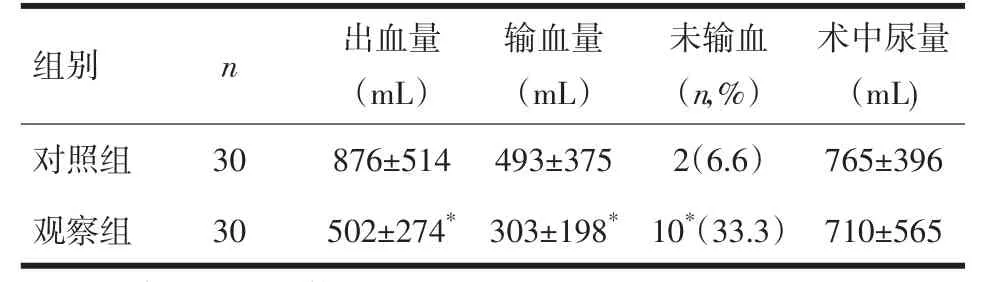
表2 两组患者术中出血量、输血量及尿量比较(,n=30)
注:与对照组比较,﹡P<0.05
组别对照组观察组n 3030出血量(mL)876±514502±274*输血量(mL)493±375303±198*未输血(n,%)2(6.6)10*(33.3)术中尿量(mL)765±396710±565
表3 两组患者术前、后24 h BUN及Cr的变化,n=30)
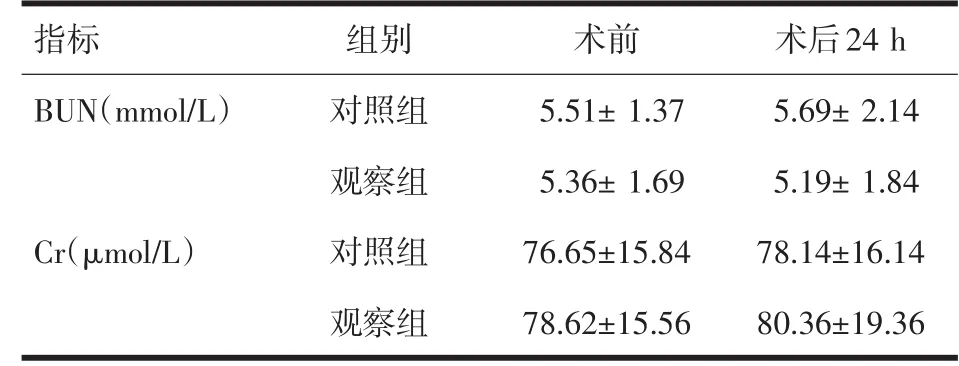
表3 两组患者术前、后24 h BUN及Cr的变化,n=30)
指标BUN(mmol/L)Cr(μmol/L)组别对照组观察组对照组观察组术前5.51±1.375.36±1.6976.65±15.8478.62±15.56术后24 h 5.69±2.145.19±1.8478.14±16.1480.36±19.36
3 讨论
肝脏部分切除术是治疗原发性和继发性肝脏肿瘤的重要方法。由于肝脏内固有的血管分布复杂,肝脏切除手术过程中,易于损伤肝内主要的血管结构特别是肝静脉和下腔静脉,尤其是肿瘤侵及这些重要血管,手术者企图彻底清除肿瘤时,可能面临大出血危险。大出血后输血,又使病人面临大量输血输液的并发症危险。Hnazaki等[1]研究提示,围术期患者输血的多少与患者预后的好坏和肿瘤复发率的高低有密切的关系。国内吕文平等[2]也报道,术中出血量和输血量超过1000mL均为影响肝癌术后长期存活的重要因素。且大量出血影响术野,致使手术者对肝脏的解剖分离和门静脉阻断的时间延长,加重缺血-再灌注肝脏损伤机会与可能性。因此在肝脏部分切除术中,任何可以减少失血量的方法对病人和手术者都是有帮助的。
近年来,由于外科技术进步,外科医师采用了许多方法来减少肝脏手术出血,如延长静脉阻断时间、肝外血管隔离术、门静脉钳夹等,这些方法使肝脏手术失血量大为减少,但对一些难度较大的肝脏手术,如在进行操作困难、易损伤肝静脉的肝段或肝叶切除时(如第Ⅶ、Ⅷ段手术),出血量仍然很多。因此有必要寻找一种安全、有效,可以重复应用的技术来减少肝脏切除术中巨大的失血量。
控制性低中心静脉压可明显降低病人术中出血量,其理论依据为,肝窦内的压力受肝静脉内的压力影响,而肝静脉内的压力与CVP又有直接的联系。因此,当中心静脉压下降时,可以使肝窦内的压力和肝静脉内的压力降低,从而使血管壁内外的压力梯度减少,最终使肝脏切除术中横断肝实质时的出血量减少。同时控制性低中心静脉压可使腔静脉及其分支静脉塌陷,有利于肝脏的游离和缩短手术时间,也使出血量大为减少。依据泊肃叶层流公式得知,肝部分切除时,肝脏静脉血管损伤引起的出血量与血管壁的压差和血管半径的4次方成正比(Q=△pr4),降低病人中心静脉压力,不仅能使血管壁的内外压差降低,同时也缩小了血管半径,因而能明显降低病人术中出血量。而单纯采用控制性降压,不限制液体入量,只能降低血管壁的压差(△p),相反在保持CVP不变时血管半径加大,起不到减少出血量的作用。
本研究通过观察组与对照组进行比较也表明,CLCVP可明显降低病人术中的出血量与输血量。国外也有研究证实,LCVP可减少肝脏切除术中的失血量。Moug等[3]术中采用LCVP技术,控制液体输注,结果50例患者平均失血量不到330mL。Smyrniotis等[4]研究表明,用Pringle法阻断肝血流时,CVP≤5mmHg或≥6mmHg时 (1mmHg≈1.36cmH2O),平均出血量分别为780mL和1250mL。还有人提出,该项麻醉技术不仅有助于减少肝脏手术的失血量及死亡率,还能保护肾功能。本研究CLCVP组术中出血量较少,输血例数及输血量均显著少于对照组,与以上报道相符。
肾功能损害是肝脏切除手术后出现的一个常见并发症。本研究中两组病人术后均未出现显著的肾功能损害,可能与术中注意保护肾功能有关。将CVP控制在不超过4cmH2O,平均动脉压(MAP)在60mmHg,每小时尿量至少25mL和肝切除后立即扩容,术中给予多巴胺2~5 μg/(kg·min),保证了肾功能的良好。头低脚高位便于手术操作,同时有利于下肢静脉血回流维持血流动力学稳定,动物实验证明,头低脚高位能增加肾小球滤过率和血浆心钠素的浓度,对肾功能具有保护作用。
综上所述,CLCVP可减少肝部分切除术的出血量,从而减少输血量,避免输血带来的不良反应。同时减少围术期并发症,降低病人死亡率,延长肿瘤复发时间,且对肾功能的影响较小。此外,还可净化手术野,便于手术者操作,从而提高手术成功率。此项技术简单易行,具有较高的临床应用价值。
[1]Hanazaki K,Kajikawa S,Shimozawa N,et al.Perioperative blood transfusion and survival following curative hepatic rescection for hepatocellular carcinoma[J].Hepatogastroentero logy,2005,52(62):524.
[2]吕文平,董家鸿,黄志强,等.肝切除手术相关因素对肝细胞癌预后的影响[J].解放军医学杂志,2007,32(7):691.
[3]Moug SJ,Smith D,Wilson IS,et al.The renal sequelae of anovel triphasicapp roach to blood loss reduction during hepatic resection[J].Eur J Surg Oncol,2006,32(4):435.
[4]Smyrniotis V,Kostopanagiotou G,Theodoraki K,et al.The role of central venous pressure and type of vascular control in blood loss during major liver resections[J].Am J Surg,2004,187(3):398.

