食管癌引流区淋巴结细胞裸鼠体内抑瘤实验
国建飞,杨立伟,高志明,何 明,白世祥,施 靖
肿瘤的细胞过继免疫治疗日益受到重视。成熟的树突状细胞 (dendritic cell,DC)是体内功能最强的、最有效的抗原递呈细胞。肿瘤引流区淋巴结 (tumor-draining lymph node,TDLN)含有丰富的淋巴细胞,由于其特殊的位置,又含有较多的已摄取肿瘤抗原的树突状细胞,TDLN可以成为一种较好获得的对肿瘤细胞有很强杀伤作用的淋巴细胞潜在来源。本研究通过建立人食管癌裸鼠模型,探索 TDLN在体内对食管癌细胞的杀伤作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级 BALB/C裸鼠 30只,3~4周龄,体质量 14~17 g,雄性,购于中国医学科学院动物中心,实验动物质量合格证明号是 48678。饲养室内恒温、恒湿,定期紫外线照射,鼠笼、垫料、饮水、饲料均高压消毒。
1.1.2 肿瘤标本 取自河北医科大学第四医院胸二科食管中段癌手术患者,男性,65岁。临床病理分期:T3N1M0,中分化鳞状细胞癌。术前未行放、化疗。
1.1.3 TDLN细胞 术中取同一患者 TDLN制成细胞悬液培养7 d获得。
1.2 方法
1.2.1 TDLN细胞的培养和食管癌细胞抗原的制备 手术时无菌摘取2~3个无明显转移的淋巴结,用 D-Hank′s液冲洗并去除结缔组织和脂肪组织后,剪成 1mm3大小的组织碎片,200目钢网过滤,悬于 30m lRPMI1640培养基。将 TDLN细胞分为 3组进行培养,TDLN-Ⅰ组培养基中添加 IL-2,TDLN-Ⅱ组添加 IL-2+IL-4+粒 -单核细胞集落刺激因子 (GM-CSF),TDLN-Ⅲ组添加 IL-2+IL-4+GM-CSF+自身食管癌细胞抗原 (tAg),置于 37℃,5%二氧化碳 (CO2)培养箱培养,具体方法参见文献 [1]。
1.2.2 人食管癌裸鼠移植瘤模型的建立 手术时无菌切取部分食管癌组织块,用 0.9%氯化钠注射液冲洗后切成近 1 mm3大小,植入裸鼠腋背部皮下,具体方法参照文献 [2]。
1.2.3 动物模型的分组及处理 依移植瘤体积大小编号,采用随机数字表法将动物模型分成 5组:空白对照组、IL-2组、TDLN-Ⅰ组、TDLN-Ⅱ组、TDLN-Ⅲ组,每组 6只裸鼠。1周后治疗 (瘤体大约 30 mm3,淋巴结细胞进入对数生长期):空白对照组每只裸鼠局部注射 0.9%氯化钠注射液 0.2 ml;IL-2组每只裸鼠局部注射 1 000 U/ml的 IL-2 0.2 ml;TDLN-Ⅰ组、TDLN-Ⅱ组、TDLN-Ⅲ组每只裸鼠局部注射效应细胞 (TDLN细胞)2×107/ml0.2ml以及 1 000 U/ml的IL-2 0.2 ml。以后,空白对照组裸鼠每周局部注射 0.9%氯化钠注射液 0.2 ml,其他各组裸鼠每 3 d局部注射 1次 IL-2 0.2 ml(1 000 U/m l)。每周用游标卡尺测量并记录肿瘤长径(a)、短径 (b),按体积 (V)=πab2/6计算肿瘤体积。根据肿瘤体积的变化描绘各组的肿瘤生长曲线,并计算抑瘤率,抑瘤率 (%)=〔1-(实验组结束瘤体积 -实验组开始瘤体积)/(空白对照组结束瘤体积 -空白对照组开始瘤体积)〕×100%。5周后脱颈处死裸鼠取出移植瘤标本。
1.2.4 流式细胞仪检测移植瘤的肿瘤细胞凋亡率 将瘤块用70%的乙醇固定,制成单细胞悬液,采用流式细胞仪检测肿瘤细胞凋亡率。具体方法按说明书进行。
1.3 统计学方法 采用 SPSS 16.0统计软件进行统计分析。计量资料以±s)表示;各组间是否有统计学差异采用General Linear Model中 Repeated Measures进行统计检验;如有统计学差异,每周各组间采用 One-way ANOVA进行统计。P<0.05为差异有统计学意义。
2 结果
2.1 本组 30只裸鼠食管癌移植瘤成活率为 100%。
2.2 裸鼠移植瘤体积变化 General Linear Model分析显示,实验的不同时间 5组裸鼠移植瘤体积变化间差异有统计学意义(F=30.020,P<0.01);且实验进行 3、4、5周时,TDLN-Ⅰ组、TDLN-Ⅱ组和 TDLN-Ⅲ组裸鼠移植瘤体积与空白对照组及 IL-2组比较,差异均有统计学意义 (P<0.01);实验进行 3周及 5周时,TDLN-Ⅲ组裸鼠移植瘤体积较 TDLN-Ⅰ组显著降低,差异有统计学意义 (P<0.05,见表 1)。
2.3 各组裸鼠的抑瘤率 TDLN各组裸鼠的肿瘤抑瘤率大于IL-2组,且 TDLN-Ⅲ组抑瘤率最高 (见表 2)。
2.4 各组肿瘤细胞凋亡率比较 空白对照组、IL-2组、TDLN-Ⅰ组、TDLN-Ⅱ组、TDLN-Ⅲ组肿瘤细胞凋亡率分别为 (7.1±3.0)%、 (12.4±1.2)%、 (27.6±2.0)%、(33.1±4.5)%和 (39.1±1.5)%,组间差异有统计学意义(F=153.314,P<0.01);且各组肿瘤细胞凋亡率间两两比较,差异均有统计学意义 (P<0.05)。
表 1 实验的不同时间 5组裸鼠移植瘤体积变化 (±s,mm3)Table 1 The transplantation tumor volume of five groups from week 1 to week 5
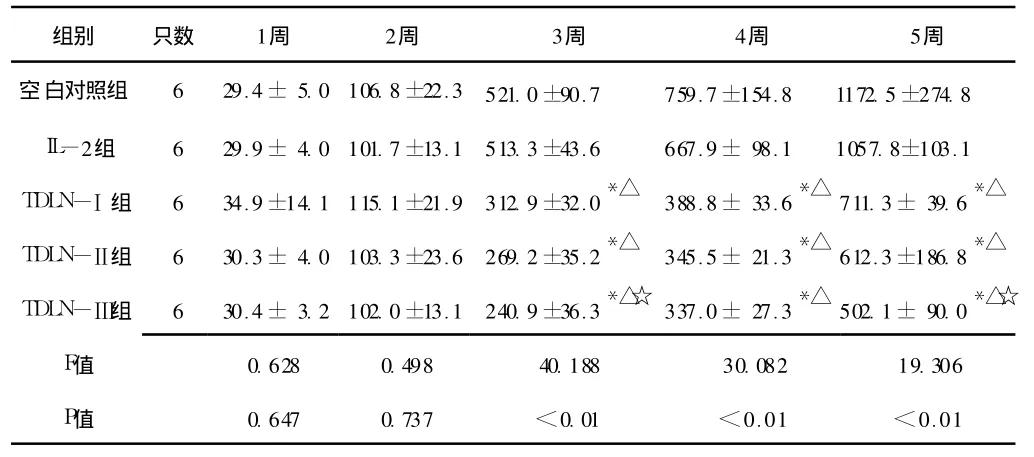
表 1 实验的不同时间 5组裸鼠移植瘤体积变化 (±s,mm3)Table 1 The transplantation tumor volume of five groups from week 1 to week 5
注:与空白对照组比较,*P<0.01;与 IL-2组比较,△P<0.01;与TDLN-Ⅰ组比较,☆P<0.05
组别 只数 1周 2周 3周 4周 5周空白对照组 6 29.4± 5.0 106.8±22.3 521.0±90.7 759.7±154.8 1172.5±274.8 IL-2组 6 29.9± 4.0 101.7±13.1 513.3±43.6 667.9± 98.1 1057.8±103.1 TDLN-Ⅰ组 6 34.9±14.1 115.1±21.9 312.9±32.0*△ 388.8± 33.6*△ 711.3± 39.6*△TDLN-Ⅱ组 6 30.3± 4.0 103.3±23.6 269.2±35.2*△ 345.5± 21.3*△ 612.3±186.8*△TDLN-Ⅲ组 6 30.4± 3.2 102.0±13.1 240.9±36.3*△☆ 337.0± 27.3*△ 502.1± 90.0*△☆F值.306 P值 0.647 0.737 <0.01 <0.01 <0.01 0.628 0.498 40.188 30.082 19
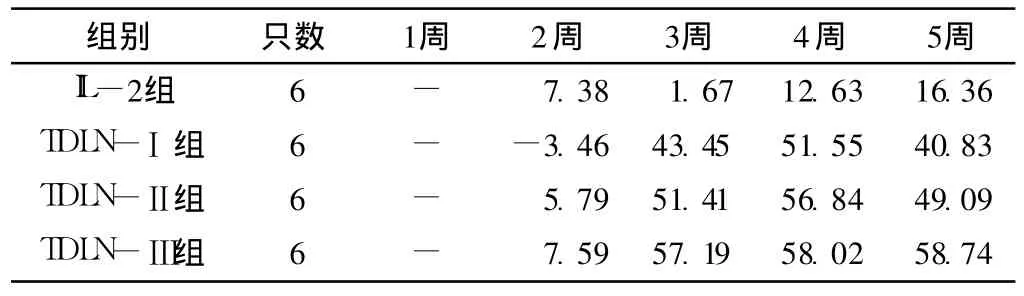
表 2 各组裸鼠抑瘤率(%)Table 2 Inhibition ratio of transplantation tumor of four groups
3 讨论
TDLN细胞含有丰富的淋巴细胞和树突状细胞,由于其特殊的位置,淋巴细胞受到树突状细胞递呈的肿瘤抗原致敏,对肿瘤细胞具有特异性杀伤作用[3]。但在患者体内,肿瘤细胞通过免疫抑制和免疫逃逸机制[4],致使肿瘤抗原不能得到有效的提呈,T淋巴细胞介导的免疫应答不能被有效激活[5]。
本实验采取体外培养 TDLN细胞的方法,消除免疫抑制性细胞因子的影响,使树突状细胞能够有效地递呈抗原,T淋巴细胞能够被有效地激活,主要通过 CD+8T细胞的分泌型杀伤作用和非分泌型杀伤作用杀伤肿瘤细胞。另外,TDLN细胞中的CD+56细胞对肿瘤细胞具有非特异性杀伤作用。
TDLN细胞容易获得,手术时摘取即可,不需要从外周血或肿瘤组织中提取,而且 TDLN内淋巴细胞含量丰富,经培养完全能达到临床使用的数量,不像淋巴因子激活的杀伤细胞(LAK细胞)和肿瘤浸润淋巴细胞 (TIL)提取获得的增殖细胞数量较少,同时它还含有较多的已摄取肿瘤抗原的树突状细胞及少量自然杀伤细胞 (NK细胞)等。食管癌 TDLN细胞经体外培养后可以得到大量 T细胞和成熟树突状细胞,IL-2是淋巴细胞体外增殖的必备条件[6],在培养基中添加 GM-CSF和 IL-4能得到更多的成熟树突状细胞[6-7]。有人认为自体肿瘤抗原致敏的树突状细胞,和 TDLN细胞共同培养后,具有更强的杀伤作用[8]。本实验结果显示,TDLN-Ⅲ组与 TDLN-Ⅱ组裸鼠移植瘤体积以及抑瘤率间无显著差异,说明 TDLN中的树突状细胞已获取肿瘤抗原,无需再次致敏,体外培养完全可以使其恢复活性。
本研究结果还显示,TDLN-Ⅰ、Ⅱ、Ⅲ组肿瘤细胞凋亡率均显著高于 IL-2组和空白对照组,表明 TDLN细胞可促进食管癌细胞凋亡,其中 TDLN-Ⅲ组肿瘤细胞凋亡率最高,TDLN-Ⅱ组次之,TDLN-Ⅰ组最低,表明经自身肿瘤抗原刺激后,TDLN细胞具有更强的促进肿瘤细胞凋亡的作用。
综上所述,TDLN细胞在体外培养后回输体内可以获得有效杀伤肿瘤细胞的作用;TDLN细胞能诱导肿瘤细胞凋亡。TDLN细胞由个体肿瘤直接致敏,具有特异性,培养 TDLN细胞回输人体有可能作为一种有效的个体化抗肿瘤免疫治疗新方法。但 TDLN细胞是通过何种途径诱导肿瘤细胞凋亡的,尚待进一步研究。
1 李启亮,单保恩,张超,等.不同刺激剂诱导肺癌患者引流淋巴结细胞分泌细胞因子的研究 [J].细胞与分子免疫学杂志,2006,22(5):609-612.
2 何明,单报恩,李启亮,等.肺癌淋巴结细胞培养及体内外的杀伤作用 [J].中华实验外科杂志,2006,23(3):359-361.
3 Carriere V,Coliddon R,Jiguet-Jiglaire C,et al.Cancer cells regulate lymphocyte recruitment and leukocyte-endothelium interactions in the tumor-draining lymph node[J].Cancer Res,2005,65(24):11639-11648.
4 Kacani L,Wurm M,Schennach H,et al.Immuno-suppressive effects ofsoluble factorssecreted by head and neck squamous cell carcinoma on dendritic cells and T lymphocytes[J].Oral Oncol,2003,39(7):672-679.
5 Cohen PA,Peng L,Kjaergaard J,et al.T-cell adoptive therapy of tumors:mechanisms of improved therapeutic performance[J].Crit Rev Immunol,2001,21(13):215-248.
6 金鹰,唐玫,李国明 .实用淋巴细胞培养技术 [J].激光生物学报,2000,9(3):75-78.
7 李秋平.细胞因子与树突状细胞分化诱导 [J].外医学肿瘤学分册,2004,31(10):742-744.
8 Sabel MS,Arora A,Su G,et al.Adoptive immunotherapy of breast cancer with lymph node cells primed by cryoablation of theprimary tumor[J].Cryobiology,2006,53(3):360-366.

