不同进气模式下平板式多孔介质电极SOFC的重整性能分析
于建国,王玉璋,惠宇,翁史烈
(上海交通大学机械与动力工程学院,上海200240)
SOFC是一种高温型燃料电池,运行温度为700~1000℃,非常适合对一些常见的气体燃料进行内部重整[1];富含H2/CO的燃料气体,例如一氧化碳、天然气、液化石油气、煤气、生物质气体或者其他的石油衍生物通过在阳极的催化加热蒸汽重整(HSR)或者部分氧化(POX),可以得到电池反应需要的氢气,其中催化加热蒸汽重整工艺具有较高的热效率。甲烷的蒸汽重整是一个十分复杂的过程,反应物和生成物各种组分不仅在主流和催化剂表面发生传热和传质,而且在多孔介质催化剂内也有传热和传质,同时重整还涉及同步并行或串行进行的多个化学反应[2]。甲烷的内部蒸汽重整也会带来一些问题,特别是阳极上的碳沉积,可能导致活性点的损失、电池性能下降和耐久性降低,为了降低碳形成率很多学者已经做了大量工作,例如通过提高蒸汽/甲烷比(S/C)和在阳极内添加一些添加物(如钼、二氧化铈、钾等)[3]等。另外,内部重整还会导致电池阳极温度分布的不均匀,引起较大的热应力。本文作者已开发了可以应用于高温平板式SOFC电池的结构和流动、电化学、电流场分析的模型,采用该模型在以氢气为燃料的情况下进行计算分析,结果和实验吻合很好[4]。作者还采用了试验的方法研究了SOFC电池Ni-YSZ(镍基的氧化钇稳定氧化锆)多孔介质阳极材料上甲烷蒸汽的重整性能[5],并利用试验结果建立了阳极上甲烷重整过程的动力学模型[6]。本文将在上述工作的基础上,进一步利用CFD软件建立SOFC多孔介质阳极上甲烷重整的动力学模型,并利用模型分析在逆流或者顺流进气模式下SOFC单电池内重整的性能,包括温度、化学组分、局部过电势、电势、电流密度等参数空间分布;这些结果应当可以为下一步新的直接内部重整SOFC单电池结构和阳极设计提供依据。
1 计算模型
平板式SOFC电池堆的运行,可以认为电池堆中大多数的单电池所处工况相同,因此分析单电池的运行可以评估整个电池堆的性能。
1.1 物理模型
图1为该平板式多孔介质电极固体氧化物燃料电池(PES-SOFC)的单电池三维几何模型,模型的几何参数见表1;该电池的电极和电解质材料由合作单位日本中央电力研究所制备,电池各部件的性能见表2[7]。

图1 平板式PES-SOFC三维计算几何模型

表1 单电池的几何尺寸 mm
阳极、阴极和电解质离子的电阻率与温度有关。
阳极电阻率:2.98×10-5
阴极电阻率:8.11×10-5
电解质离子阻率:2.94×10-5

表2 电池各部件性能
1.2 流动和传热传质模型
SOFC内的流体包括在阴极中的氧气和氮气以及阳极中的氢气、甲烷、一氧化碳、二氧化碳和水蒸气等,并且多组分的流动和传热传质相互耦合。该数学模型的基本控制方程组可以采用三维N-S方程组,湍流采用 k-ε模型,假定孔隙率和渗透性恒定,可以利用N-S方程和Darcy定律来计算多孔介质内气体的流动[4,6]。通常,多孔介质中的扩散可以通过努森扩散和分子扩散来描述,如果多孔介质的孔径小于气体分子的平均自由程(即努森数K n远大于1)那么只需要考虑努森扩散,如果孔径大于气体分子的平均自由程(即K n远小于1)只需要考虑分子扩散,但是对于SOFC来说,多孔介质中的扩散的努森数在1左右,因此必须同时考虑努森扩散和分子扩散;由于孔的曲折性和收缩性,扩散系数要还要用曲折因子和多孔介质的孔隙率进行修正。这样,SOFC多孔介质中的气体i有效扩散系数为:
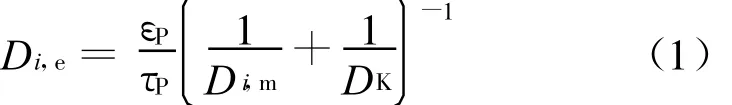
式中:τP为曲折因子;εP为多孔介质的孔隙率;Di,m为组分i在混合气体中分子扩散系数;D K为努森扩散系数[7]。
多孔电极内的有效热传导率λ,采用流体和固体热传导率的体积平均值:

式中:λg是气体混合物的热导率[8];λs是等方向的固体热传导率。
另外气体在多孔介质中流动有较大的流体阻力,在模型中该流动阻力以体积力形式作为动量方程的源项。
1.3 电化学模型
在阴极和电解质的三相界面上的电化学反应为:

氧离子穿过电解质到达阳极,在阳极和电解质三相界面上的电化学反应为:

氢气在氧化时产生的电动势E TPB是一个当地量,大小取决于当地的气体组分和温度,可以通过Nernst方程来计算[4,8]。另外,CO的转换反应速度很快,可以把转换反应产生的H2的电动势作为CO产生的电动势,因此只需要计算H 2的产生电动势。

式中:ΔG为吉布斯自由能差;F为法拉第常数, 96487 C/mo l;Pi,TPB为标准压力下电极/电解质三相界面处组分i的分压比(i为H 2,O2,H2O)。
多孔电极内气体组分扩散率会影响电化学反应的速度,特别是在燃料利用率U f≥80%时,高电流密度和低燃料浓度的工况会引起很大浓度极化损失。随着燃料和空气流体中气体组分的消耗和生成,电化学反应的产物及其浓度将在阳极和阴极通道内发生变化。式(5)中的气体各组分的分压力采用电极/电解质三相界面的压力,因此计算的Nernst电动势包括了组分扩散的极化损失,即该电动势就是当地电动势,从而可以得到电解质层的当地电流i为:

式中:ηact为电化学反应极化损失;U a和U c分别为阳极和阴极三相界面处的电势;R ohm为电阻。
1.4 活化损失
SOFC运行时阴极和阳极上会产生活化极化损失,在较高的工作温度下由于电极反应迅速活化能损失通常比较小,但当工作温度降低后活化能损失就会迅速变大,成为影响电压下降的主因,是进行电化学反应必须要克服的能量损失。活化损失通常由B-V方程来求解:


式中:j为电流密度;n e为电子数;α为电子传导系数;j a和j c分别是阳极、阴极交换电流密度,ηact为活化极化损失;pRef为参考压力;pi为组分i当地分压力。
B-V方程为非线性方程,本文利用 New ton-Raphson迭代方法求解,精度1.0×10-6。
1.5 欧姆损失
欧姆损失是由离子在电解质内和电子在电极内的传导阻抗,以及电池组件的接触面的阻抗引起的,欧姆损失引起的电压降正比于电流密度:
电解质和电极的欧姆电阻:

式中:R ohm1,R ohm2和R ohm3分别是电解质、电极的电阻和组件接触面的电阻;ρi是电解质或者电极材料的电阻率(i=1,2),与温度相关;δ为材料厚度;A为材料横截面积。
由于SOFC的电解质层非常薄,沿厚度方向的电阻远小于其他方向,因此电解质层的电流可以认为仅仅沿厚度方向流动,但是阴极和阳极中的电流可以沿三维流动。根据基尔霍夫电流定律,在电极的每个计算体中的电压和电流有如下关系:
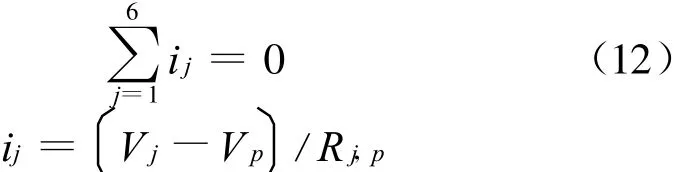
式中:Rj,p当前计算单元p与相邻单元j间的电阻,在x,y和z方向上与p相邻的单元共有6个。
为了简化计算,规定与阳极连接的连接体外表面的电势为零,这样与阴极连接的连接体外表面的电势就是电池的输出电压。本文通过设定平均电流密度和电池反应面积来给定电池的输出电流,通过电流、电阻以及电势差的关系,得到了所有的局部电动势后,进而的得到了输出电流和输出电压。
1.6 蒸汽重组反应和动力模型
甲烷经过蒸汽重整生成氢气、一氧化碳、二氧化碳和碳的总体反应各方程式列于表3[1,9]。实际上, CO2重整(反应4和5)是甲烷蒸汽重整反应(反应1和3)和水转换反应(反应2)的线性拟合。根据反应动力学分析,反应4,5和反应9,10,11都很慢[1]。甲烷裂解(反应6)、Boudard反应(反应7)和反应8是最有可能导致碳沉积和沉积碳的气化的反应。

表3 甲烷水蒸气重整反应方程式
Xu和Forment为镍基催化剂的甲烷蒸汽重整建立了广义的Langmuir-Hinshelwood式动力学模型,被公认为是目前最可信的通用模型[9-11],然而该模型是建立在假设气体的所有分子都被在催化剂表面捕获的基础上的,在多孔阳极中传热传质和组分扩散的应用中明显受到限制,特别是不同的制造工艺会使多孔阳极使中只有一部分催化剂参与重整过程。在Xu和Forment动力学模型基础上,通过实验和数值分析建立的甲烷蒸汽重整有效动力学模型为[11,12]:

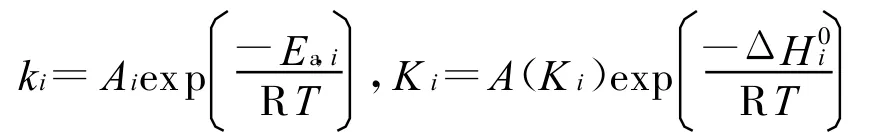
式中:Ce为多孔介质阳极催化剂的线性有效系数;ki为组分i的反应速度常量;K i为组分i的吸收常数;E a,i为组分i的反应活化能。
2 计算结果和讨论
本文分别在顺流和逆流情况下分析了对该类型PES-SOFC单电池的性能,计算采用的工况为:电极中气体压力1.013 Pa,空气和甲烷的入口温度1273.15 K,入口空气流率1000.0 m L/m in,入口甲烷流率40.0m L/m in,比3.5,电化学反应面积3.6×10-3m2。由于平板式SOFC单电池工作在相同的工作条件下,两个连接体的外表面指定为周期性边界条件。在计算中,单电池进出口分别给出4 mm延伸段。
2.1 电流密度对电池的影响
图2给出了不同电流密度下电池输出电压和功率密度的计算结果。可以看出在计算工况下,逆流时,电池的电压和功率密度较高;电池输出电压随着电流密度的增长而降低,功率密度随着电流密度的增加先增加后降低。采用逆流,在电流密度大约为4000 A/m2时功率密度达到峰值0.23W/cm2(顺流为0.22W/cm2),此时电池输出电压为0.568 V (顺流为0.547 V)。
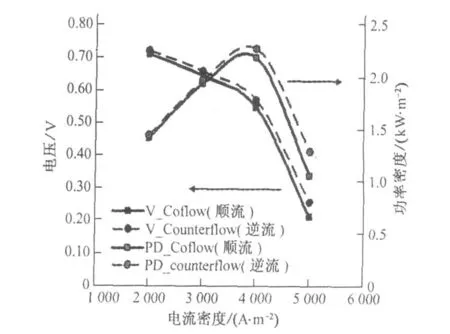
图2 电池电压和功率密度随电流密度的变化
在进口燃料流量相同时,流道中最高、最低温度和出口气体温度随着电流密度的计算结果见图3。可以看到这些温度都随着电流密度的增加而增加,这是因为电化学反应放出更多的热量;与此同时流道中的最高和最低温度的温差也增加,这就意味着较高的电流密度会加剧电池内部温度分布的不均匀性,从而在电池内引起更大的热应力。从图中还可以看到,尽管在所有计算工况下最低温度小于或接近于入口气体温度,而且在顺流时气和燃料的出口温度几乎相同,燃料出口温度也仅仅略有提高,但是在逆流时空气和燃料的出口温度不同,特别是燃料的出口温度提高较多。而在低电流密度时,空气和燃料出口温度低于入口温度,这也意味着从电化学反应放出的热量比甲烷重整反应需要的热量少,需要外界提供额外的热量;在顺流时当电流密度为2500 A/m2时,气体出口温度等于入口温度,然而逆流时约为3200 A/m2。

图3 电池中最高、最低温度和出口气体温度
2.2 定电流密度时各参数的空间分布
模型的计算把通过电解质层的平均电流密度设定为4000 A/m2,然后对SOFC内部的温度、气体组分、局部电势和电流密度空间分布规律进行分析。分析中的切面,是指多孔电极管道中心线切面。
(1)温度分布 PES-SOFC电池内多孔电极中切面上温度分布的计算结果如图4。由图中可见,由于在阳极流道内的甲烷重整反应需要吸收大量热量,因此通入的高温气体首先被冷却。不过由于阳极中的气体流量较少,气体的流速本来就非常低,特别在多孔介质区域内的巨大阻力下气体的流速更低,气体流动对温度的影响较小;与气体相比多孔电极中的固体热传导率较大,因此多孔阳极中的温度分布主要取决于固体热传导。但是阴极内空气流量较大,在管道中气体温度要低于附近多孔介质区域的温度。电池各部件材料不同,热传导率也不同,因此在各个电池组件的接触面上有较大的温梯度,顺流时高温点出现在近电解质的阳极出口处,而逆流时高温点位置不固定,取决于电池的结构和工作条件。
(2)化学组分分布 电极内各气体组分的摩尔分数分布模拟结果见图5。可以看出,随着电化学反应的进行,电极内气体的氧气摩尔分数与空气流动方向有关。由图中等值线分布也可以看出,在空气主流和阴极/电解质接触面之间的氧气摩尔分数差异较大;多孔阳极的进口处燃料气温度较高而且没有氢气,催化剂活性较高,因此甲烷蒸汽的重整反应非常快,氢气摩尔分数急剧增长,然后随着氢气在阳极/电解质接触面电化学反应的消耗而下降。从图中还可以看到:水蒸气的摩尔分数从进口到出口先下降然后逐渐上升;从阳极/电解质接触面到阳极/连接体接触面,氢气和水蒸气的摩尔分数先是剧烈变化,然后相对平坦变化;一氧化碳的摩尔分数随着甲烷重整反应进行在某个位置达到最大值,然后因为电化学反应进行其摩尔分数开始逐渐降低;二氧化碳的摩尔分数从进口到出口逐渐增大。

图4 多孔电极切面中的温度分布
(3)电流场分布 图6所示为流动方向中间横切面的电势分布的模拟结果。由于计算中假定连接于阳极的连接体外表面电势为零,因此阳极中的电势都为负值,并从连接体外表面到阳极/电解质三相界面处电势逐渐降低,在界面处电势的负值最大,而阳极材料的电导率高电势绝对值相对很小,因此阳极中的欧姆过电势也较小。从图中可看到:阴极中的电势为正值,并从阴极/电解质三相界面处到连接体外表面逐渐降低,在连接阴极的连接体外表面电势是输出电压;多孔电极两个管道之间的区域,电流通过面积相对较小,这就导致了更致密的等值线,电压降较大。从图中还可以看出,阴极的欧姆过电势要大于阳极欧姆过电势;在多孔电极的管道内没有固体导电介质,因此这些区域没有电流流过,电势为零。
电解质的电流密度分布的模拟结果如图7,可以看到,电流密度分布受到了温度、组分浓度、活化过电势等因素的影响。随着甲烷蒸汽重整反应和电化学反应的进行,从电池的入口到出口重整气温度先降后升,由于电解质的离子阻抗随温度上升而增加,还导致离子阻抗先增后降。由于多孔阴极的管道和多孔介质区域换热能力不同,电解质上的温度沿着x轴有所波动,电解质的离子阻抗也随着x轴有波动,因此电解质板上电流密度随x轴波动。同时可以看出,在进气情况为顺流和逆流的情况下,该结构类型燃料电池在电解质面电流密度分布相似,且数值上也相差不大,这和图2中显示两种流动方式下电池输出电压和输出功率相近相吻合。
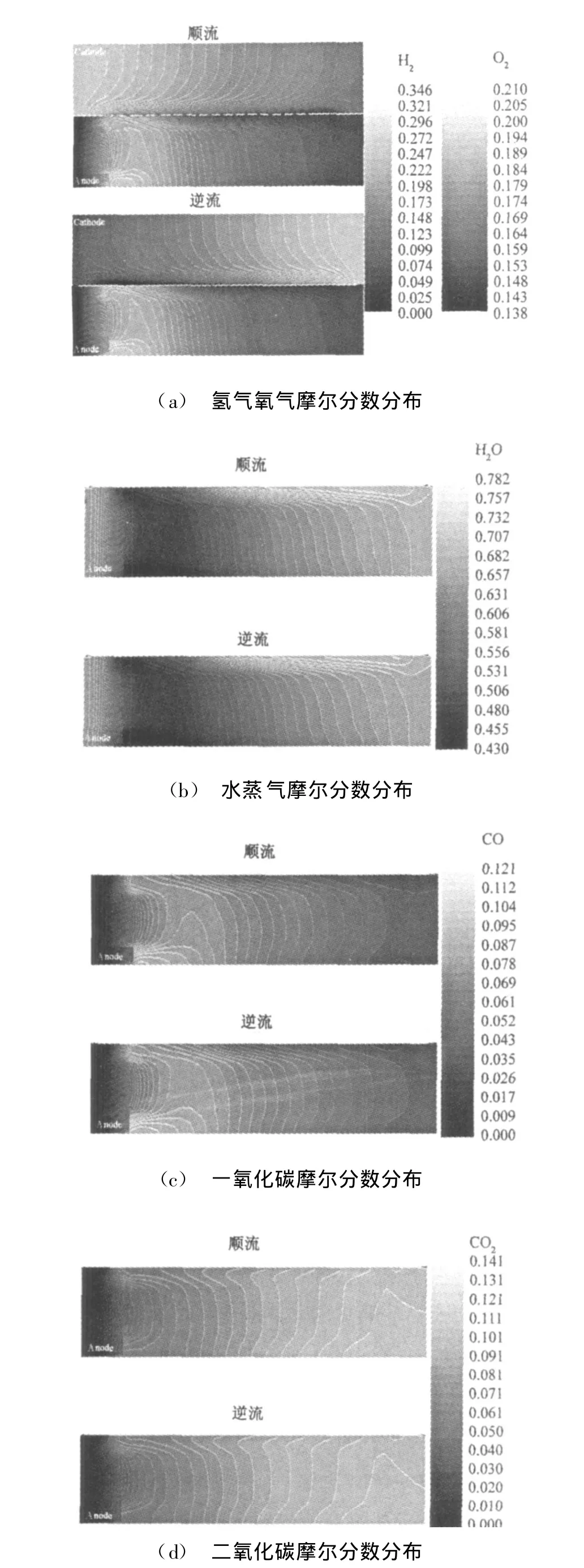
图5 电极通道中化学组分的摩尔分数

图6 电势分布
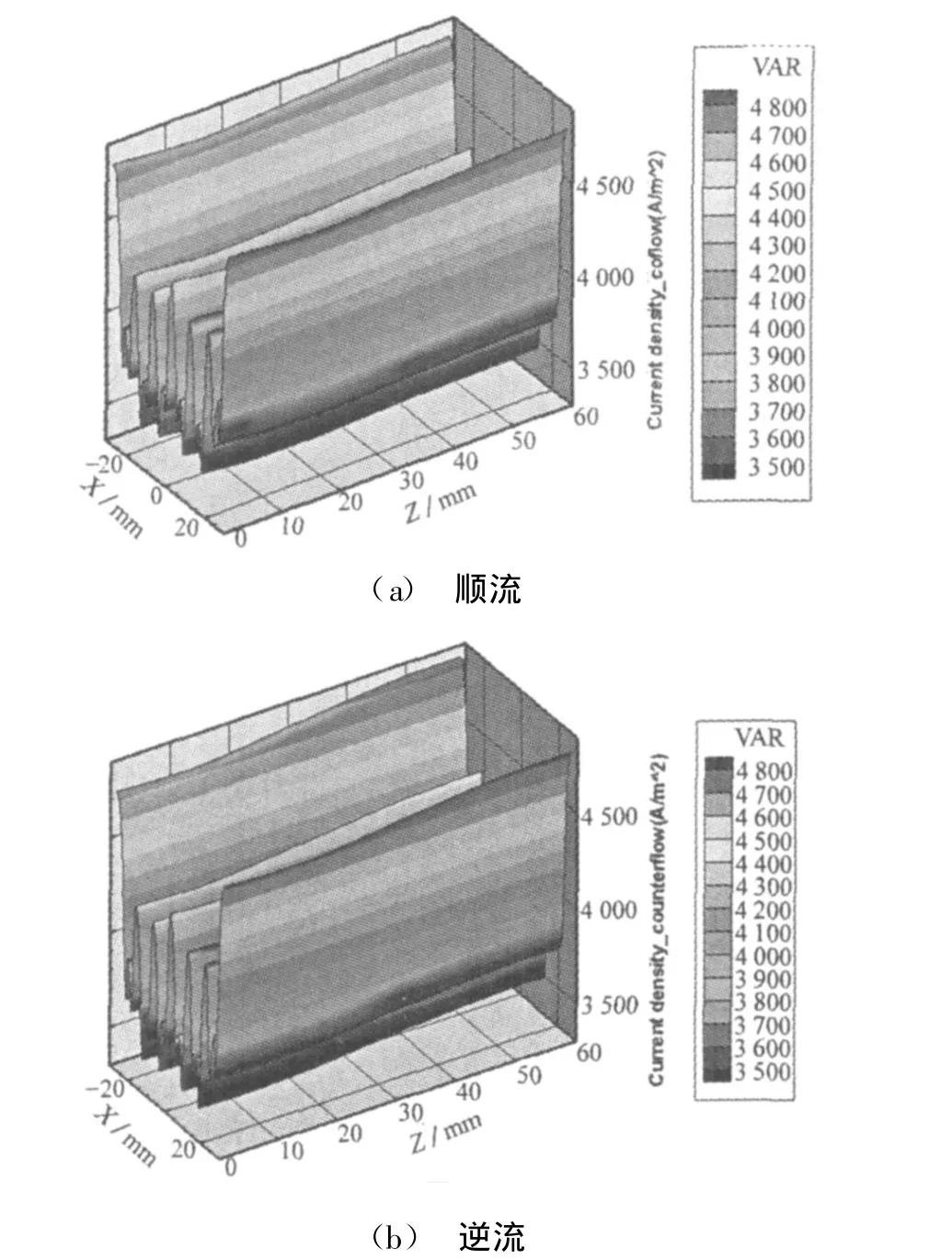
图7 通过电解质的电流密度分布
3 结论
本文采用已开发的SOFC单电池结构,建立了多孔介质阳极上甲烷重整的有效动力学模型,利用模型分析了该SOFC单电池内重整的过程,得到了不同进气模式逆流和顺流下的温度、各化学组分、局部过电势、电势、电流密度等参数空间分布,根据分布情况可以得到如下结论。
(1)在相同工作条件下,逆流时单电池输出电压和功率密度略高于顺流工况,顺流时电池内高温点位于近电解质的阳极出口处,相对来说,逆流时电池中有较高温度的高温点,而且热点位置不确定。
(2)由于重整反应吸收大量热量,在电池进口处有较大的低温区域;气体温度从进口到出口先降低后增加。
(3)电解质板上电流密度随x轴波动,但顺流和逆流时,电解质板上电流密度分布相似。
[1] CLARKE SH,D ICKS A L,POINTON K,etal.Catalytic aspects of the steam reform ing of hydrocarbons in internal reform ing fuel cells[J].Catal Today,1997, 38(4):411-423.
[2] HOU K,HUGHESR.The kinetics ofmethane steam reform ing over a N i/α-A l2O catalyst[J].Chem Eng J, 2001,82(1/3):311-328.
[3] SANGTONGK ITCHAROENW, ASSABUM RUNGRA T S,PAVARAJARN V,et al.Comparison of carbon formation boundary in differentmodes of solid oxide fuel cells fueled by methane[J].J Pow er Sources,2005,142(1/2):75-80.
[4] WANG Y Z,YOSHIBA F,WaTANABE T,et al. Numerical analysis o f electrochem ical characteristics and heat/species transport for p lanar porous-electrode-supported SOFC[J].Jof Pow er Sources,2007, 170(1):101-110.
[5] 王玉璋,惠宇,于建国,等.平板式SOFC的Ni/YSZ阳极上甲烷重整过程实验研究[J].中国电机工程学报, 2009,29(14):104-108.
[6] WANG Y Z,YOSH IBA F,KAWASE M,et al.Performance and effective kineticmodels ofmethane steam reforming over N i/YSZ anode of p lanar SOFC[J].Int J of Hydrogen Energy,2009,34(9)3885-93.
[7] TODD B,YOUNG J B.Thermodynamic and transport p roperties of gases for use in so lid oxide fuelmodeling[J].JPower Sources,2002,110(1):186-200.
[8] JIANG S P.Con figurations for Performance evaluation in Planar solid oxide fuel cells[J].JApplied Electrochemistry,2004,34(10):1045-1055.
[9] GROOTE A M D,FROMENT G F.Simulation of the catalytic partial oxidation of methane to synthesis gas [J].Applied Catalysis A:General,1996,138(2):245 -264.
[10] XU J,FORM EN T G F.Methane steam reform ing methanation and w ater gas shift-I.Intrinsic kinetics [J].A IChE J,1989,35(1):88-96.
[11] CHEN Z X,YAN Y B,ELNASHA IE SS EH.Novel circu lating fast fluidized-bed membrane reformer for efficientproduction of hydrogen from steam reforming ofmethane[J].Chem Eng Sci,2003,58(19): 4335-4349.

