气相色谱法测定黄瓜、苹果中的虫螨腈残留量
吴 迪,罗雪婷,潘洪吉,聂向云,范丽佳
(北京市植物保护站,北京 100029)
气相色谱法测定黄瓜、苹果中的虫螨腈残留量
吴 迪,罗雪婷,潘洪吉,聂向云,范丽佳
(北京市植物保护站,北京 100029)
为了对虫螨腈在黄瓜和苹果上的残留分析方法进行探讨,采用乙腈提取、Flolisil小柱净化、GC-μECD进行检测。结果表明:黄瓜上添加标准品0.005、0.01、0.5μg/g的回收率分别为115.6%、86.4%、82.8%,相对标准偏差分别为2.6%、7.6%、9.2%;苹果上添加标准品0.005、0.1、0.5μg/g的回收率分别为109.2%、95.9%、94.6%,相对标准偏差为8.0%、4.2%、7.6%;田间试验得到的虫螨腈在黄瓜的消解动态方程为y=0.0431e-0.1665x,半衰期为4.2d;虫螨腈在苹果上的消解动态方程为y=0.1115e-0.0734x,半衰期为9.4d。本方法灵敏度、准确度、精密度高,能够为大规模监测蔬菜水果中虫螨腈的残留情况提供参考。
虫螨腈;残留;黄瓜;苹果;消解动态
虫螨腈又名溴虫腈(chlorfenapyr),化学式为C15H11BrClF3N2O,化学名称为4-溴基-2-(4-氯苯基)-1-(乙氧基甲基)-5-(三氟甲基)吡咯-3-腈,相对分子质量为407.62。虫螨腈是一种芳基取代吡咯化合物,作用于昆虫体内细胞的线粒体上,通过昆虫体内的多功能氧化酶起作用,主要抑制二磷酸腺苷(ADP)向三磷酸腺苷(ATP)的转化。虫螨腈通过胃毒及触杀作用于害虫,在植物叶面渗透性强,有一定的内吸作用,可以控制对氨基甲酸酯类、有机磷酸酯类和拟除虫菊酯类杀虫剂产生抗性的昆虫和某些螨类。其杀虫谱广、对常规农药无交互抗性,对人、鸟、鱼、蚕低毒[1],但医学研究表明,虫螨腈会对小鼠的肝、脾、肾细胞DNA产生损伤[2]。
许多国家都对该药使用进行了严格规定,美国制订的虫螨腈在蔬菜、水果上的最大允许残留量(MRL)为0.01~2.0mg/kg,日本肯定列表规定虫螨腈的MRL为0.01~5.0mg/kg[3]。许多国家都确定了虫螨腈在环境和蔬菜中的官方残留检测方法[4-6]。
我国对虫螨腈的残留分析,文献报道已有液相色谱方法[7]和气相色谱方法[8-14],以及气相色谱-负化学电离质谱法(GC-NC IMS)等方法[15]。液相色谱测定的灵敏度相对于气相色谱法较低,而报道中的气相色谱法测定蔬菜和土壤样品,需要对样品进行抽滤、进行液液分配等,较为繁琐。目前并未见同时测定蔬菜、水果中虫螨腈残留量的较为简便的方法报道,本实验鉴于此进行研究。
1 材料与方法
1.1 材料、试剂与仪器
黄瓜(中农12)、苹果(富士)产于北京市延庆县。
虫螨腈标准品(99.7%)、虫螨腈悬浮剂(240g/L) 德国巴斯夫公司;淋洗液[丙酮-正己烷(20:80,V/V)];乙腈、正己烷、丙酮(均为色谱纯) 迪马公司;氯化钠、无水硫酸钠(均为分析纯) 北京化学试剂公司。
6890(μECD)气相色谱仪、Frolisil小柱(1g/6mL) 美国安捷伦公司;高速匀浆机;往复式振荡器;旋转蒸发仪;水分测定仪;固相萃取仪。
1.2 方法
1.2.1 样品前处理
称取20.0g样品,加15g NaCl和50mL乙腈,用高速匀浆机匀浆1min,静置15min,使乙腈提取液和NaCl溶液层分离。
在100mL具塞量筒中加20g无水硫酸钠,将乙腈提取液倒入其中,振荡除水。取25mL上清液至100mL圆底烧瓶中,40℃真空旋转蒸发,浓缩该上清液至1mL。
用6mL正己烷、6mL淋洗液活化Frolisil柱。在浓缩液中加入2mL正己烷,将样品加入Frolisil柱上,用6mL淋洗液冲洗圆底烧瓶并淋洗小柱,接收至刻度试管中。氮气吹干,用正己烷定容至2.5mL,待气相色谱检测。
1.2.2 仪器条件
色谱柱:HP-5毛细管色谱柱(30m×0.25mm,0.25μm);DB-17毛细管色谱柱(30m×0.25mm,0.25μm);进样口温度:280℃;柱温:初始柱温180℃,以5℃/min的速率升温至280℃,保持5min;检测器温度:280℃;柱流量:1.0mL/min;进样量:1μL;保留时间:10.603min (HP-5)、16.045min(DB-17)。
1.2.3 标准曲线的制作
准确称取虫螨腈标准品10.03mg,用正己烷溶解至10mL,得到1000mg/L的虫螨腈母液。逐级稀释,用0.01、0.05、0.1、0.2、0.5、1.0、5.0mg/L的虫螨腈标准溶液进样,制作标准曲线。
1.3 残留动态实验
1.3.1240 g/L虫螨腈悬浮剂在黄瓜中的消解动态实验
选有代表性的黄瓜地块,设3个重复实验小区,每小区面积20m2。施药浓度均为216g a.i/ha(即每公顷施虫螨腈有效成分量216g),兑水一次性喷雾处理,待黄瓜生长至1cm直径(成熟个体近一半大小)时,开始对黄瓜整个植株喷雾处理,施药时注意黄瓜全植株与果实的着药,以保证施药均匀。药后分别间隔1h和1、2、3、5、7、10、14d进行采样。采样要求每小区随机抽采黄瓜6条,不少于2kg。将黄瓜切碎后,采用四分法取250g装入聚乙烯塑料密封袋中,置于-20℃冰柜中贮存待测。
1.3.2240 g/L虫螨腈悬浮剂在苹果中的消解动态实验
苹果园内选有代表性的地块设3个重复实验小区,每小区面积不少于2棵树。以300g a.i/ha药液处理,于苹果生长至成熟个体一半大小时,开始对苹果整个植株喷雾处理,保证施药均匀。药后分别间隔1h和1、3、7、14、21、30d进行采样。采样要求按每棵树的上、中、下、内、外四周随机采果1 2个,不少于2 k g。采用四分法取250g装入聚乙烯塑料密封袋中,置于-20℃冰柜中贮存待测。
2 结果与分析
2.1 标准曲线结果
使用D B-1 7毛细管色谱柱得到的标准曲线为y=295014x+4619.4(R2=0.9998);使用HP-5毛细管色谱柱得到的标准曲线为y=153757x+2538.8(R2=0.9999)。标准曲线见图1。

图1 使用不同色谱柱得到的标准曲线Fig.1 Standard curve of chlorfenapyr using DB-17 and HP-5 columns in GC analysis
2.2 灵敏度、准确度和精确度
该方法对虫螨腈的最小检出量为1×10-11g,在黄瓜和苹果中的最低检测浓度均为0.005μg/g。虫螨腈在黄瓜中添加0.005~0.5μg/g时,平均回收率为82.8%~115.6%,相对标准偏差为2.6%~9.2%(表1);在苹果中
添加0.005~0.5μg/g时,平均回收率为94.6%~109.2%,相对标准偏差为4.2%~8.0%(表2)。

表1 虫螨腈在黄瓜中的添加回收率、相对标准偏差Table 1 Average recoveries of 5 replicates of chlorfenapyr in cucumbers at different spike levels

表2 虫螨腈在苹果中的添加回收率、相对标准偏差Table 2 Average recoveries of 5 replicates of chlorfenapyr in apples at different spike levels
2.3 方法净化效果
通过本方法处理的黄瓜、苹果空白样品和添加样品(图2),在分析过程中排除了杂质干扰,说明本方法有良好的净化效果。
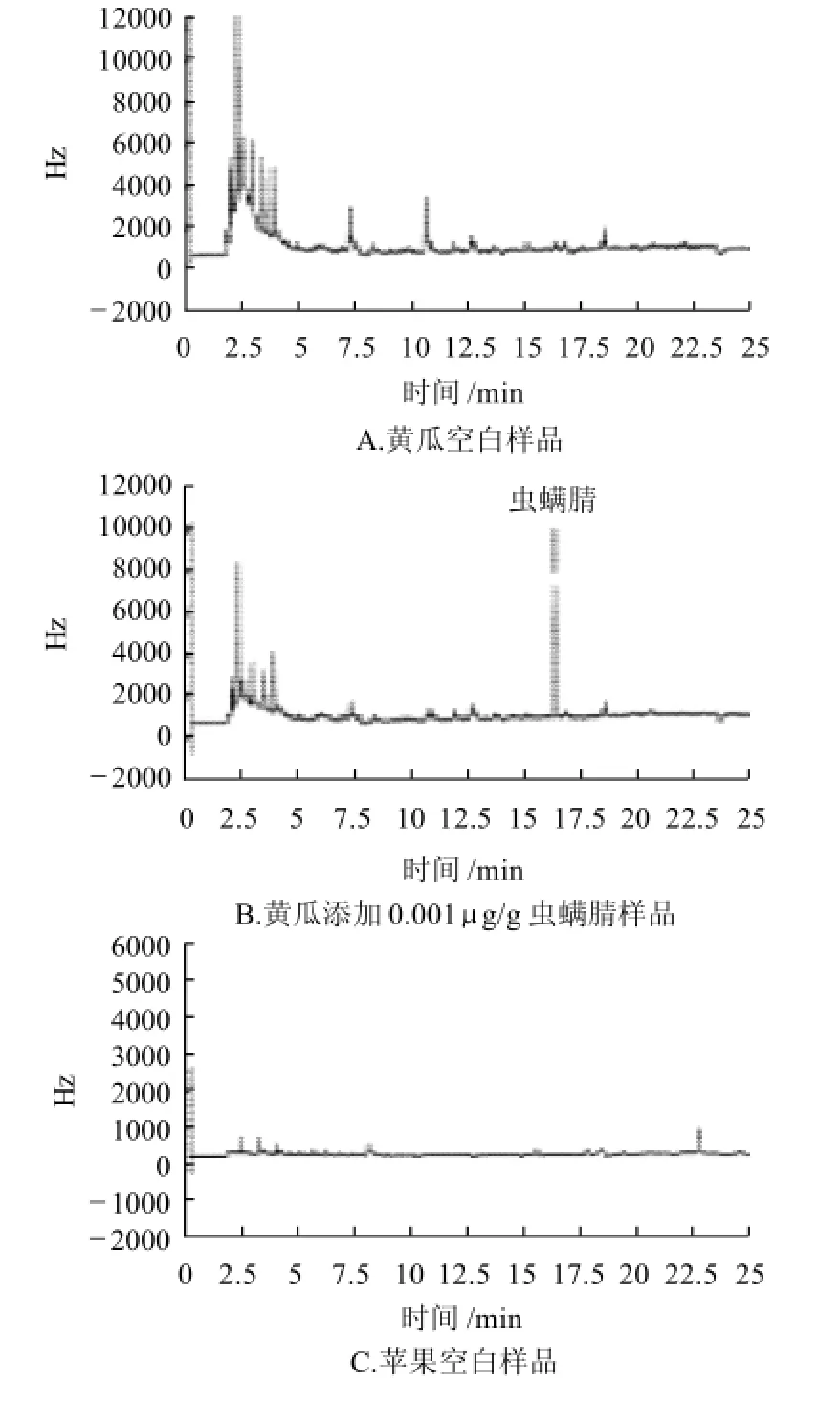

图2 不同样品色谱图Fig.2 GC chromatograms of blank and chlorfenapyr spiked cucumbers and apples
2.4 残留消解动态结果
虫螨腈在黄瓜上的消解动态方程为y=0.0431e-0.1665x,半衰期为4.2d(表3),消解动态曲线见图3;虫螨腈在黄瓜上的消解动态方程为y=0.1115e-0.0734x,半衰期为9.4d (表4),消解动态曲线见图4。

表3 虫螨腈在黄瓜上的消解动态Table 3 Equation describing the degradation dynamics of chlorfenapyr residue in cucumbers and its half life

图3 虫螨腈在黄瓜上的消解动态曲线Fig.3 Degradation dynamic curve of chlorfenapyr residue in cucumbers

表4 虫螨腈在苹果上的消解动态Table 4 Equation describing the degradation dynamics of chlorfenapyr residue in apples and its half life

图4 虫螨腈在苹果上的消解动态曲线Fig.4 Degradation dynamic curve of chlorfenapyr residue in apples
3 讨 论
本实验得到的方法灵敏度、准确度、精密度高;虫螨腈在黄瓜的消解动态方程为y=0.0431e-0.1665x、半衰期为4.2d,虫螨腈在苹果上的消解动态方程为y=0.1115e-0.0734x、半衰期为9.4d。本方法能够为大规模监测蔬菜水果中虫螨腈的残留情况提供参考。
[1]皇甫伟国, 陈国, 杨挺. 蔬菜中溴虫腈残留量检测方法研究[J]. 浙江农业学报, 2007, 19(2): 119-122.
[2]李小燕, 陈贤均. 嗅虫腈对小鼠三种脏器细胞DNA损伤程度的比较[J]. 咸宁学院学报: 医学版, 2004, 18(3):164-167.
[3]U.S Environmental protection agency. Chlorfenapyr Tolerance Petition Filing 1/97[EB/OL]. (1997-4-2)[2009-5-23].http:// http://pmep.cce. cornell.edu/profiles/insect-mite/cadusafos-cyromazine/chlorfenapyr/ chlorfenapyr-tol.html.
[4]葛志荣. 食品中农业化学品残留限量: 药品卷[M]. 北京: 中国标准出版社, 2006: 288.
[5]CAO Yongsong, CHEN Jiuxin, WANG Yuelong, et al. HPLC/UV analysis of chlorfenapyr residues in cabbage and soil to study the dynamics of different formulations[J]. Science of the Total Environment, 2005, 350: 38-46.
[6]EPA. Analytical methods for residual compositional substances of agricultural chemicals, feed additives, and veterinary drugs in food[S].
[7]刘育清. 虫螨腈的高效液相色谱分析法[J]. 农药科学与管理, 2002, 23(4): 14-15.
[8]郭新东, 杜志峰, 黄梦基, 等. 气相色谱法测定食用植物油中的溴虫腈[J]. 粮油食品科技, 2007, 15(1): 27-28.
[9]徐莹, 徐辉. 虫螨腈悬浮剂的毛细管气相色谱分析方法[J]. 农药科学与管理, 2003(10): 6-7.
[10]毕富春, 吴国旭. 虫螨腈毛细管柱气相色谱法分析[J]. 农药科学与管理, 2003, 24(9): 7-8.
[11]麦燕玲, 钟国华, 胡美英, 等. 溴虫腈土壤和甘蓝微量残留量的气相色谱法测定[J]. 农药, 2004, 43(5): 233-235.
[12]麦燕玲, 刘红梅, 刘承兰, 等. 溴虫腈在黄瓜和苋菜中的残留动态研究[J]. 华南农业大学学报, 2007, 28(1): 67-69.
[13]陈文团, 钟国华, 施楚新, 等. 溴虫腈在土壤的残留动态[J]. 生态环境, 2007, 16(5): 1441-1445.
[14]张曼, 林安清, 许泓, 等. 气相色谱法测定茶叶中残留的溴虫腈[J].食品研究与开发, 2007, 28(10): 150-151.
[15]张晟瑞, 潘艳, 孙晓燕, 等. 气相色谱-负化学电离质谱法(GC-NC IMS)对虫螨腈在茄子和土壤中残留的分析[J]. 分析测试学报, 2008, 27: 134-136.
GC Determination of Chlorfenapyr Residue in Cucumbers and Apples
WU Di,LUO Xue-ting,PAN Hong-ji,NIE Xiang-yun,FAN Li-jia
(Beijing Plant Protection Station, Beijing 100029, China)
A gas chromatographic (GC) method was established for the determination of chlorfenapyr residue in cucumbers and apples. The target analyte was extracted from samples with acetonitrile, cleaned up on a Frilisil column, and determined by GC with electron capture detector. The average recoveries of 5 replicates of chlorfenapyr at the spike levels of 0.005, 0.01 and 0.5 μ g/g were 115.6%, 86.4% and 82.8% in cucumbers, with the relative standard deviations (RSDs) of 2.6%, 7.6% and 9.2% and 109.2%, 95.9% and 94.6% in apples, with the RSDs of 8.0%, 4.2% and 7.6%, respectively. Field tests gave the equations describing the degradation dynamics of chlorfenapyr residue in cucumbers and apples of y = 0.043e-0.1665xand y = 0.115e-0.0734x, with the half lives of 4.2 d and 9.4 d, respectively. The method has the advantages of high sensitivity, accuracy and precision, thereby providing a good approach for the monitoring of chlorfenapyr residue in vegetables and fruits.
chlorfenapyr;residue;degradation dynamics;cucumbers;apples
TS207.3
A
1002-6630(2010)10-0268-04
2009-07-30
吴迪(1983—),女,农艺师,硕士,研究方向为农产品安全。E-mail:wudii098@163.com

