绿原酸酵母细胞微胶囊工艺研究
卢 琪,曹少谦,吕思伊,周 荧,高 丽,潘思轶*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
绿原酸酵母细胞微胶囊工艺研究
卢 琪,曹少谦,吕思伊,周 荧,高 丽,潘思轶*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
采用酿酒酵母的细胞壁包埋水溶性的绿原酸,通过正交试验考察包埋温度、包埋时间、芯材比和加水量因素对绿原酸微胶囊包埋率的影响。结果表明,在包埋温度40℃、包埋时间6h、芯材比3:1(g/g),以6mL蒸馏水为包埋介质的组合条件下,包埋率最大为18.9%。微胶囊红外光谱分析发现绿原酸的特征官能团的振动消失;荧光显微镜观察显示微胶囊呈球形,微胶囊内的绿原酸自发明亮的荧光;高效液相色谱定性分析显示,绿原酸包埋前后保留时间及紫外扫描图谱相一致。研究结果表明绿原酸成功的包埋到酵母细胞壁内,且在包埋过程中没有发生任何化学变化。
绿原酸;细胞壁;微胶囊;正交试验;高效液相色谱
Abstract :Brewer's yeast (Saccharomyces cerevisiae) cells subjected to a 24 h plasmolysis treatment were used to encapsulate chlorogenic acid, a water-soluble antioxidant. The optimal encapsulation for 6 h at 40 ℃ and 3:1 core material/wall material ratio(g/g) in 6 mL of distilled water as encapsulation medium determined using orthogonal array design resulted in a maximum encapsulation efficiency of 18.9%. Infrared spectral analysis indicated the disappearance of characteristic function groups of chlorogenic acid. Fluorescence microscopic studies revealed that the microcapsules were spherical in shape and that the spontaneous fluorescence of chlorogenic acid was observed on the inner side of yeast cell wall. The similar retention time and UV-Vis profiles between unmicroencapsulated and microencapsulated chlorogenic acid were found through HPLC analysis. All these results suggested that chlorogenic acid was successfully encapsulated and no significant chemical changes occurred during the encapsulation process.
Key words:chlorogenic acid;microencapsulation;cell wall;orthogonal array design;HPLC
当今,人们越来越注重通过功能性食品来预防、治疗疾病[1]。绿原酸作为天然存在的酚类化合物,具有抗氧化功能,医学上证实其具有利胆、降压、抗菌、消炎及升高白细胞等药理作用[2-4]。但在许多情况下,酚类物质通常具有令人反感的味道和不稳定的性质。因此,如何利用食品工艺学方法处理绿原酸,既能充分发挥其疗效,又能祛除异味、提高稳定性,已成为一项具有探索性的研究课题[5-6]。
微胶囊技术已广泛应用于医药、食品、化妆品等行业。然而,这些技术主要应用在包埋挥发性油和香料等酯溶性物质中。包埋壁材通常选用具有两亲性结构的物质,如环状糊精和大豆蛋白,它们通过内部疏水结构包埋酯溶性的物质,提高其稳定性,而关于包埋水溶性物质的报道甚少。酵母细胞呈球形或椭球形,以分散的单细胞状态存在,大小在几微米到20微米范围内,完整的酵母细胞壁和细胞膜结构具有一定的强度和通透性,因此是理想的微胶囊壁材[7-8]。在包埋过程中无需引入其他的化学试剂,避免了药物残留,并且获得的微胶囊产品大小均一、无毒、生物相溶性好、易生物降解[9]。
本研究采用正交试验优化酿酒酵母细胞壁包埋绿原酸的工艺条件,并通过红外光谱分析、荧光显微镜观察和高效液相色谱分析来表征绿原酸微胶囊,旨在建立一种绿原酸微胶囊的制备新工艺。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae) 华中农业大学作物遗传与改良国家重点实验室。
绿原酸(chlorogenic acid,CGA,纯度90%) 泰安中荟植物生化有限公司。
1.2 仪器与设备
2998高效液相色谱仪 美国Waters公司;Eclipse 80i荧光显微镜 日本Nikon公司;傅里叶变换红外光谱美国 Nicolet公司;SHA-B 恒温水浴振荡器 常州国华电器有限公司;SW-CJ-2D双人单面净化工作台 苏州净化设备有限公司;Anke TDL-5-A型离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 包埋壁材的制备
采用YPD液体培养基(酵母提取物10g,蛋白胨20g,葡萄糖20g,溶于1L水),水浴振荡培养酵母细胞(28℃,200r/min,36h)后,离心(4200r/min,10min)收集酵母细胞。酵母细胞经5次水洗后,加入质量分数为5%的氯化钠溶液(体积为酵母细胞的4倍),置于锥形瓶,放入摇床进行质壁分离(54℃,150r/min,24h)。质壁分离后的酵母细胞再次离心(4200r/min,10min),水洗5次后,冷冻干燥。
1.3.2 绿原酸微胶囊的制备
按不同的芯材比加入CGA和酵母细胞及一定体积的蒸馏水,在100mL的烧杯中混合搅拌,加盖后放入摇床。恒温恒速振荡一定时间后,CGA可通过渗透扩散作用进入酵母细胞内部,形成微胶囊。混合液在4200 r/min下离心15min后缓慢倒出上层清液,下层细胞用蒸馏水洗涤,除去未包入的绿原酸,40℃真空干燥1h。
1.3.3 包埋率的计算
微胶囊中绿原酸包埋率的计算如下:

式中:Y为绿原酸包埋率/%;mA为加入的干酵母质量/g;mB为收集的微胶囊总质量/g。
1.3.4 荧光显微镜观察微胶囊形态[10]
绿原酸酵母微胶囊被分散在双蒸水中形成悬浊液后,烘干固定。在同一荧光强度,同一激发波长下,观察酵母细胞壁所产生的荧光和酵母胶囊包埋的绿原酸发出的荧光。利用荧光显微镜获得明场视野和荧光显微镜图像,数字图像处理使用Adobe Photoshop软件。
1.3.5 傅里叶变换红外光谱(FT-IR)分析
将2mg的绿原酸样品、冻干的酵母细胞和已包埋的微胶囊粉末碾磨均匀,使其分布在200mg的溴化钾中利用压片。压片后放置在傅里叶变换红外分光镜中测定。
1.3.6 绿原酸微胶囊的释放及成分分析
将0.1g绿原酸酵母胶囊,用50mL盐酸(0.1mol/L)破壁萃取5次,绿原酸的定性分析由高效液相色谱仪测定。流动相的成分的体积配比为水:甲醇:冰醋酸=700:300:2;流速为0.8mL/min;样品上液量为20μL;检测波长:326nm。此外,酵母包埋后的绿原酸紫外吸收波段在200~400nm之间确定[11]。
2 结果与分析
2.1 绿原酸包埋工艺的研究
通过正交试验设计,研究了包埋时间(A)、加水量(B)、芯材比(C)和温度(D)4个因素对酵母微胶囊制备的影响。其中芯材比是指绿原酸纯品(囊心)质量和酵母细胞壁(壁材)质量的配比。结果如表1~3所示。

表1 正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
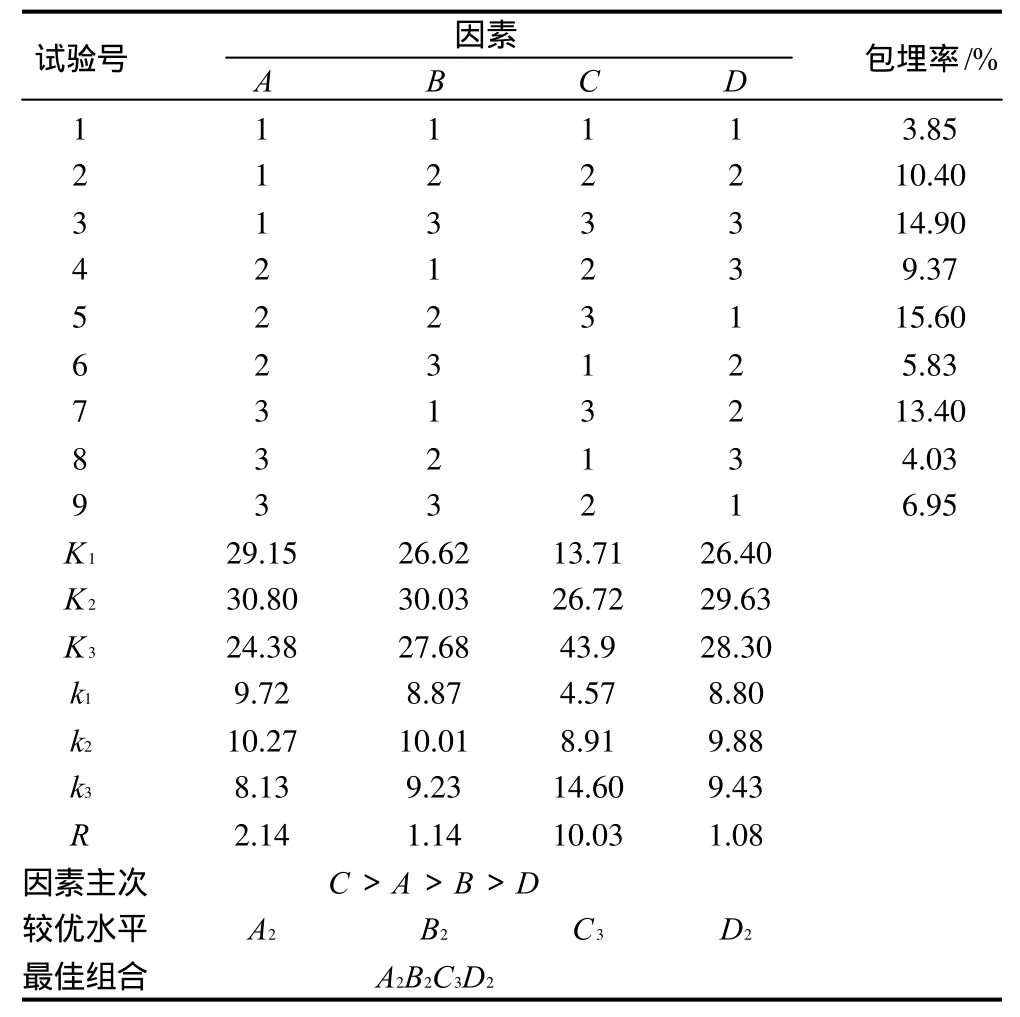
表2 L9(34)正交试验结果Table 2 Orthogonal array design and experimental results of the encapsulation efficiency

表3 方差分析表Table 3 Analysis of variance of the encapsulation efficiency with various encapsulation conditions
正交试验方案及结果如表1~3所示。通过极差分析和方差分析结果可以看出:包埋芯材比对包埋效果影响最大,当芯材比逐渐增大时,体系中绿原酸的浓度增大,细胞外的渗透压也随之增大,加速了绿原酸向细胞内扩散从而使包埋率增大。时间对包埋率的影响次之,足够的时间能保证绿原酸充分的向细胞内扩散。加水量间接影响了绿原酸的包埋浓度从而影响包埋率。温度对包埋率的影响最小,随着温度的升高,分子运动加快,促进了绿原酸的扩散。但温度过高可能破坏了细胞壁和细胞膜的通透性或韧性,导致绿原酸溶出,影响包埋率。结果说明,极差分析的结果可信度很高(P < 0.0001)。
通过正交试验得出各因素的最佳水平组合为A2B2C3D2,即包埋温度40℃、包埋时间6h、芯材比3:1(g/g),用6mL的蒸馏水溶解。对该最佳组合条件经过3次重复验证实验,获得的微胶囊包埋率平均结果是18.9%,略高于正交试验最大值15.6% (5号试验结果)。微胶囊中绿原酸包埋率可达18.9%,比环状糊精包埋酯溶性物质所得的包埋率要低,这可能是由于绿原酸粉末包埋过程中需先溶解再真空干燥成固体的原因,本实验采用摇床振荡使绿原酸扩散包埋的方法优于文献报道的加压包埋的方法,其包埋率为12.6%[12]。
2.2 绿原酸微胶囊的荧光显微镜分析

图1 普通光学显微镜和荧光显微镜下的酵母细胞(A, B)和微胶囊(C, D)Fig.1 Optical microscopic observations: A. yeast cells; and C.chlorogenic acid microcapsules. Fluorescence microscopic observations: B. yeast cells; and D. chlorogenic acid microcapsules
光学显微镜下(图1A)酵母细胞呈圆形,有厚厚的细胞壁包围。光学显微镜下的微胶囊的形态(图1C),与酵母细胞的图片并无明显区别。由光显微镜下的酵母细胞图像(图1B)可看见细胞壁在330~380nm紫外激发波长下,带有微弱的蓝色荧光。而荧光显微镜下的微胶囊图像(图1D)中酵母细胞内部产生明显荧光,其荧光强度和色泽较图B强。由于绿原酸除了自身结构特征能够自发荧光,相关研究表明绿原酸和酵母细胞中的蛋白质或多糖之间的相互作用,包括共价键作用和非共价键作用,如氢键、疏水键、离子键、π键等,也能发出荧光,可以推断微囊状荧光是绿原酸包埋后发出的[13-14]。制片时虽然使微胶囊被分散在双蒸水中形成悬浊液,但细胞附近并无相应的荧光,这说明,酵母细胞与绿原酸之间产生相互作用,酵母细胞能够有效的阻止绿原酸的释放和容出。图1A和图1C是在光学显微镜明场条件下图片底色为灰色或淡蓝色,而图1B和图1D是在荧光环境下,图片底色为黑色,有助于观察荧光的强度和色泽。
2.3 微胶囊的红外光谱分析

图2 绿原酸、酵母细胞、微胶囊的傅里叶变换红外光谱图Fig.2 FT-IR spectra of chlorogenic acid, yeast cells and chlorogenic acid microcapsules
绿原酸、酵母细胞和微胶囊的红外光谱图,如图2所示。根据CGA纯品的红外光谱分析,从特征吸收波数可知,3390cm-1为O-H的伸缩振动;在1632cm-1有一特征峰,为单核芳香烃C=C伸缩振动,1521cm-1附近出现C=O非伸缩振动,认为是-COO基团;波数在1389cm-1附近的吸收峰为甲基的面内弯曲振动;在1270、1115cm-1和1062cm-1的吸收峰,可能为C-OC反对称伸缩振动;在 819cm-1处有一吸收峰,可能是由R-CH=CH2面外弯曲振动引起的;在 607cm-1处有一特征峰可能为对称环伸缩振动引起的,也可能有C=O面内弯曲振动结构[15]。而从微胶囊的红外光谱可知,在607、819、1389cm-1处的CGA原有的特征峰消失。因此,可考虑以下可能性,如绿原酸,蛋白质和多糖之间相互作用,微胶囊和酵母细胞之间形状和强度的改变使得微胶囊中的绿原酸在 607、819、1389cm-1处的吸收峰消失,这些情况间接表明绿原酸被包埋到了酵母细胞中。
2.4 包埋前后绿原酸的定性分析

图3 绿原酸纯品和酵母微胶囊化的绿原酸色谱(a)和光谱(b)图形的对比Fig.3 HPLC chromatograms (a) and UV spectra (b) of chlorogenic acid standard and chlorogenic acid microcapsules
图3a是绿原酸纯品和酵母细胞微胶囊化的绿原酸在HPLC中的色谱图,在同一色谱条件下绿原酸纯品和酵母细胞微胶囊化的绿原酸有同样的出峰时间,而且通过PDA检测器检测两者在其他波长下没有杂峰。图3b是绿原酸纯品和酵母细胞微胶囊化的绿原酸在HPLC中的光谱图,绿原酸纯品和酵母细胞微胶囊化的绿原酸具有相同的峰形,两者的最大吸收均在326nm,最小吸收均在264nm和肩峰均在299nm。这些都证明了两者是相同的物质。
图中同样的色谱出峰时间和相同的UV-Vis图谱表明,在包埋过程中绿原酸没有发生任何化学变化。
3 结 论
3.1 优化的微胶囊制备条件:包埋温度40℃、包埋时间6h、芯材比3:1(g/g),用6mL的蒸馏水溶解。对最佳组合条件经过3次重复验证实验,获得的微胶囊包埋率平均结果是18.9%。
3.2 通过荧光显微镜分析,质壁分离的酵母细胞呈球形,大小均一,在荧光显微镜下发出淡蓝色的荧光。包埋后的绿原酸由于绿原酸自身结构特征,及与酵母细胞的相互作用形成氢键、π键等,发出颜色较亮的荧光,图中只有酵母细胞存在的地方才出现荧光,说明绿原酸被充分的包埋进入酵母细胞,外部无残留。
3.3 红外图谱分析,包埋后的绿原酸在607、819、1389cm-1处的吸收峰消失,证明绿原酸被包埋到酵母细胞内,外部无残留。
3.4 通过高效液相色谱的定性分析,包埋前后绿原酸的保留时间均在6min左右(两者差值小于2%),并且PDA检测器检测两者在其他波段没有吸收峰出现,说明绿原酸在包埋前后没有发生任何化学变化。同时,绿原酸包埋前后的紫外吸收图谱一样,进一步证明用酵母细胞包埋前后的绿原酸为同一物质。
3.5 实验过程中应该注意到绿原酸本身的不稳定性,包埋时不能高温、强光及长时间加热。此制备工艺仅能反应在微量条件下的情况,对日后大批量的工业生产仅作参考。
[1] HILLIAM M. Functional foods: the Western consumer viewpoint[J].Nutrition Reviews, 1996, 54(11): 189-194.
[2] KONO Y, KOBAYASHI K, TAGAWA S, et al. Antioxidant activity of polyphenolics in diets: Rateconstants of reactions of chlorogenic acid and caffeic acid with reactivespecies of oxygen and nitrogen[J]. Biochimica et Biophysica Acta, 1997, 1335(3): 335-342.
[3] 邓良, 袁华, 喻宗沅, 等. 绿原酸的研究进展[J]. 化学与生物工程,2005, 22(7): 4-6.
[4] 吴卫华, 康桢, 欧阳冬生, 等. 绿原酸的药理学研究进展[J]. 天然产物研究与开发, 2006, 18(4): 691-694.
[5] NACZK M, AMAROWICZ R, SULLIVAN A, et al. Current research developments on polyphenolics of rapeseed/canola: a review[J]. Food Chemistry, 1998, 62(4): 489-502.
[6] CHANG Q, ZUO Z, CHOW M, et al. Effect of storage temperature on phenolics stability in hawthorn (Crataegus pinnatida var. major) fruits and a hawthorn drinkvar[J]. Food Chemistry, 2006, 98(3): 426-430.
[7] 王金宇, 李淑芬, 关文强. 酵母细胞微胶囊化丁香油的研究[J]. 食品科学, 2006, 27(4): 154-155.
[8] PANNELL N. Encapsulation of material in microbial cells: US, 5288632[P]. 1994-02-22.
[9] 梁治齐. 微胶囊技术及其应用[M]. 北京: 中国轻工业出版社, 1999:157-161.
[10] BISHOP J, NELSON G, LAMB J. Microencapsulation in yeast cells[J].Journal of Microencapsulation, 1998, 15(6): 761-773.
[11] 赵永成. 高效液相色谱法测定杜仲叶中的绿原酸[J]. 色谱, 2005, 18(3): 262-264.
[12] SHI Guorong, RAO Liqun, YU Huazhong, et al. Yeast-cell-based microencapsulation of chlorogenic acid as a water-soluble antioxidan[J].Journal of Food Engineering, 2007, 80(4): 1060-1067.
[13] RAWEL H, ROHN S, KROLL J. Characterisation of 11S protein fractions and phenolic compounds from green coffee beans under special consideration: a review[J]. Deutsche Lebensmittel-Rundschau, 2005,101(4): 148-160.
[14] CLIFFORD M. The use of poly-n-vinylpyrrolidone as the adsorbent for the chromatographic separation of chlorogenic acids and other phenolic compounds[J]. Journal of Chromatography, 1974, 94(17): 261-266.
[15] 关炳峰. 金银花中绿原酸类物质的提取、抗氧化及抑菌特性研究[D]. 武汉: 华中农业大学, 2007.
Microencapsulation of Chlorogenic Acid in Yeast Cells
LU Qi,CAO Shao-qian,LSi-yi,ZHOU Ying,GAO Li,PAN Si-yi*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
O625.31
A
1002-6630(2010)10-0137-05
2009-08-14
卢琪(1986—),女,硕士研究生,研究方向为食品科学与工程。E-mail:chitty1986@yahoo.com.cn
*通信作者:潘思轶(1964—),男,教授,博士,研究方向为农产品的贮藏加工。E-mail:pansiyi@mail.huau.edu.cn

