七种谷物麸皮中的酚酸类成分分析
郝 杰,张长虹,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
七种谷物麸皮中的酚酸类成分分析
郝 杰,张长虹,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
利用反相高效液相色谱法(RP-HPLC)测定7种不同种类及品种的谷物麸皮中8种酚酸类成分的含量,并利用数学统计的方法对不同种类谷物、各类酚酸及总酚酸含量间的差异性进行分析。分析结果表明:所分析谷物种类所含酚酸的含量顺序为玉米>小麦>荞麦>燕麦,谷物麸皮中酚酸主要以束缚型酚酸形式存在,且肉桂酸类酚酸含量明显大于苯甲酸类酚酸,游离型及可溶共价结合型酚酸中4-羟基苯甲酸、香草酸含量较高;而在束缚型酚酸中阿魏酸的含量在各类谷物中均最高,玉米品种中可达到6527.86μg/g麸皮。
谷物麸皮;酚酸;高效液相色谱
酚酸是酚类物质中的一类,约占植物源食品中酚类化合物的1/3,多为苯甲酸和肉桂酸的羟化衍生物,许多研究结果证明其具有良好的保健功能[1]。植物源酚酸主要以游离和束缚的形式存在,束缚的酚酸通常以酯键、醚键与许多化合物连接在一起[2]。常见的酚酸分为羟化肉桂酸和羟化苯甲酸。羟化肉桂酸衍生物主要有香豆酸、咖啡酸和阿魏酸,它们通常与奎尼酸或葡萄糖酯化存在于食物中,羟化肉桂酸中羧烯基团(—CH=CH—COOH)的存在是其具有显著抗氧化性的关键所在[3];而羟化的苯甲酸衍生物中最常见的有对羟基苯甲酸、香草酸和原儿茶酸,主要以配糖物的形式存在食物中[4]。
麸皮是谷物加工的主要副产物,仅小麦麸皮来说,我国每年出产的小麦麦麸在2000万吨以上,目前主要用作饲料,经济利用价值低[5]。以往的研究中,人们多把注意力放在对谷物麸皮中游离型酚酸的研究,而麸皮中的游离型酚酸相对于蔬菜水果来说,含量是极少的,因此只着重研究水果蔬菜中的酚酸物质,而忽略了谷物麸皮的价值。近年来,国外陆续有人发现谷物麸皮中含有大量具有强抗氧化活性的植物活性物质,包括有酚酸、类胡萝卜素、木酚素、V E等[6]。谷物麸皮中的酚酸绝大多数以束缚型酚酸的形式存在,这些酚酸与细胞壁相结合,因此主要作用于下消化道,经酶解释放出生物活性物质,可以预防结肠癌等慢性疾病[7]。因此,谷物麸皮的利用价值急剧上升,美国膳食营养学家也把谷物麸皮放在膳食营养金字塔的最底端,提倡全谷物食品的摄入量应达到每天3次,每次约100g[6]。
国外学者也开始对谷物麸皮中的酚酸进行分品种的研究[8-11]。Oufnac等研究了在不同溶剂条件(甲醇、丙
酮、正己烷)下以及采用微波辅助提取法时,小麦麸皮中酚类化合物的提取率及抗氧化活性的不同。结果表明,采用甲醇溶剂和微波辅助时提取率要高于其他溶剂,达到467.5μg/g麸皮。Zhou等对稻米中的酚酸的分布进行了研究,发现在未去壳的糙米中,阿魏酸含量达到255~362μg/g谷物,香豆酸70~152μg/g谷物,均远大于去壳之后的精制米。在总酚酸含量中束缚型酚酸占总量的80%~90%。Sylvester等通过对硬质小麦的抗氧化性研究表明,小麦麸皮中存在的酚酸类成分,包括羟基苯甲酸、龙胆酸、咖啡酸、香草酸、绿原酸、丁香酸、香豆酸和阿魏酸,是其抗氧化活性的关键。
本实验选取4个种类(小麦、玉米、荞麦、燕麦) 7个品种的麸皮样品,将其中的酚酸成分按其存在形式分为游离型、可溶共价结合型、束缚型3部分,利用高效液相色谱对其进行含量测定,并用数学统计方法对不同种类、不同品种、不同酚酸之间的含量差异进行分析比较,寻找酚酸物质在谷物麸皮中的存在规律,对麸皮的资源开发进行初步研究。
1 材料与方法
1.1 材料与试剂
小麦样品主要品种:鲁麦13号(产地山东泰安县);中优206(产地山西太谷县);京9843(北京通州区)。玉米主要品种:鲁丹981(产地山东泰安县);鑫丰甜糯80(产地山西太谷县)。定96-1甜荞(产地吉林镇赉县)。坝莜九号:由河北高寒作物研究所提供。
4-羟基苯甲酸(4-hydroxybenzoic acid)、4-羟基苯乙酸(4-hydroxyphenylacetic acid)、4-羟基苯甲醛(4-hydroxybenzaldehyde)、香草酸(vanillic acid)、丁香酸(syringic acid)、香豆酸(coumanic acid)、阿魏酸(ferulic acid)、肉桂酸(cinnamic acid)(纯度均大于95%) 美国Sigma-Aldrich公司;正己烷、无水乙醚、乙酸(均为分析纯);甲醇(色谱纯) 美国Fisher Scientific公司;超纯水(电导率18mΩ/cm) 自制。
1.2 仪器与设备
1100高效液相色谱系统[配有四元梯度泵、在线脱气机、自动进样器、二极管阵列紫外检测器和Chemstation Rev A.09.01(1206)色谱工作站] 美国安捷伦科技有限公司;RE-2000型旋转蒸发仪 上海亚荣生化仪器厂;SHB-B9循环水式多用真空泵 郑州长城科工贸有限公司。
1.3 方法
1.3.1 酚酸的提取
1.3.1.1 样品的预处理
所有7种麸皮样品分别经粉碎后,取颗粒直径为250~380μm之间的部分,以料液比1:20(m/V)正己烷脱脂,搅拌1 h,抽滤后残渣室温下阴干。
1.3.1.2 游离型酚酸提取方法
取0.5g脱脂麸皮用20mL 80%的甲醇浸提,室温条件下搅拌3次,各次分别为1.5、1、0.5h。滤液混合浓缩至10mL,用HCl溶液调至pH2,用10mL的乙醚萃取3次,有机相混合后用真空旋转蒸发器蒸干,用2mL的色谱纯的甲醇复溶,得到游离型酚酸(FPA),滤渣于60℃条件下真空干燥。
1.3.1.3 可溶共价结合型酚酸提取方法
上述萃取后的水相用2mol/L的NaOH溶液调至pH7,用5mL 2mol/L的NaOH溶液碱解4h,用6mol/L的盐酸调pH2,用10mL乙醚萃取3次,有机相用真空旋转蒸发器蒸干后,用2mL甲醇复溶,得到碱解可溶共价结合型酚酸(BHPA),水相用5mL 6mol/L的HCl溶液在沸水中酸解30min,冷却后用10mL乙醚萃取3次,有机相用真空旋转蒸发器蒸干后,用2mL甲醇复溶,得到酸解可溶共价结合型酚酸(AHPA)。
1.3.1.4 束缚型酚酸提取方法
真空干燥后滤渣称重,取50mg,用4mL 2mol/L的NaOH溶液碱解18h,于室温条件下4000r/min离心15min,上清液调pH2,用无水乙醚萃取3次,有机相混合后用真空旋转蒸发器蒸干后,用2mL甲醇复溶,得到碱解束缚型酚酸(BBPA)。残渣用4mL 6mol/L的HCl溶液于沸水中酸解1h,冷却后室温条件下4000r/min离心15min,上清液用10mL乙醚萃取3次,有机相混合用真空旋转蒸发器蒸干后,用2mL甲醇复溶,得到酸解束缚型酚酸(ABPA)。
1.3.2 色谱条件
色谱柱:Phenomenex Luna 5u phenyl-hexyl(250mm ×4.6mm,5μm)配有Phenomenex SecurityGuard KL0-4282 (4.0mm×2.0mm,5μm);柱温30℃;流动相:B为含有体积分数2%乙酸的水,C为甲醇;洗脱程序:0~25min,C为5%~30%;25~35min,C为30%~50%;35~45min,C为50%~100%;45~55min,C为100%;55~60min,C为100%~5%;60~70min,C为5%;进样量10μL;检测波长280nm;进样前样品均用0.45μm微孔滤膜过滤。
1.3.3 标准曲线的绘制
准确配制一定质量浓度(表1中最高检测质量浓度)8种酚酸的标准样品,并分别梯度稀释到1/2、1/5、1/10、1/20、1/50、1/100,经0.45μm微孔滤膜过滤,进样量10μL,按上述色谱条件进行测定。以测定得到的峰面积为纵坐标、标准样品的质量浓度为横坐标,分别绘制8种酚酸样品的标准曲线。
1.3.4 数据统计分析
所有样品从粗样提取开始做3组平行实验。采用SPSS 17.0统计软件的单因素方差分析(one-way ANOVA)和Turkey多重比较法进行数据统计(α<0.05)。
2 结果与分析
2.1 标准样品工作曲线的绘制

图1 标准混合样品液相色谱图Fig.1 HPLC chromatograms of mixed 8 PA standards
将所购得标准样品按一定质量浓度溶于甲醇中,制得8种标准样品的混合标样,使用前述方法进行高效液相色谱检测,确定其保留时间及分离效果。所得标准样品的液相色谱图如图1所示。将8种标准样品按一定稀释倍数稀释,绘制工作曲线,所得到工作曲线的检测范围及相关系数列于表1中。

表1 8种标准样品的检测范围及相关性系数Table 1 Linear concentration ranges and correlation coefficients of 8 PAs

表2 7种谷物麸皮游离型酚酸含量Table 2 Contents of free species of 8 PAs in different varieties of cereal branμg/g麸皮

表3 7种谷物麸皮可溶共价结合型酚酸含量Table 3 Contents of soluble covalent species of 8 PAs in different varieties of cereal bran μg/g麸皮
2.2 谷物麸皮中游离型酚酸含量的比较
由表2可知,从酚酸种类上来看,香草酸在禾本科植物的游离型酚酸中均有存在(荞麦为蓼科),阿魏酸
在除鑫丰甜糯80之外的每一品种中均有分布。丁香酸在小麦品种的游离型部分中普遍存在,而在玉米品种中香豆酸的分布要大于其他品种谷物。4-羟基苯乙酸在7中谷物的FPA部分中均没有分布。对于杂粮中燕麦,其游离型部分的酚酸成分比较复杂,除4-羟基苯乙酸之外均有存在。而荞麦中只有4-羟基苯甲酸、阿魏酸、肉桂酸。
另外,从所测得的酚酸含量上看,小麦及燕麦品种中,香草酸、阿魏酸的含量均大于其余酚酸,是其FPA部分的主要酚酸。荞麦中阿魏酸为主。而玉米中生长于较湿润山东地区的鲁丹781中阿魏酸及肉桂酸的含量均高于生长于干燥地区的鑫丰甜糯80,说明生长地域的环境因素对其酚酸的含量及种类分布可能有影响。
2.3 可溶共价结合型酚酸的比较
可溶共价结合型酚酸包括BHPA及AHPA两部分。由表3可知,一方面,从种类上,与FPA部分测定的结果相同,4-羟基苯乙酸除在鲁麦13号及中优206小麦中微量存在之外,在各类谷物中均没有分布。而香草酸同样在禾本科植物中存在。而丁香酸在玉米可溶共价结合型中也有分布,并非只存在于小麦中。从碱解与酸解的部分上来看,4-羟基苯甲酸在玉米样品中只存在于酸解AHPA部分;4-羟基苯甲醛分布于禾本科植物的BHPA部分;香豆酸只分布于BHPA部分,酸解部分中没有分布。
另一方面,酚酸含量上,香草酸在酸解AHPA的分布远远大于碱解BHPA部分,例如在中优206小麦中,AHPA中香草酸含量为587.23μg/g麸皮,而在BHPA中,只有18.66μg/g麸皮。香草酸是小麦、玉米、燕麦等禾本科品种可溶共价结合部分中含量最高的酚酸种类,两部分总和可达到97.02~605.89μg/g麸皮,而蓼科的荞麦中以4-羟基苯甲酸为主,但含量不高。4-羟基苯甲酸、丁香酸、阿魏酸、肉桂酸虽在各品种均有较广分布,但含量均不高,分别为4-羟基苯甲酸18.96~69.11μg/g麸皮、丁香酸21.35~36.13μg/g麸皮、阿魏酸19.72~93.90μg/g麸皮、肉桂酸3.87~19.77μg/g麸皮。这使得在游离型酚酸中,苯甲酸衍生物的含量大于肉桂酸衍生物。
2.4 谷物麸皮中束缚型酚酸含量的比较
表4为束缚型酚酸的测定结果。从总体来看,束缚型部分中酚酸的含量远远大于游离型和可溶共价结合型部分。禾本科谷物阿魏酸的含量相当高,达到961.1~6527.86μg/g麸皮,小麦品种中阿魏酸含量1160.60~2038.12μg/g麸皮,而在玉米品种中阿魏酸含量高达6159.48~6527.86μg/g麸皮。同时,阿魏酸主要存在于碱解的BBPA部分。在玉米品种中,香草酸及香豆酸依然有较高含量,分别为333.21~1488.72μg/g麸皮及432.41~452.99μg/g麸皮。肉桂酸在各品种中均有检出,这与可溶共价结合型的情况相同,含量48.43~307.79μg/g麸皮。
在束缚型酚酸中,肉桂酸衍生物的含量高于苯甲酸衍生物。含量最高的5种酚酸为阿魏酸1160.60~2038.12 μg/g麸皮、香草酸57.62~1488.72μg/g麸皮、香豆酸94.40~452.99μg/g麸皮、4-羟基苯甲酸67.14~392.09 μg/g麸皮、肉桂酸48.43~307.79μg/g麸皮。
2.5 总酚酸含量的对比
从图2可以看出,不同品种的谷物麸皮酚酸含量差异显著。含量在1316.37~9378.98μg/g麸皮。鲁丹781玉米中酚酸含量达到9378.98μg/g麸皮,而在定96-1甜荞中只有1316.37μg/g麸皮。总体来说,各品种酚酸含量大小顺序为玉米>小麦>燕麦>荞麦。束缚型酚酸的含量在总酚酸含量中显著高于其他部分,达到71.54%~95.63%。

表4 7种谷物麸皮束缚型酚酸含量Table 4 Contents of bound species of 8 PAs in different varieties of cereal branμg/g麸皮
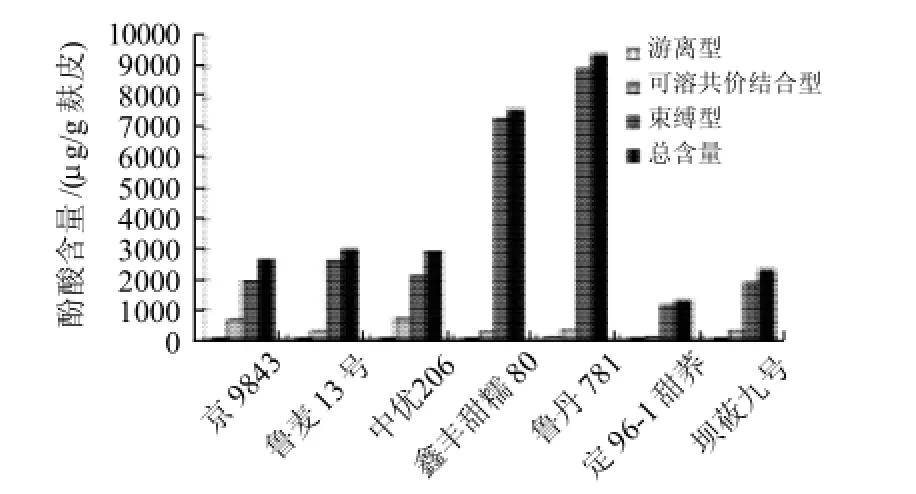
图2 7种谷物样品的各部分酚酸总含量的比较Fig.2 Comparisons of total contents of 3 respective species of 8 PAs in different varieties of cereal bran
3 结论与讨论
在对谷物麸皮中酚酸含量的测定中,测得所含酚酸含量由高到低的顺序为玉米、小麦、燕麦、荞麦;且束缚型酚酸是谷物麸皮中酚酸的主要存在形式;阿魏酸的含量显著高于其他酚酸。这与Adom等[12]及Verma等[13]得到研究的到的结论相同。而在实验组中,同一品种的不同样品之间表现出含量差异,这可能与实验材料的生长环境因素,成熟度有关。
同时从不同部位的酚酸含量上,碱解的部分要明显高于酸解部分,但是在某些样品中酸解时能够释放碱解时所不能得到的酚酸,例如小麦样品酸解可溶共价结合型部分中的香草酸。这说明,在具体实验过程中,需要根据所需酚酸种类的不同,来对酸解步骤进行取舍。
此外,在对谷物麸皮中酚酸的释放量上,本实验得到小麦麸皮中的阿魏酸含量(1160.60~2038.12μg/g麸皮)要略低于王萍等[14](3080μg/g麸皮)及王金等[15](2580 μg/g麸皮)测定的值;玉米麸皮中的阿魏酸含量(6159.48~6527.86μg/g麸皮)也低于罗艳铃等[16](14892μg/g麸皮)的报道结果。这可能与处理方法、样品种类、成熟度、干燥方式等有关。
[1]张东明. 酚酸化学[M]. 北京: 化学工业出版社, 2009.
[2]XU G H, YE X Q, CHEN J C, et al. Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 330-335.
[3]KIM K H, TSTO R, CUI S W, e t al. Pheonlic acid profiles and antioxidant activities of wheat bran extract and the effect of hydrolysis conditions[J]. Food Chemistry, 2006, 95: 466-473.
[4]HERRMANN K. Occurrence and content of hydroxycinnamic and hydroxybenzoic acid compounds in foods[J]. Critical Reviews in Food Science and Nutrition, 1989, 28: 315-347.
[5]王旭峰, 何计国, 陶纯洁, 等. 小麦麸皮的功能成分及加工利用现状[J]. 粮食与食品工业, 2006, 13(1): 19-22.
[6]LIU Ruihai. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46: 207-219.
[7]SHAHIDI F, NACZK M. Phenolics in food and nutraceuticals[M]. 2nd ed. NewYork: CRC Press, 2003.
[8]OUFNAC D S, XU Zhimin, SUN Ting, et al. Extraction of antioxidant from wheat bran using conventional solvent and microwave-assisted method[J]. Cereal Chemistry, 2007, 82(2): 125-129.
[9]ZHOU Zhongkai, ROBARDS K, HELLIWELL S, et al. The distribution of phenolic acids in rice[J]. Food Chemistry, 2004, 87: 401-406.
[10]ONYENEHO S N, HETTIARACHCHY N S. Antioxidant activity of durum wheat bran[J]. Journal of Agriculture and Food Chemistry, 1992, 40: 1496-1500.
[11]PETERSON D M. Oat antioxidants[J]. Journal of Cereal Science, 2001, 39(1): 115-129.
[12]ADOM K K, SORRELLS M E, LIU Ruihai. Phytochemical profiles and antioxidant activity of wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 7825-7834.
[13]VERMA B, HUCL P, CHIBBAR R N. Phenolic content and antioxidant properties of bran in 51 wheat culitvars[J]. Cereal Chem, 2008, 85 (4): 544-549.
[14]王萍, 葛丽花, 宋林平. 小麦麸皮阿魏酸的制备[J]. 粮油加工与食品机械, 2006(5): 68-70.
[15]王金, 吴向阳, 陈荣华, 等. 碱解小麦麦麸制备阿魏酸的工艺条件研究[J]. 食品科技, 2008(4): 107-109.
[16]罗艳玲, 欧仕益. 碱解玉米皮制备阿魏酸的研究[J]. 中国食品学报, 2007, 7(5): 97-101.
RP-HPLC Analysis of Phenolic Acids in Different Varieties of Cereal Bran
HAO Jie,ZHANG Chang-hong,CAO Xue-li*
(Beijing Key Laboratory of Plant Resources Research and Development, College of Chemical and Environmental Engineering, Beijing Technology and Business University, Beijing 100048, China)
Eight phenolic acids (PAs) in different varieties of cereal bran including 3 wheat cultivars, 2 corn cultivars, 1 oat cultivar and 1 buckwheat cultivar were determined by the developed RP-HPLC method. Meanwhile, the differences in the contents of each PA and total PAs among the cereal bran materials were statistically analyzed. Results showed that the total PA contents in different varieties of cereal bran decreased in the following order: corn>wheat>buckwheat>oat. Bound PAs were the predominant PAs in the 4 varieties of cereal bran, of which, cinnamic acid exhibited a much higher content than benzoic acid. Of free and soluble covalent PAs, 4-hydroxybenzoic and vanilla acids both exhibited a higher content. Of bound PAs, the highest content of ferulic acid was observed in all the varieties of cereal bran and reached up to 6527.86 μ g/g corn bran.
cereal bran;phenolic acid;reversed-phase high performance liquid chromatography (RP-HPLC)
O625.54
A
1002-6630(2010)10-0263-05
2009-08-05
郝杰(1984—),男,硕士研究生,研究方向为生物分离工程。E-mail:crab_susu@yahoo.com.cn
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离技术。E-mail:caoxl@th.btbu.edu.cn

